Применение алпелисиба при метастатическом эстроген-рецептор-положительном HER2/neu-негативном раке молочной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
На долю гормонозависимого эстроген-рецептор-положительного (ЭР+) HER2/neu-негативного (HER2-) рака молочной железы (РМЖ) приходится около 70% всех случаев [1, 2]. Метастатический РМЖ (мРМЖ) представляет собой хроническое неизлечимое заболевание, лечение которого направлено на продление жизни при сохранении ее удовлетворительного качества, контроль над симптомами и предотвращение осложнений [3].
Мутация гена PIK3CA встречается у 28–46% больных гормонозависимым (HR+) HER2- мРМЖ. Она вызывает гиперактивацию фосфатидилинозитол-3-киназы (PI3K), что приводит к активации сигнального пути PI3K/Akt/mTOR и стимулирует рост и деление раковых клеток [4]. Мутация PIK3CA служит неблагоприятным прогностическим фактором, ассоциируется с быстрым прогрессированием заболевания и сокращением продолжительности жизни [5]. Резистентность к гормонотерапии требует поиска новых терапевтических опций.
Алпелисиб – единственный на сегодняшний день ингибитор PI3K, успешно прошедший клинические испытания и одобренный для лечения ЭР+ HER2- мРМЖ у больных с мутацией PIK3CA, ранее получавших гормонотерапию. Его применение в комбинации с фулвестрантом показано для лечения женщин в постменопаузе и мужчин с HR+ HER2- рРМЖ или мРМЖ с мутацией гена PIK3CA с прогрессированием заболевания во время или после проведения эндокринной терапии. Данное показание к применению было установлено на основании результатов рандомизированного клинического исследования III фазы SOLAR-1, в ходе которого оценивали эффективность алпелисиба, добавленного к фулвестранту, в широкой когорте пациенток. У пациенток с мутацией гена PIK3CA выявлено достоверное преимущество в отношении выживаемости без прогрессирования (ВБП): медиана ВБП составила 11,0 месяца в группе алпелисиба и 5,7 месяца в группе плацебо (относительный риск (ОР) 0,65; 95%-ный доверительный интервал (ДИ) 0,5–0,85); p < 0,001 [6].
В последние годы наметилась тенденция к интеграции ингибиторов циклин-зависимых киназ (иCDK4/6) преимущественно в схемы ранних линий гормонотерапии. Таким образом, в реальной клинической практике появляется подгруппа пациенток, которые в первой линии терапии получали иCDK4/6 в комбинации с ингибиторами ароматазы, а во второй – фулвестрант.
В открытом исследовании II фазы BYLieve оценивали эффективность комбинации алпелисиба и фулвестранта во второй линии терапии у пациенток, ранее получавших ингибиторы ароматазы в комбинации с иCDK4/6 [7]. Несмотря на то что мРМЖ с мутацией гена PIK3CA характеризуется более агрессивным течением, комбинация алпелисиба и фулвестранта, назначенная после прогрессирования на терапии иCDK4/6 и ингибиторами ароматазы, обеспечила медиану ВБП 7,3 месяца [7].
Таким образом, при непрямом сравнении с результатами эффективности других видов терапии комбинация алпелисиба и фулвестранта ассоциируется с более чем двукратным увеличением медианы ВБП [8]. Результаты исследований SOLAR-1 и BYLieve продемонстрировали не только эффективность препарата, но и новые, свойственные этой терапии виды токсичности. На сегодняшний день разработаны рекомендации по профилактике и лечению наиболее частых нежелательных явлений, позволяющие использовать препарат максимально безопасно [9].
Клинический случай
Женщина, 63 года. В феврале 2018 г. обнаружила уплотнение в левой молочной железе. Обратилась в онкологический диспансер. При проведении маммографии обнаружен рак левой молочной железы с метастазами в подмышечных лимфоузлах слева. Ультразвуковое исследование (УЗИ) периферических лимфоузлов показало поражение подключичных, подмышечных лимфоузлов слева. Цитологически – из пунктата левого подмышечного лимфоузла выделены структуры карциномы неспецифического типа, пунктата подключичного лимфоузла слева – эритроциты, жировая клетчатка. В марте 2018 г. данными компьютерной томографии (КТ) грудной клетки подтверждены метастазы в подмышечных лимфоузлах слева. Метастатического поражения легких не выявлено. Гистологически – картина низкодифференцированной инвазивной карциномы. Иммунофенотипирование: экспрессия прогестерона в единичных клетках, экспрессия эстрогена – 8 баллов (интенсивное ядерное окрашивание в 99% опухолевых клеток); статус HER2/neu отрицательный – 0 (Ventana).
Проведено восемь курсов неоадъювантной полихимиотерапии (четыре курса по схеме АС (доксорубицин, циклофосфамид) + четыре курса монохимиотерапии доцетакселом). Лечение завершено в августе 2018 г.
На контрольном обследовании в ходе маммографии отмечалась частичная регрессия опухоли (выраженное уменьшение размеров первичной опухоли и пораженных подмышечных лимфоузлов).
17 августа выполнена операция – радикальная резекция левой молочной железы. Результаты гистологии (операционный материал): рак левой молочной железы (инвазивная карцинома неспецифического типа). Лечебный патоморфоз 1-й степени. 8500/3, стадия pTNM по классификации AJCC-2009 (7-е изд.): уpT1 N1 (2/11 л/у) R0 Pn0 L1 V0.
С сентября по ноябрь 2018 г. проведен курс дистанционной лучевой терапии с послеоперационной целью. Лечение проводилось на линейном ускорителе Varian TrueBEAM с применением таких технологий, как IMRT, IGRT, плоскостной и объемной визуализацией мишени. Объемы облучения: CTVhigh – оставшаяся часть левой молочной железы, CTVmed – надключичные, подключичные, подмышечные лимфоузлы слева, CTVlow – парастернальные лимфоузлы слева, boost на ложе опухоли – 10 Гр. За курс лечения на предписанные объемы подводились дозы: PTVhigh 50 Гр – 25 фракций, PTVboost 10 Гр – 5 фракций (суммарно 60 Гр на ложе опухоли), PTVmed 50 Гр – 25 фракций, PTVlow 46 Гр – 23 фракции.
Адъювантная гормональная терапия (тамоксифен 20 мг/сут внутрь ежедневно) начата в октябре 2018 г. Осложнений не зафиксировано.
В октябре 2020 г. пациентка заметила появление опухолевидного образования в правой надключичной области. КТ показала появление в правой надключичной области лимфоузлов до 14 мм в диаметре с выраженной перифокальной инфильтрацией жировой клетчатки. В легких и в костях метастазов не выявлено.
13 октября 2020 г. выполнена операция по иссечению новообразования в правой надключичной области. Гистологически – метастаз РМЖ в правом надключичном лимфоузле. Иммуногистохимическое исследование метастатической опухоли в надключичном лимфатическом узле на парафиновых срезах: экспрессия рецепторов эстрогена – 7 баллов (умеренной интенсивности ядерное окрашивание около 99% клеток опухоли), прогестерона – 8 баллов (интенсивное ядерное окрашивание около 99% клеток опухоли). Уровень экспрессии HER2/neu – 0. Индекс пролиферативной активности по экспрессии Ki-67 – около 60–70%.
УЗИ периферических лимфоузлов после операции: признаки подключичной лимфоаденопатии слева. Небольшие жидкостные образования правой надключичной области (послеоперационные серомы). Одиночная надключичная лимфоаденопатия справа. Признаки единичной шейно-надключичной лимфоаденопатии справа.
Назначена первая линия мРМЖ – иCDK4 и иCDK6 в составе комбинированной терапии с ингибитором ароматазы.
С 30 октября 2020 г. пациентка начала прием препаратов рибоциклиб 600 мг/сут внутрь (1–21-й дни с семидневным перерывом, цикл 28 дней) и анастрозол 1 мг мг/сут (ежедневно).
После четырех месяцев терапии, в феврале 2021 г. появились жалобы на одышку при ходьбе.
УЗИ плевральных полостей: в левой плевральной полости свободная жидкость толщиной около 86 мм. Выполнен торакоцентез слева. Цитологически из осадка плевральной жидкости – метастатическая карцинома молочной железы.
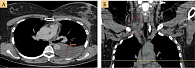
КТ, выполненная в феврале 2021 г., показала наличие в структуре левой молочной железы образования неправильной формы, размером 22 × 25 мм (рецидив). В подмышечной области справа лимфоузел размером 9 × 4 мм, равномерно накапливающий контрастное вещество. Слева в верхней доле по междолевой плевре образование размером 4 × 13 мм, в S3 образование размером 5,6 мм, в нижней доле S8 очаговое образование 4 мм. В периферических отделах S8 правого легкого очаговое образование 5,5 мм (рис. 1).
Установлен диагноз: рак левой молочной железы, стадия IIIа, рТ1сN2аМ0 С 50.4 (верхненаружный квадрант). Рецидив. Метастазы в надключичных лимфоузлах справа, медиастинальных лимфоузлах, легких. Канцероматозный плеврит. Первичная гормонорезистентность.
В феврале 2021 г. начата вторая линия терапии метастатического процесса – монохимиотерапия эрибулином. Клинически пациентка отмечала улучшение – одышка уменьшилась.
Результаты УЗИ (май 2021 г.) периферических лимфоузлов после пяти курсов монохимиотерапии: гиперплазия подмышечных лимфоузлов с обеих сторон. КТ (май 2021 г.): склеротические изменения жировой клетчатки надключичной области справа. Очаговые изменения в легких без динамики, образование в левой молочной железе без динамики, подмышечный лимфоузел справа без динамики.
Результаты исследования расценены как стабилизация на фоне проводимого лечения, рекомендовано продолжение терапии с оценкой эффекта через три месяца. От продолжения лечения пациентка отказалась в связи с выраженными побочными явлениями (периферическая полинейропатия 2-й степени). Все риски прерывания лечения разъяснены, отказ от лечения подписан.
Молекулярно-генетическое тестирование от 20 июня 2021 г.: мутация в гене PIK3CA (экзоны 7 (кодон 420), 9, 20). Мутация в гене PIK3CA, обнаружена мутация Q546R.
В течение трех месяцев пациентка не получала противоопухолевой терапии. В июле 2021 г. появились тянущие боли в левой молочной железе и надключичных областях с обеих сторон и одышка при умеренной физической нагрузке. Состояние по ECOG – 1. Тем не менее на КТ динамических изменений по сравнению с данными исследования, проведенного в мае 2021 г., не обнаружено.
В августе 2021 г. пациентка согласилась продолжить лечение. Начата третья линия терапии по схеме: алпелисиб 300 мг внутрь один раз в сутки во время еды в комбинации с фулвестрантом 500 мг внутримышечно один раз в 28 дней (с нагрузочной дозой 500 мг внутримышечно один раз в 14 дней в первый месяц лечения). Сопутствующая терапия: назначен профилактический прием цетиризина 10 мг внутрь один раз в день. Через 14 дней приема алпелисиба пациентка отмечала уменьшение болевого синдрома и одышки при физической нагрузке.
После месяца терапии жалобы отсутствовали, боль и одышка полностью купированы. С восьмого дня приема алпелисиба возникли нежелательные явления – единичные высыпания на коже лица и волосистой части головы. В местах высыпаний зуда не было, дополнительное лечение не назначалось. На 13-й день терапии отмечалось повышение уровня глюкозы крови до 6,2 ммоль/л на фоне диеты со сниженным потреблением сладкого. На 27-й день терапии уровень глюкозы снизился до 6,0 ммоль/л без коррекции. На 28-й день увеличились единичные высыпания на коже лица и волосистой части, беспокойства не вызывали. На 56-й день терапии высыпаний на коже не обнаружено, глюкоза крови в пределах нормы, цетиризин отменен.
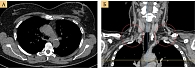
КТ в декабре 2021 г. (после четырехмесячной терапии): полная регрессия опухоли по критериям RECIST 1.1 (рис. 2).
К настоящему моменту пациентка получает терапию алпелисибом и фулвестрантом уже семь месяцев. Состояние по ECOG – 0. На контрольном обследовании сохраняется полная регрессия опухоли. С третьего месяца терапии нежелательных явлений не наблюдалось. Пациентка ведет активный образ жизни, социально активна, продолжает работать. Планируется продолжить терапию алпелисибом в комбинации с фулвестрантом до прогрессирования заболевания или появления непереносимой токсичности с оценкой эффективности каждые три месяца.
Обсуждение
Рассмотренный клинический случай иллюстрирует потенциальный благоприятный эффект в отношении отдаленных результатов лечения при назначении алпелисиба в комбинации с фулвестрантом пациентке с метастатическим ЭР+ HER2/neu- РМЖ с мутацией в гене PIK3CA. Пациентка продолжает получать алпелисиб и фулвестрант в течение семи месяцев. Отмечается полная регрессия опухоли. Данное лечение позволяет не только продлить время до прогрессирования заболевания, но также значительно увеличить медиану общей выживаемости, сохранить качество жизни и социальный статус.
Путь PI3K/AKT/mTOR играет одну из ключевых ролей в регулировании пролиферации, роста и выживания клеток. Очевидно, такой путь служит привлекательной мишенью для таргетной противоопухолевой терапии. Разработан и изучается ряд терапевтических стратегий при мРМЖ, направленных на три важнейших участка на этом сигнальном пути. PI3K (фосфатидил-инозитол-3-киназы) представляют собой семейство липидкиназ. Стимуляция рецепторной тирозинкиназы запускает активацию PI3K. Мутация PIK3CA приводит к неконтролируемому росту, пролиферации и выживанию клеток [10]. Установлено, что мутация PIK3CA – одна из наиболее частых соматических мутаций при РМЖ [11] и выявляется примерно в 20–50% всех случаев, чаще при ЭР+ HER2- и HER2+ подтипах – 35–40 и 23% случаев соответственно [10, 12].
Крупный метаанализ клинических исследований (n = 1929) роли мутационного статуса PIK3CA при РМЖ как прогностического фактора и предиктора ответа на лечение показал, что наличие мутации PIK3CA ассоциируется с повышенным риском рецидива, прогрессирования или смерти (ОР 1,67; 95% ДИ 1,15– 2,43; p = 0,007) [13].
Алпелисиб – первый и единственный таргетный препарат для лечения мРМЖ с мутацией гена PIK3CA. Его применение в комбинации с фулвестрантом показано для лечения женщин в постменопаузе и мужчин с HR+ HER2- рРМЖ или мРМЖ с мутацией в гене PIK3CA с прогрессированием заболевания во время или после проведения эндокринной терапии. Данное показание к применению было определено на основании результатов рандомизированного клинического исследования III фазы SOLAR-1, в ходе которого оценивали эффективность алпелисиба, добавленного к фулвестранту, в широкой когорте пациенток [6]. На фоне применения комбинации алпелисиба и фулвестранта отмечалось увеличение медианы общей выживаемости пациенток с мутацией гена PIK3CA на 7,9 месяца (39,3 vs 31,4 месяца; ОР 0,86; 95% ДИ 0,64–1,15; p = 0,15). Различия не достигли статистической достоверности, тем не менее выигрыш в абсолютных цифрах был клинически значимым. В подгруппе пациенток с метастазами в печени и в легких добавление алпелисиба к гормонотерапии фулвестрантом способствовало увеличению медианы общей выживаемости более чем на год – 14,4 месяца (37,2 vs 22,8 месяца; ОР 0,68; 95% ДИ 0,46–1,00) [14]. В SOLAR-1 в качестве предшествующей терапии только 5,9% больных получали иCDK4/6. Медиана ВБП у них составила 5,5 месяца при использовании комбинации алпелисиба и фулвестранта против 1,8 месяца на фоне применения фулвестранта [6, 14].
В исследовании BYLieve оценивали эффективность комбинации алпелисиба и гормонотерапии у больных с мутацией PIK3CA, получавших ранее иCDK4/6 [15]. В исследование было включено несколько когорт: когорта A – больные, получавшие иCDK4/6 и ингибитор ароматазы в качестве предшествующей терапии; когорта B – пациенты, ранее получавшие иCDK4/6 + фулвестрант; когорта C – пациенты, у которых наблюдалось прогрессирование заболевания во время и после применения ингибитора ароматазы и которые получали химио- или гормонотерапию в качестве предшествующего лечения. Среди 121 больного в когорте A (алпелисиб + фулвестрант) частота объективного ответа составила 17,4%, стабилизация – 45,5%, прогрессирование – 11,6%. Достигнута первичная конечная точка – шестимесячная ВБП: 50,4% (95% ДИ 41,2–59,6) пациентов живы без признаков прогрессирования заболевания спустя шесть месяцев, медиана ВБП составила 7,3 месяца [15]. Результаты исследования BYLieve свидетельствуют о необходимости проведения таргетной терапии алпелисибом и гормонотерапии после применения иCDK4/6.
В рандомизированном клиническом исследовании SOLAR-1 медиана относительной интенсивности дозы достигла 82,7%, отмена терапии из-за возникновения нежелательных явлений имела место в 25,4% случаев. Редукция дозы потребовалась 62,1% пациенток [6]. При этом снижение дозы или отмена препарата влияли на эффективность лечения [9]. С учетом механизма действия алпелисиба наиболее частыми нежелательными эффектами, приводящими к отмене препарата или редукции дозы, являются гипергликемия, сыпь и диарея. О них должны быть предупреждены все пациенты. Перед назначением препарата крайне важны тщательный отбор больных с оценкой исходного уровня гликозилированного гемоглобина (HbA1c), глюкозы у всех пациентов, индекса массы тела, мониторинг уровня глюкозы в зависимости от факторов риска, а при повышении уровня глюкозы – назначение метформина – патогенетического препарата для купирования гипергликемии, связанной с блокадой пути PI3K/АКТ/ mTOR, при необходимости – консультация эндокринолога [16]. Все пациенты с целью профилактики должны получать антигистаминные препараты для предупреждения сыпи [17]. В случае диареи им назначают лоперамид при более чем одном-двух эпизодах жидкого стула в день. При возникновении нежелательных явлений высокой степени тяжести приостанавливают прием или снижают дозу препарата до их разрешения. Расширение опыта применения препарата и отбор больных способствуют уменьшению частоты прекращения приема из-за нежелательных явлений. Так, в исследовании SOLAR-1 препарат был отменен у 25% пациентов, а в BYLieve, которое проводилось позже, – у 20,5%. Реже случались отмены из-за гипергликемии: 6,3 и 1,6% случаев соответственно [6, 14, 15].
Следует отметить, что терапия алпелисибом удовлетворительно переносится пациентами и приводит к значительному увеличению ВБП и общей выживаемости по сравнению с другими методами лечения.
Спектр нежелательных явлений в рассмотренном клиническом случае позволил сохранить качество жизни и социальный статус пациентки на протяжении всего периода лечения [9].
Заключение
На современном этапе алпелисиб в комбинации с фулвестрантом является препаратом выбора при ЭР+ HER2/neu- РМЖ с мутацией в гене PIK3CA. С внедрением алпелисиба не только расширились возможности нехимиотерапевтических вариантов лечения для прогностически неблагоприятной категории пациентов, но и наметилась тенденция к использованию персонализированной медицины и таргетной терапии [18].
D.Yu. Yukalchuk, D.M. Ponomarenko, T.N. Yukalchuk, S.S. Sidorova, A.V. Shevchuk, A.M. Novopashin
District Oncologic Dispensary, Irkutsk
Contact person: Denis Yu. Yukalchuk, dyuyu558@mail.ru
The clinical case presented in the article demonstrates the effectiveness of orange in combination with fulvestrant in metastatic estrogen receptor-positive HER2/neu-negative breast cancer with a mutation in the PIK3CA gene. The resistance of hormone therapy requires the search for new therapeutic options. The results of the SOLAR-1 and BYLieve studies have shown not only the effectiveness of alpelisib, but also new types of toxicity characteristic of this therapy. At the moment, recommendations have been developed for the prevention and treatment of the most frequent adverse events, allowing the drug to be used as safely as possible. With the introduction of alpelisib, the possibilities of non-chemotherapeutic treatment options for prognostically unfavorable patients have not only expanded, but there has also been a trend towards the use of personalized medicine and targeted therapy.

