Применение лечебного пластыря с лидокаином (Версатис) при миофасциальных болях
- Аннотация
- Статья
- Ссылки
Цель настоящего исследования заключалась в сравнении эффектов наложения лечебного пластыря с лидокаином, пластыря с плацебо, а также инъекции анестетика (инфильтрация) в место локализации боли при симптомах МБС с точки зрения боли, нетрудоспособности и местной реакции гиперчувствительности в зоне наложения, а также в определении переносимости лечебного пластыря с лидокаином пациентами. Случайным образом были отобраны пациенты, которые прошли один из трех курсов лечения:
1) в течение 4 дней на болевую зону накладывался лечебный пластырь с лидокаином (с заменой каждые 12 часов; общая суточная доза 350 мг);
2) в течение 4 дней на болевую зону накладывался пластырь плацебо (с заменой каждые 12 часов);
3) проводилась инфильтрация болевой зоны при помощи двух инъекций 0,5-процентного хлоргидрата бупивакаина объемом 1 мл, вводимого с интервалом в 2 суток.
Лечение с использованием пластырей было двойным слепым, в то время как инъекционное лечение было односторонне слепым. Перед началом, во время и после лечения с использованием визуальной аналоговой шкалы (ВАШ) были зарегистрированы количество приступов боли, интенсивность боли в состоянии покоя и при движении, взаимосвязь боли с дневной активностью, работой, настроением и качеством жизни. Перед началом терапии (День 1) и на 5 и 9 дни были оценены надавливание и пороги болевой чувствительности кожи, подкожного слоя и мышц при воздействии электрическим током на болевую зону, зону наблюдения и безболезненную зону. Для оценки дискомфорта от терапии использовалась ВАШ. Кроме того, каждому пациенту был выдан дневник для записи запросов на дополнительное лечение (в случае необходимости) и побочных явлений.
В исследовании приняли участие шестьдесят пациентов (46 женщин и 14 мужчин) в возрасте от 19 до 76 лет. Средний (среднеквадратическое отклонение) возраст составил 46,88 (15,37) лет, а средний (среднеквадратическое отклонение) вес – 69,58 (13,94) кг. В каждую группу лечения вошли по двадцать пациентов. При использовании плацебо субъективные симптомы не изменились, однако значительно уменьшились по отношению к исходному этапу при использовании лечебного пластыря с лидокаином и инфильтрации (в обоих случаях p < 0,001). При использовании пластыря плацебо пороги болевой чувствительности не изменились, однако значительно увеличились при использовании медицинского пластыря с лидокаином и инфильтрации (у всех p < 0,001); при инфильтрации эффекты по триггерным зонам и зонам наблюдения были выше. При инфильтрации дискомфорт от терапии был выше, чем при использовании лечебного пластыря с лидокаином. Дополнительное лечение потребовалось только тем пациентам, которые входили в группу, где применялось плацебо (p < 0,001). Ни в одной из групп побочных эффектов не наблюдалось.
Вывод: лечебные пластыри с лидокаином доказали свою эффективность и широко использовались пациентами с МБС и гиперчувствительностью в зоне наложения пластыря. Результаты рандомизированного, контролируемого исследования, в котором сравниваются применение лечебного пластыря с лидокаином, пластыря плацебо и инъекции анестетиков для лечения болей у пациентов с миофасциальным болевым синдромом (оценка боли и порогов соматической болевой чувствительности) опубликованы в журнале «Клиническая терапия». 2009; 31: 705-720. © 2009 Excerpta Medica Inc.
Цель настоящего исследования заключалась в сравнении эффектов наложения лечебного пластыря с лидокаином, пластыря с плацебо, а также инъекции анестетика (инфильтрация) в место локализации боли при симптомах МБС с точки зрения боли, нетрудоспособности и местной реакции гиперчувствительности в зоне наложения, а также в определении переносимости лечебного пластыря с лидокаином пациентами. Случайным образом были отобраны пациенты, которые прошли один из трех курсов лечения:
1) в течение 4 дней на болевую зону накладывался лечебный пластырь с лидокаином (с заменой каждые 12 часов; общая суточная доза 350 мг);
2) в течение 4 дней на болевую зону накладывался пластырь плацебо (с заменой каждые 12 часов);
3) проводилась инфильтрация болевой зоны при помощи двух инъекций 0,5-процентного хлоргидрата бупивакаина объемом 1 мл, вводимого с интервалом в 2 суток.
Лечение с использованием пластырей было двойным слепым, в то время как инъекционное лечение было односторонне слепым. Перед началом, во время и после лечения с использованием визуальной аналоговой шкалы (ВАШ) были зарегистрированы количество приступов боли, интенсивность боли в состоянии покоя и при движении, взаимосвязь боли с дневной активностью, работой, настроением и качеством жизни. Перед началом терапии (День 1) и на 5 и 9 дни были оценены надавливание и пороги болевой чувствительности кожи, подкожного слоя и мышц при воздействии электрическим током на болевую зону, зону наблюдения и безболезненную зону. Для оценки дискомфорта от терапии использовалась ВАШ. Кроме того, каждому пациенту был выдан дневник для записи запросов на дополнительное лечение (в случае необходимости) и побочных явлений.
В исследовании приняли участие шестьдесят пациентов (46 женщин и 14 мужчин) в возрасте от 19 до 76 лет. Средний (среднеквадратическое отклонение) возраст составил 46,88 (15,37) лет, а средний (среднеквадратическое отклонение) вес – 69,58 (13,94) кг. В каждую группу лечения вошли по двадцать пациентов. При использовании плацебо субъективные симптомы не изменились, однако значительно уменьшились по отношению к исходному этапу при использовании лечебного пластыря с лидокаином и инфильтрации (в обоих случаях p < 0,001). При использовании пластыря плацебо пороги болевой чувствительности не изменились, однако значительно увеличились при использовании медицинского пластыря с лидокаином и инфильтрации (у всех p < 0,001); при инфильтрации эффекты по триггерным зонам и зонам наблюдения были выше. При инфильтрации дискомфорт от терапии был выше, чем при использовании лечебного пластыря с лидокаином. Дополнительное лечение потребовалось только тем пациентам, которые входили в группу, где применялось плацебо (p < 0,001). Ни в одной из групп побочных эффектов не наблюдалось.
Вывод: лечебные пластыри с лидокаином доказали свою эффективность и широко использовались пациентами с МБС и гиперчувствительностью в зоне наложения пластыря. Результаты рандомизированного, контролируемого исследования, в котором сравниваются применение лечебного пластыря с лидокаином, пластыря плацебо и инъекции анестетиков для лечения болей у пациентов с миофасциальным болевым синдромом (оценка боли и порогов соматической болевой чувствительности) опубликованы в журнале «Клиническая терапия». 2009; 31: 705-720. © 2009 Excerpta Medica Inc.



Миофасциальный болевой синдром (МБС) – это местный болевой синдром, вызванный активацией триггерных точек ≥ 1 в мышцах или фасциях мышц. Триггерная точка – это зона повышенной раздражимости и сильной чувствительности в напряженной, пальпируемой группе мышечных волокон. При пальпации с похлопыванием болевая зона является промежуточным звеном реакции местных мышечных сокращений и при местной стимуляции путем надавливания или введения иглы вызывает боль, слабость, вегетативные явления, а также двигательную дисфункцию, не только в зоне наблюдения, но также на расстоянии (иррадиирующая боль) от нее, и эта зона является специфичной и характерной для каждой мышцы (1-3).
Клиническая терапия
МБС оказывает значительное эпидемиологическое влияние (4, 5). Р. Беннетт указал на наличие у почти 44 млн жителей США активных миофасциальных триггерных точек (6). Многочисленные исследователи пришли к выводу о том, что частота случаев МБС у пациентов, жалующихся на боль в опорно-двигательном аппарате, как рассеянную, так и локализованную, составляет ~30% в терапевтической практике и от 55% до 95% в специализированной практике лечения боли (6-9). Эпидемиологические исследования показали, что МБС, как правило, существует одновременно с другими болезненными состояниями (например, фибромиалгия, головная боль, боль в спине, боль в шее и височно-нижнечелюстной области, висцеральные болевые синдромы) и зачастую вызывает обострения типичных симптомов этих состояний (6, 10-17).
МБС самостоятельно или совместно с другими вызывающими боль синдромами становится причиной нетрудоспособности не только из-за боли, но также из-за слабости и сильного ограничения движения задействованных мышц (18). В результате пациенты могут испытывать ухудшение состояния при выполнении работы или социальной активности, а также ухудшение качества жизни (3).
Раннее распознание и лечение МБС важно не только для облегчения симптомов у пациентов, но также для предупреждения нетрудоспособности, которая может возникнуть при отсутствии лечения. Для МБС разработано несколько терапевтических подходов (например, растяжение и опрыскивание, массаж/ишемическая компрессия, теплая аппликация), однако золотым стандартом лечения являются местные инъекции в болевые зоны с использованием либо сухих игл, либо инъекций активных веществ (как правило, местных анестетиков) в сочетании с определением и устранением повторяющихся факторов (например, неправильное положение тела) (4, 5, 19-23). Несмотря на свою эффективность подход, основанный на введении игл, может быть очень неприятным для пациента и требует вмешательства врача.
Первостепенная задача настоящего исследования заключалась в сравнении эффектов локального наложения лечебного пластыря с лидокаином, пластыря плацебо, а также инъекции анестетика (инфильтрация) в место локализации боли при симптомах МБС с точки зрения боли, нетрудоспособности и местной реакции гиперчувствительности (24). Эффективность лечения оценивалась не только исходя из спонтанности боли и симптомов нетрудоспособности, но также исходя из изменений чувствительности в болезненных и неболезненных участках, потому что, как показали предыдущие исследования (15, 25-30), болевые зоны и зоны наблюдения – но не безболезненные (контролируемые) зоны – являются местами гипералгезии. К этим местам относится кожа, подкожный слой и мышцы в болевой зоне, а также подкожный слой и мышцы на уровне наблюдения, при этом имеется возможность распространения на кожу, если речь идет о болевых зонах с повышенной раздражительностью, что подтверждается значительным уменьшением порогов болевой чувствительности по отношению к различным раздражителям (например, надавливание, электрический ток) (15, 25-30). Второстепенной задачей была оценка степени переносимости лечебного пластыря с лидокаином пациентами и, в частности, определение того, вызвал ли лечебный пластырь с лидокаином меньше дискомфорта, чем инфильтрация.
Материалы и методы исследования
Пациенты. Все пациенты, участвовавшие в настоящем исследовании, страдали МБС и прошли лечение в Центре исследования фибромиалгии и патологий опорно-двигательного аппарата, Департамент медицины и науки о старении, в Университете Габриэле Д’Аннунцио (Кьети, Италия). Для участия были отобраны пациенты в возрасте от 18 до 80 лет (обоих полов).
Критериями отбора служили периодическая повторяемость заболевания или хронические локальные боли в области опорно-двигательного аппарата, вызванные активацией триггерных точек, что было подтверждено при медицинском осмотре (диагностика МБС в соответствии с клиническими критериями Симона (31); появление симптомов МБС за 30-50 дней до осмотра; средняя интенсивность спонтанной мышечной боли ≥ 40 мм по визуальной аналоговой шкале (ВАШ) Скотта–Хаскиссона (32) в течение предыдущих 4 дней; отсутствие истории жалоб на другие боли в области опорно-двигательного аппарата, отличные от МБС (например, фибромиалгия, синдром хронической усталости), ревматизм или аритмии; отсутствие неврологических/психоневрологических состояний или интеллектуальных расстройств, которые могли бы помешать правильному проведению анализов на чувствительность; отсутствие истории о каких-либо состояниях, которые мешают проверке чувствительности к восприятию соматической боли – например, гипертензия, сахарный диабет (28, 33-35), отсутствие ранее зарегистрированных случаев аллергии на местные анестетики; фармакологическое промывание ≥ 72 часа для центральных анальгетиков, нестероидных противовоспалительных препаратов (NSAID) и антидепрессантов и ≥ 30 дней для применяемых системных кортикостероидов до проведения оценки чувствительности; отрицательный тест на беременность для женщин детородного возраста; а также информированное, письменное согласие на участие в исследовании (полученное после проверки всех предшествующих критериев отбора и перед началом любой процедуры исследования).
Для каждого пациента были выбраны 2 участка для проведения лечения: 1 триггерная точка (наиболее активная, определенная при помощи клинических процедур стимуляции) и 1 безболезненная (контролируемая) точка (локализованная на теле за пределами болевой зоны и зоны наблюдения, на которой во время проведения медицинского осмотра не было выявлено никаких скрытых миофасциальных болевых зон) (29).
План исследования
На исходном этапе (день 1) все пациенты прошли оценку по следующим параметрам:
- интенсивность боли в состоянии покоя и боль при движении с участием рассматриваемых мышц (ВАШ, средний показатель боли по сравнению с предшествующими 4 днями);
- нетрудоспособность, возникшая в результате болевых симптомов (измеряется, исходя из взаимосвязи боли с привычной дневной активностью, работой, настроением и качеством жизни (специальные ВАШ) (описание см. подробнее в Оценке субъективных симптомов); средний показатель за последние 4 дня (32);
- количество приступов резкой боли в течение последних 4 дней;
- пороги болевой чувствительности при стимуляции надавливанием на триггерную точку, зону наблюдения и безболезненную зону;
- пороги болевой чувствительности при электростимуляции кожи, подкожного слоя и мышц на уровне триггерной точки, зоны наблюдения и безболезненной зоны (15, 25). Исследования всегда проводились утром (10:00-12:00) и в одну и ту же относительную фазу менструального цикла (фолликулиновая фаза) для женщин репродуктивного возраста.
Пациенты были отобраны случайным образом и распределены по 3 группам лечения (20 пациентов на группу). Список случайно отобранных пациентов был составлен администратором данных, назначенным для проведения этого исследования, с использованием специального макроса SAS (SAS Institute Inc., Кэри, шт. Северная Каролина) для групп из 6 пациентов. Группа I получила пластыри с 5%-ным лидокаином на 4 дня (Дни 2-5), группа II получила пластыри с плацебо (повязки с подходящей средой, содержащие те же наполнители, что и активные повязки) на 4 дня (Дни 2-5), а группа III получила два инъекции по 1 мл 0,5%-ного хлоргидрата бупивакаина в день рандомизации (День 2) и спустя 2 дня (День 4). Все оценки (симптомы боли, нетрудоспособность, чувствительность в ретенционной зоне) были повторены на 5 день (спустя 12 часов после снятия последней повязки) и на 9 день (после 4 дней контроля). Оценка дискомфорта, связанного с лечением, была произведена на 5 день (специальная ВАШ).
В конце исследования (День 9), если предшествующее купирование боли было неудовлетворительным, всем пациентам было разрешено попросить получения либо дополнительного получения стандартного лечения анальгетиками (2 инфильтрации бупивакаина с интервалом в 2 дня).
Лечение с использованием лечебных пластин с лидокаином и плацебо было двойным слепым. Лечение инфильтрацией было односторонне слепым, поскольку эквивалента плацебо не существует (прокалывание сухими иглами и инъекция солевого раствора считаются методами терапии болевых зон) (3). С другой стороны, в аналогичном исследовании (15) был сделан вывод о том, что введение иглы рядом с болевой зоной (лечение, аналогичное применению плацебо) было неэффективным в плане облегчения как боли, так и изменений чувствительности в болевой зоне и зоне наблюдения. По этическим соображениям (т.е. утаивание соответствующей терапии от дополнительных пациентов) группа, где применялось бы плацебо, и в которую входили бы противники инфильтрации, в настоящем исследовании не участвовала. Для контроля терапии и обработки посещений пациентов/оценок были приглашены различные исследователи; от исследователя, обслуживающего пациентов, лечение было скрыто.
Пациентов попросили записать все побочные явления терапии за весь 9-дневный период исследования. В инструкциях, предоставленных пациентам, было указано, чтобы пациенты отметили любые необычные (местные или общие) изменения в состоянии своего здоровья (помимо боли, связанной с МБС), даже если они не были уверены в том, что эти изменения были связаны именно с получаемым ими лечением. Их попросили записать дату и время появления изменений, описать осложнение, указать продолжительность осложнения, а также незамедлительно сообщить об осложнении лицу, проводящему исследование.
Кроме того, пациенты были проинформированы о том, что им разрешается отказаться от участия в исследовании в любое время и по любой причине, без уплаты штрафных санкций, и что в случае необходимости они будут обеспечены альтернативным лечением.
Протокол (№1042/05 от 31 мая 2005 г.) был утвержден Комиссией по этике Университета Габриэле Д’Аннунцио в Кьети. Настоящее исследование подчиняется правилам, установленным в Хельсинской Декларации.
Фармакологическое лечение
Группы, в которых выдавались лечебные пластыри. После первого осмотра пациентов исследователь разрезал повязку (с лидокаином или плацебо) на 4 части (7 ´ 5 см каждая) и накладывал 1 часть на кожу выше болевой зоны. Исследователь давал указание пациенту сменять повязку каждые 12 часов, т.е. общая суточная доза лидокаина составила 350 мг. Пациента просили снять последнюю повязку за 12 часов до посещения в День 5.
Разрезание лечебного пластыря с лидокаином – это принятый метод использования этого продукта, соответствующий указаниям по применению производителя, и не мешает получению лекарства от лечебного пластыря в достаточном количестве, потому что лекарство равномерно распределяется по всему лечебному пластырю (36).
Группа, в которой проводилась инфильтрация. После проведения оценки исследователь выполнял первую инфильтрацию болевой зоны 1 мл 0,5%-ного хлоргидрата бупивакаина. Вторая инфильтрация 1 мл производилась спустя 2 дня (15). В каждом случае расположение болевой зоны определялось путем сильного надавливания пальцами рук. Затем глубоко в болевую зону вводилась игла, после чего проводилась инъекция анестетика в соответствии с методикой, стандартизованной Д.Г. Симонсом и др. (3).
Проведение эксперимента
Оценка субъективных симптомов. Для оценки субъективных симптомов (например, оценка интенсивности боли и ее влияния при помощи различных параметров) были использованы специальные визуальные аналоговые шкалы (ВАШ). Каждая шкала представляла собой линейку, в начале которой – «отсутствие симптомов», в конце – «наихудшие вообразимые симптомы» (например, 0 = отсутствие влияния боли на настроение; 100 = максимальное влияние боли на настроение). Для определения интенсивности симптома пациент делал на линейке пометку, показывающую интенсивность боли, а специалист выполнял измерения (32). Также фиксировалось количество приступов боли в Дни 1, 5 и 9 (например, на каждом из 3 посещений пациента просили сообщить о количестве приступов за последние 4 дня). С этой целью каждому из пациентов был выдан дневник.
Оценка восприимчивости к соматической боли. Болевой порог при нажатии и болевой порог при воздействии электротока замерялись в триггерных точках, контрольных зонах и безболезненных участках (15, 25). Во время проведения сенсорного тестирования все пациенты находились в удобном положении, лежа на кушетке в тихой комнате. В первую очередь измерялся болевой порог при нажатии; затем измерялся болевой порог при воздействии электротока, сначала на коже, затем в подкожном слое и мышцах. Последовательность тестирования (т.е. измерение в первую очередь триггерных точек, контрольных зон или безболезненных участков) определялась произвольно.
Измерение болевого порога при нажатии. Болевой порог при нажатии измерялся при помощи алгометра Фишера (динамометр для измерения силы нажатия с круглой пробой диаметром 1 см; Pain Diagnostics & Treatment Inc., Грейт-Нек, шт. Нью-Йорк) (25). Алгометр перпендикулярно помещался на каждый участок измерений, и сила нажатия постепенно увеличивалась (0,1 кгс/сек.) до тех пор, пока пациент не сообщал об ощущении дискомфорта. Соответствующая величина записывалась в качестве порога для отдельной точки измерения.
Измерение болевого порога при воздействии электротока. С помощью компьютеризированного электрического стимулятора постоянного тока (Стимулятор R.S.D., опытный экземпляр, Флоренция, Италия) поставлялись 18 мс последовательности однофазных прямоугольных импульсов по 0,5 мс (частотой 310 Гц), которые автоматически повторялись каждые 2 секунды. Форма стимулирующей волны постоянно контролировалась при помощи двухлинейного осциллоскопа, подключенного к прибору стимуляции (37). При стимуляции кожи электроток проходил через проводящую пасту с помощью поверхностных электродов, состоящих из круглой пластины, сделанной из Ag/AgCl (эталонный электрод) диаметром 10 мм и цилиндра из Ag/AgCl (стимулирующий электрод) с основанием 0,3 мм диаметром, помещенных на расстоянии 1 см друг от друга. Регулируемое пружинное устройство, подключенное к стимулирующему электроду, поддерживало постоянное давление на кожу во время проведения измерений.
Для стимуляции подкожного слоя и мышц использовались два однополярных игольчатых электрода. Электроды были диаметром 0,3 мм, 25 мм длиной и изолированы политетрафторэтиленом, за исключением участка 2 мм на кончике. Во время внедрения этих тонких игл пациенты не сообщали о самопроизвольных болезненных реакциях (словами или жестами). Однако после внедрения специалист систематически спрашивал пациентов, не испытывают ли они дискомфорт при проведении процедуры. Никто из пациентов на болевые ощущения не жаловался.
Для исследования подкожного слоя 2 иглы были вертикально вставлены под поверхность кожи на расстоянии 1,5 см друг от друга. Такие же игольчатые электроды использовались и для исследования мышц; кончики иголок помещались глубоко под фасции (внутримышечное положение проверялось путем наблюдения за движениями электродов при произвольном сокращении мышц и (или) малоинтенсивной электростимуляции мышцы). Для измерения порога в триггерной точке 2 иглы вставлялись на расстоянии 1,5 см друг от друга так, чтобы триггерная точка находилась посередине между двумя кончиками иголок. Попадание иглы в триггерную точку тщательно избегалось, так как это могло привести к ее деактивации (3).
Стимуляция начиналась при очень низкой силе тока (0,01 мА), а затем прибор автоматически начинал увеличивать силу тока с интервалом в 0,03 мА до тех пор, пока пациент не сообщал о первых безболезненных ощущениях (прикосновение к коже, парестезия в подкожном слое, легкие сокращения в мышцах). Затем сила тока начинала увеличиваться с интервалом 0,1 мА до тех пор, пока пациенты не сообщали об отчетливых болевых ощущениях (15, 27-29, 37). При параметрах стимуляции и электродов, применявшихся при проведении данного исследования, чувствительность имела различные характеристики в 3 тканях: покалывающая боль на коже; линейно-радиальная боль в подкожном слое и схваткообразная боль в мышцах. Болевые пороги постоянно измерялись с использованием метода ограничений. Показатели при первом болевом ощущении заносились в компьютер. Затем стимулирующее воздействие ослаблялось в таком же порядке (0,1 мА) до исчезновения болевых ощущений, и этот показатель также заносился в компьютер. Затем вновь стимулирование увеличивалось до появления болевых ощущений, и соответствующее значение фиксировалось. Среднее значение между тремя показателями автоматически высчитывалось компьютером стимулирующего прибора и показывалось как окончательный болевой порог для каждой ткани.
Пациентов попросили сообщать о появлении и исчезновении ощущений нажатием кнопки, подключенной к компьютеру стимулирующего прибора. Им объяснили, что исследование проводится не для оценки переносимости боли, что не предполагается использование сверхпороговых стимулов, и что они не должны стараться терпеть боль, прежде чем сообщить о болевых ощущениях.
Статистический анализ
Статистический анализ (38) данных проводился с использованием системы статистического анализа SAS, версия 8.2 (SAS Institute Inc.).
Размер группы. Количество участников (по 20 пациентов в группе) рассчитывалось на основе опыта исследований, ранее проводившихся в исследовательском центре и относящихся к тому же виду клинических исследований по препаратам той же категории – а точнее, внутримышечных (в триггерных точках) инъекций местного анестетика – которая представляет собой эталонную терапию/препарат, использующиеся в протоколе (30). Основным показателем эффективности было изменение мышечных порогов в контрольной зоне до и после применения исследуемых препаратов.
Изменения порогов мышц контрольной зоны были проанализированы с целью установить, что исследуемый препарат не менее эффективен, чем стандартная (эталонная) терапия, с учетом того, что разница между терапиями равна 0, а коэффициент изменчивости составляет 60% для обеих групп в качестве нулевой гипотезы. Согласно схеме эксперимента, установив, что a = 0,05 и b = 0,20 (эквивалент мощности 80%), для каждой группы требовалось по 18 пациентов, чтобы гарантировать, что 95% CI за изменения в порогах мышц, на которые воздействовал исследуемый препарат (5% участок лидокаина) были ≥ 50% изменений, наблюдаемых при применении эталонного препарата (1 мл 0,5% гидрохлорида бупивакаина). С учетом отсева 10% пациентов было решено набирать по 20 пациентов на группу.
Анализ результатов исследования. По всем параметрам – непроизвольные симптомы (количество болевых приступов; интенсивность боли в состоянии покоя и в движении; влияние боли на повседневную деятельность; рабочая деятельность, настроение и качество жизни), объективные симптомы (болевые пороги при нажатии на кожу, подкожный слой и мышцы; болевые пороги при воздействии электричества в триггерных точках, контрольных зонах и безболезненных участках) и приемлемость терапии – рассчитывались средние значения (среднеквадратическое отклонение (SD)) для каждой группы пациентов в каждый период оценки.
Исходное состояние (День 1). Субъективные и объективные симптомы 3 групп пациентов были сопоставлены с помощью однофакторного дисперсионного анализа (ANOVA), а затем для внутреннего сравнения был проведен тест Тьюки. В каждой группе пациентов болевые пороги в триггерной точке и контрольной зоне сравнивались с болевыми порогами в безболезненных участках при помощи однофакторного дисперсионного анализа и последующего проведения теста Даннетта.
Период проведения терапии (Дни 1-9). В каждой группе применялся однофакторный анализ ANOVA для неоднократных измерений оценки воздействия терапии на каждый из субъективных и объективных симптомов, с последующим, где уместно, проведением тестов для внутреннего сравнения. Изменение (увеличение или уменьшение) по каждому из параметров рассчитывалось в 5 и 9 дни относительно исходного состояния (День 1). Для этих изменений рассчитывались средние значения. Изменения, наблюдаемые в различных группах, сравнивались с помощью критерия суммы рангов Уилкоксона.
Окончание исследования (День 9). Разница в частоте обращения за дополнительным лечением в 3 группах оценивалась при помощи χ2 теста. Уровень значимости был установлен на p < 0,05.
Результаты
Участники. Участвовать в исследовании могли шестьдесят пациентов (46 женщин и 14 мужчин) в возрасте от 19 до 76 лет. Демографические и другие базовые характеристики этих пациентов представлены в таблице 1. Относительно этих характеристик между 3 группами не было существенных различий.
Все пациенты, участвовавшие в исследовании, имели ≥ 1 миофасциальную триггерную точку, с которой были связаны их жалобы на спонтанную боль, характеризующуюся постоянными болевыми ощущениями с периодическими усилениями. Для снятия симптомов пациенты несистематически принимали нестероидные противовоспалительные средства (перорально или внутримышечно), но получали лишь частичное или временное облегчение. Никто из пациентов раньше не применял местных топических препаратов. Большинство (73%) выбранных триггерных точек находились в верхней части туловища, а 27% – в нижней (таблица 1). Безболезненные зоны находились в дельтовидной (n = 28), четырехглавой (n = 27), ягодичной (n = 3) или трапециевидной (n = 2) мышцах и находящихся над ними подкожном слое и коже.
Субъективные симптомы
Исходное состояние (День 1). 3 группы пациентов существенно не различались с точки зрения среднего количества болевых приступов, интенсивности боли в состоянии покоя и в движении или влияние боли на повседневную деятельность, рабочую деятельность, настроение или качество жизни (таблица 2).
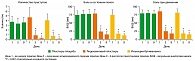
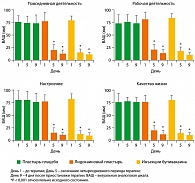
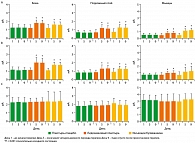
После терапии (Дни 5-9). В группе, принимавшей плацебо, в дни с 5 по 9 относительно исходного состояния (День 1) не произошло существенных изменений ни по одному из средних (SD) субъективных симптомов (таблица 2, рисунки 1 и 2). В группах, принимавших лидокаин и инъекции, все средние (SD) субъективные симптомы в дни с 5 по 9 существенно уменьшились (ANOVA, p < 0,001) относительно исходного состояния.
Сравнение средних (SD) оцениваемых симптомов не выявило существенной разницы между двумя группами, получавшими активную терапию, в любой момент оценки, в то время как разница между группой, получавшей плацебо, и группами активной терапии, была достаточно существенной как в 5-й, так и в 9-й день (обе, p < 0,001) (таблица 2, рисунки 1 и 2).
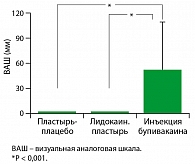
Показатели ВАШ по оценке дискомфорта, вызванного терапией, полученные в День 5, были существенно выше у пациентов, получавших инъекции, чем у пациентов, получавших лидокаиновые или плацебо пластыри (оба, p < 0,001) (рисунок 3). Средние (SD) показатели были 0,91 (0,31) мм для плацебо-пластыря, 0,87 (0,28) мм для лидокаинового пластыря и 51,45 (58,13) мм для инъекций.
В День 9 90% пациентов группы плацебо просили об инъекции бупивакаина (были сделаны 2 инъекции с интервалом 2 дня) в связи с сохранением болевых симптомов. Ни один из пациентов других двух групп об инъекции не просил. Разница в частоте обращений за инъекциями между группой плацебо и группами активной терапии была достаточно существенной (обе, p < 0,001).
Восприимчивость к соматической боли
Исходное состояние. 3 группы пациентов существенно не различались с точки зрения болевых порогов на любом из участков оценки (триггерные точки, контрольные зоны или безболезненные участки) (рисунки 4 и 5). В каждой группе все пороги в триггерной точке и контрольных зонах были значительно ниже, чем на безболезненных участках (все, p < 0,001), что указывало на гипералгезию всех 3 париетальных тканей на пораженных участках (28-30, 37).
После терапии (Дни 5-9 по сравнению с Днем 1). В группе плацебо в Дни 5 или 9 не наблюдалось существенных изменений в средних (SD) показателях болевых порогов относительно исходного состояния (таблица 3, рисунки 4 и 5). В обеих группах активной терапии (лидокаиновый пластырь и инъекции), соматическая чувствительность в триггерной точке и контрольной зоне существенно улучшилась в День 5 по сравнению с исходным состоянием, с сохранением эффекта в День 9 (ANOVA, p < 0,001), в то время как на безболезненном участке значительных изменений не отмечено. Тем не менее, в дни 5 и 9 все пороги в триггерной точке и контрольной зоне были значительно ниже, чем в зоне наблюдения (все, p < 0,01), за исключением болевых порогов при воздействии электротока на коже контрольной зоны в группе, получавшей лидокаин.
Сравнение порогов группы плацебо и каждой из групп активной терапии показало статистически достоверную разницу в День 5 и День 9 (оба, p < 0,001). Сравнение двух групп, получавших активную терапию, не показало существенных различий, за исключением болевых порогов при воздействии электротока в мышцах (при более значительном увеличении в группе инфильтрации), на уровне триггерной точки (День 5 и День 9; оба p < 0,001) и в контрольной зоне (День 5, p < 0,03; День 9, p < 0,007).
Побочные эффекты. Ни в одной из терапевтических групп пациенты не сообщали о побочных эффектах.
Обсуждение
В данном исследовании терапия лидокаиновым пластырем активных триггерных точек давала существенное уменьшение болевых симптомов МБС и связанной с ним недееспособности. Кроме того, десенсибилизация соматической гиперчувствительности тканей в болезненных участках (триггерных точках и контрольных зонах) была значительно ниже при применении лидокаинового пластыря, чем с плацебо. Все пациенты, получавшие лидокаиновый пластырь, испытывали сокращение количества эпизодов острой боли, средней интенсивности боли в состоянии покоя и в движении, а также влияния боли на повседневную деятельность, рабочую деятельность и качество жизни. Более того, пациенты, получавшие лидокаиновый пластырь, не обращались за дополнительным обезболиванием в течение 4 дней после приостановки терапии, в то время как 90% пациентов группы плацебо нуждались в дополнительном обезболивании.
Сравнение эффектов от лидокаинового пластыря и стандартной инъекционной терапии не выявило существенных различий по большинству параметров оценки, включая спонтанные симптомы и сенсорные ресурсы кожи и подкожного слоя, в то время как инъекционная терапия оказывалась более эффективной при сокращении мышечной гиперчувствительности как в триггерных точках, так и в контрольной зоне.
Никто из пациентов, участвовавших в исследовании, не сообщил о побочных эффектах. Отсутствие местных побочных эффектов после наложения пластыря в нашем исследовании может быть связано с ограниченной поверхностью наложения/контакта с тканями, относительно малым количеством исследованных пациентов и коротким периодом проведения исследования.
После определенного количества инъекций периодически сообщалось о системных и местных побочных эффектах (3, 31, 39). Сообщения о системных побочных эффектах в отношении лидокаина были также редкими, даже при применении высоких доз (напр., 3 пластыря в сутки; общая суточная доза – 2100 мг) на протяжении нескольких недель (40). Поскольку количество случаев появления системных побочных эффектов пропорционально продолжительности терапии и величине поверхности воздействия, отсутствие таких эффектов у наших пациентов не удивительно, учитывая ограниченный период терапии (4 дня) и небольшую поверхность воздействия (по 1/4 пластыря два раза в сутки). Последний фактор также объясняет отсутствие местных побочных эффектов в нашем исследовании, поскольку после продолжительного применения целого пластыря изредка (6,6%) сообщалось о побочных эффектах (41).
При отсутствии побочных эффектов у обеих групп активной терапии пациенты считали лидокаиновый пластырь более подходящим, чем инъекции. Уровень дискомфорта, связанного с терапией, был высоким при применении инъекций и очень низким (ноль для большинства пациентов) при применении пластыря.
Введение соляных инъекций в триггерные точки не считалось целесообразной симулирующей процедурой в данном исследовании, поскольку для триггерных точек оно является общепризнанной терапией (не плацебо) (3). Эффекты наложения лидокаинового пластыря на триггерные точки можно объяснить на основании предлагаемой патофизиологии триггерных точек. Триггерная точка рассматривается как фокальная зона устойчивого сокращения мышцы, возможно, на фоне случаев микротравм (1, 3-5, 17, 30, 31). Микротравмы повреждают мембраны мышечных клеток, вызывая высвобождение ионов кальция из саркоплазматической сети цитоплазматической среды, где они ответственны за постоянное взаимодействие актина и миозина, которое может прекратиться только при наличии аденозинтрифосфата (АТФ). Сокращение вызывает дефицит снабжения кислородом при недостатке АТФ, что делает цикл сокращений постоянным (3, 42). Местная ишемия также вызывает местное высвобождение альгогенных веществ (например, гистамина, кинина, калия, простагландинов), которые местно сенсибилизируют ноцирецепторы и отвечают за местную болезненность (43). Болевые ощущения в контрольной зоне связаны с рефлекторным механизмом, который управляется спинным мозгом (рефлекторная боль с гиперальгезией) (42).
Терапевтический эффект лидокаина, возможно, является результатом блокирующего действия препарата на потенциалозависимые натриевые каналы в нервных окончаниях триггерной точки (24, 44). Сокращение сенсорного входа из триггерной точки в результате воздействия лидокаина не только снимает местные симптомы и местную болезненность, но также косвенно уменьшает симптомы в контрольной зоне, снижая степень действия рефлекторного механизма, ответственного за соответствующий симптом.
Маловероятно, что терапевтический эффект лидокаина является результатом системной абсорбции, которая оказалась минимальной (40, 41). Фактически, при применении 5% лидокаинового пластыря на максимальной поверхности кожи площадью 420 см2 (соответствует применению 3 целых пластырей) в течение 12 часов, средний показатель (SD) максимальной плазменной концентрации лидокаина будет 0,129 (0,063) мкг/мл (в 10 раз ниже минимальной терапевтической плазменной концентрации, применяемой при сердечной аритмии) (45). С учетом того, что поверхность кожи, ежедневно подвергавшейся терапии в нашем исследовании, была 70 см2, системная абсорбция лидокаина может считаться минимальной, что можно также предположить на основании того факта, что во время проведения терапии не было обнаружено никаких сенсорных изменений вне участков триггерных точек и контрольной зоны (например, на безболезненных участках) (45).
Местные инъекции оказывают более сильное воздействие на сенсорные изменения, особенно на мышечном уровне, поскольку инъекция имеет два механизма воздействия: механическая деструкция триггерной точки (чего не происходит при применении лидокаинового пластыря) и введение местного анестетика (3). Однако преимуществом лидокаинового пластыря является возможность его самостоятельного применения.
Длительное воздействие лидокаина на триггерные точки требует проведения дальнейших исследований, отдельно посвященных вопросу спонтанных симптомов и сенсорных изменений в течение длительных периодов (недель) после проведения первоначальной терапии. Однако результат настоящего исследования можно считать благоприятным (например, значительное облегчение симптомов и десенсибилизация тканей в течение 4 дней после окончания терапии, которое указывает на то, что терапевтический эффект лидокаина намного превосходит действие непосредственного анестетика во время его применения). Хотя результаты не являются достаточно полными для того, чтобы предложить лидокаиновый пластырь в качестве абсолютной альтернативы общепринятым стандартам терапии (инъекции), они позволяют предположить, что препарат может быть действенным дополнительным лекарственным средством при МБС. Эти результаты в дальнейшем должны быть подтверждены на основании испытаний, проведенных двойным слепым рандомизированным контролируемым методом.
Выводы
В настоящем исследовании применение лидокаинового пластыря в выбранной группе пациентов оказалось эффективным и крайне подходящим видом терапии при МБС. Если результаты данного исследования будут подтверждены среди широких групп пациентов, применение лидокаинового пластыря может стать одним из вариантов терапии для пациентов с МБС и высокой гиперчувствительностью тканей, которые испытывают значительный дискомфорт при применении стандартной инъекционной терапии.

