Пробиотики в педиатрической практике
- Аннотация
- Статья
- Ссылки
Не вызывает сомнения тот факт, что тип вскармливания ребенка во многом определяет состав микрофлоры кишечника новорожденного. В грудном молоке содержится много компонентов, способствующих стабильной колонизации пищеварительного тракта ребенка бифидобактериями. Лактоза и олигосахариды являются энергетическим субстратом для нормофлоры, стимулируя рост бактерий-комменсалов. У детей, находящихся на грудном вскармливании с первых часов жизни, создаются оптимальные условия для формирования нормального микробиоценоза кишечника.
Кишечная микрофлора представлена множеством видов бактерий и может влиять на различные физиологические функции, участвовать в метаболических и биосинтетических процессах, проявлять иммуномодулирующие свойства, являясь составляющей частью организма хозяина [1]. Антагонистическая активность бактерий-комменсалов, направленная против экзогенной микрофлоры, основывается на различных механизмах. Важнейшая роль принадлежит продукции органических кислот. Молочная и уксусная кислоты – основные органические кислоты, снижают рH в желудочно-кишечном тракте, оказывает бактериостатическое действие. Резидентные микроорганизмы способны продуцировать различные антимикробные соединения, бактериоцины, конкурировать в борьбе за прикрепление к эпителию и питательные вещества, контролировать численность условно-патогенной флоры в толстом кишечнике, препятствовать ее проникновению в верхние отделы желудочно-кишечного тракта и транслокации из просвета кишечника во внутренние органы. Представители индигенной микрофлоры находятся в тесной симбиотической связи с макроорганизмом и могут активно противостоять заселению кишечника экзогенными патогенными и условно-патогенными микроорганизмами.
Бифидобактерии участвуют в расщеплении солей желчных кислот и оказывают выраженное иммуностимулирующее действие на систему местного иммунитета кишечника [2].
В настоящее время дискутируется вопрос о возможном участии микрофлоры в контроле моторной активности кишечника посредством продукции монокарбоновых (короткоцепочечных) жирных кислот.
Значительная часть облигатной микрофлоры кишечника здорового человека сформирована за счет бифидобактерий. В толстой кишке у детей бифидобактерии являются основной группой сахаролитических бактерий и составляют до 95% от общей популяции микроорганизмов. У взрослых людей бифидобактерии в количественном отношении уступают только бактериям классов Bacteroidetes и Clostridia.
В наших исследованиях было установлено, что для микрофлоры кишечника здоровых детей первого года жизни характерен высокий уровень бифидобактерий. Высокая частота встречаемости бифидобактерий в толстой кишке у детей всех исследованных нами возрастных групп соответствует ранее представленным данным (до 95% общего количества микроорганизмов) [3].
Бифидобактерии обладают высокой антагонистической активностью по отношению к патогенным микроорганизмам, выделяют в процессе жизнедеятельности большое количество кислых продуктов, лизоцима, бактериоцинов, спиртов, что препятствует проникновению микробов в верхние отделы пищеварительного тракта и другие внутренние органы.
Кроме того, недавно было выяснено, что некоторые штаммы бифидобактерий, выделенные из кишечника новорожденных, способны к продукции конъюгированной линолевой кислоты.
Конъюгированные линолевые кислоты представляют собой смесь частично гидрогенированных Cis-9 Trans-11 и Trans-10 Cis-12 производных линолевой кислоты, являющихся промежуточными продуктами биохимического пути восстановления линолевой кислоты в стеариновую. Показано, что данные вещества обладают антиканцерогенными, иммуномодулирующими, антиатеросклеротическими свойствами [4].
Иммуномодулирующий эффект бифидобактерий связан с их способностью к индукции синтеза ряда про- и противовоспалительных цитокинов, а также со способностью к модуляции экспрессии поверхностных маркерных молекул на цитоплазматических мембранах иммунокомпетентных клеток. Различные виды бифидобактерий, доминирующие в кишечнике здоровых людей в разные возрастные периоды, способны индуцировать экспрессию разных репертуаров цитокинов [5].
Важное значение имеет не только определение общего количественного уровня бифидобактерий, но и их видового состава.
Возрастная динамика видового состава бифидобактерий у человека до настоящего времени недостаточно изучена. Использование для типирования бактерий молекулярно-генетических методов исследований позволило изменить наши представления о видовом составе бифидобактерий [6]. Так, ранее с использованием классических бактериологических методов было установлено, что часто встречающимися видами в микрофлоре кишечника взрослых людей являются B. adolescentis и B. longum, а у детей первых месяцев жизни, находящихся на естественном вскармливании, B. infantis и B. breve. Однако в работах последних лет, в том числе проведенных в нашей лаборатории с использованием в качестве метода видовой детекции бифидобактерий ПЦР с видоспецифичными праймерами, амплифицирующими уникальные консервативные области генов 16 S рибосомальной РНК (рРНК), было установлено, что в микрофлоре кишечника взрослых людей весомое место занимают бактерии группы B. catenulatum (B. catenulatum и B. pseudocatenulatum), а у грудных детей относительно большая частота встречаемости характерна также и для B. longum [7].
Наиболее важным и принципиально новым этапом в изучении биологии бифидобактерий явилось секвенирование генома Bifidobacterium longum. Анализ особенностей генома бифидобактерий показал их выраженную филогенетическую и экологическую адаптацию к условиям существования в кишечнике. Было показано, что большое количество обнаруженных генов вовлечено в катаболизм полисахаридов и олигосахаридов [8].
Лактобациллы в наших исследованиях регистрировались с меньшей частотой. Было установлено, что только 66,6% детей были колонизированы лактобациллами в первом полугодии жизни. В дальнейшем в нашей работе прослеживалась устойчивая тенденция к повышению частоты колонизации кишечника лактобациллами с увеличением возраста человека. Однако частота встречаемости этих бактерий у детей разных возрастных групп, в отличие от бифидобактерий, была подвержена значительным колебаниям [9].
У разных видов лактобацилл наблюдаются существенные отличия в способности индуцировать секрецию цитокинов: L. casei служит мощным стимулятором продукции ИЛ-6, ИЛ-12, фактора некроза опухоли α и экспрессии маркеров созревания, тогда как L. reuteri является слабым индуктором ИЛ-12, подавляет секрецию цитокинов и экспрессию маркеров созревания, вызванных другими видами лактобактерий. Полученные результаты позволяют предположить, что разные виды/штаммы лактобактерий могут оказывать различное влияние на функционирование дендритных клеток и таким образом осуществлять регуляцию первоначальных этапов иммунного ответа [10].
У здоровых детей, находящихся на грудном вскармливании, лактобациллы обнаруживаются в количестве 10 6–10 7 КОЕ/г. У детей, находящихся на искусственном вскармливании, уровень этих микроорганизмов выше – 10 8 КОЕ/г. Очевидно, качественный и количественный состав лактобацилл, в отличие от менее иммуногенных бифидобактерий, в большей степени зависит от контроля со стороны иммунной системы организма человека.
У детей в период новорожденности количество бактероидов обычно ниже, чем бифидобактерий. К концу первого месяца жизни бактероиды обнаруживаются только у 35% детей, их уровень составляет 10 9 КОЕ/г. В дальнейшем частота обнаружения бактероидов возрастает до 48% у детей в возрасте 2‑х месяцев и до 59% у детей к концу первого полугодия жизни. Запаздывание контаминации толстой кишки грамотрицательными неспорообразующими облигатно-анаэробными бактериями может быть связано с их высокой чувствительностью к токсическому действию кислорода воздуха, а также с необходимостью предварительного снижения окислительного потенциала в толстой кишке ребенка, которое достигается в результате первичной колонизации кишечника бактериями, относящимися к аэробной флоре. Бактероиды, колонизирующие кишечный тракт человека, обладают выраженными гликофильными свойствами, которые проявляются в способности к ферментации не перевариваемых человеком полисахаридов, входящих, например, в состав пищевых волокон растительного происхождения. Бактероиды, которые испытывают недостаток в органеллах адгезии (B. thetaiotaomicron), осуществляют доступ к нутриентам частично за счет продуцируемых ими гликан-специфических поверхностных мембранно-связан-ных протеинов. Прикрепление к пищевым платформам (частицы пищи, пищевые волокна, слизевой покров, слущенные эпителиальные клетки) помогают этим бактериям избегать смыва из кишечного биореактора. Таким образом, задержка колонизации кишечника бактероидами у детей раннего возраста может быть связана с особенностями их диеты, которая в ранние сроки физиологической адаптации отличается отсутствием или дефицитом пищевых волокон растительного происхождения [10].
Клостридии в кишечнике новорожденных появляются к 6–7 дню жизни и могут достигать уровня 10 6–10 7 КОЕ/г исследуемого материала.
К представителям облигатной микрофлоры кишечника относятся Escherichia coli, количество их незначительно (менее 0,01%) по сравнению с доминирующими, неспорообразующими анаэробами (бифидобактериями, лактобактериями, бактероидами). В кишечнике человека E. coli появляются в первые дни после рождения, сохраняясь в течение жизни человека на уровне 10 7 – 10 8 КОЕ/г. В результате изучения качественного и количественного состава бактерий, относящихся к семейству Enterobacteriaceae, всего было выявлено 20 различных видов энтеробактерий. Исследования показали, что у детей от 6 месяцев до 1,5 лет с наибольшей частотой высевались бактерии, относящиеся к виду Escherichia coli. Вместе с тем обнаруживалось значительное количество штаммов E. сoli со сниженными ферментативными свойствами, а также штаммов, способных продуцировать гемолизины. Кроме того, с высокой частотой определялись и другие представители семейства (клебсиеллы, энтеробактеры и цитробактеры). К концу первого года жизни по мере созревания иммунной системы ребенка происходит частичная или полная элиминация условно-патогенных бактерий.
Энтерококки выявляются у большинства обследованных детей в течение всего периода грудного вскармливания.
Еще одной группой бактерий, колонизация которыми толстого кишечника детей была зарегистрирована в раннем возрасте, были стафилококки. Причем у всех детей микроорганизмы вида Staphylococcus aureus в количественном отношении преобладали над коагулазо-негативными стафилококками, а у детей в возрасте 8 месяцев и 1 года была отмечена также более высокая частота встречаемости золотистых стафилококков.
Наиболее выраженные изменения в кишечной микрофлоре происходят у детей на первом году жизни. Для них характерны высокие уровни и частота выделения не только таких аутохтонных групп бактерий, как бифидобактерии, энтерококки, непатогенные эшерихии, но и бактерий, относящихся к условно-патогенным аллохтонным группам. Такими группами бактерий являются лецитиназо-позитивные клостридии, цитрат-ассимилирующие энтеробактерии и эшерихии с низкой биохимической активностью, а также со способностью к продукции гемолизинов, кроме того, к этой группе относятся коагулазо-позитивные стафилококки. В последующем по мере взросления ребенка происходит прогрессивная элиминация бактерий этой последней группы. Основными механизмами, участвующими в контроле качественного и количественного уровня бактерий в микрофлоре кишечника, по нашему мнению, являются неспе-цифические и специфические факторы иммунологической защиты, созревание которых происходит по мере взросления человека.
Бифидобактерии благодаря способности благотворно влиять на здоровье человека нередко добавляются во многие ферментируемые молочные продукты, а также входят в состав многих препаратов-пробиотиков, используемых для комплексного лечения различных заболеваний.
Пробиотические штаммы реализуют свои положительные для здоровья эффекты на разных уровнях: в просвете кишечника, кишечном эпителии, на уровне иммунной системы.
В последние годы все большее значение придают влиянию пробиотиков на иммунную систему. Не вызывает сомнения, что желудочно-кишечный тракт является важной частью иммунной системы человека. Об этом свидетельствует целый ряд факторов, включая тот факт, что значительная часть лимфоидной ткани сосредоточена в кишечнике. В реализации иммунных механизмов на уровне интестинального тракта принимают участие три ключевых взаимосвязанных компонента:
- нормальная микрофлора;
- лимфоидная ткань, ассоциированная со слизистой оболочкой кишечника;
- цитокины как факторы межклеточного взаимодействия, продукты секреции иммунокомпетентных и фагоцитарных клеток.
Недавние исследования показали, что механизмами защитного действия пробиотиков против возбудителей кишечных инфекций могут быть стимуляция спе-цифического фактора и усиление естественной резистентности.
Известно, что течение многих воспалительных заболеваний кишечника сопровождается значительными иммунологическими нарушениями. Назначение препаратов‑пробиотиков в комплексной терапии этих заболеваний оказывает иммуномодулирующий эффект: они усиливают локальный ответ в кишечнике и повышают толерантность к пищевым антигенам. Дефицит или отсутствие ИЛ-2 и противовоспалительного цитокина ИЛ-10 вызывает патологический ответ на микроорганизмы-комменсалы кишечника, что проявляется чрезмерно интенсивным воспалительным процессом [11].
В наших исследованиях изучалось влияние комплексного бактерийного препарата Примадофилус на качественный и количественный состав микрофлоры кишечника у детей раннего возраста из групп риска по развитию дисбактериоза кишечника. Неонатальный период у обследуемых детей протекал с осложнениями, и в их лечении использовались антибактериальные препараты.
Препарат-пробиотик Примадофилус создан с учетом особенностей видового состава бифидобактерий и лактобацилл у детей раннего возраста. Основу препарата Примадофилус составляют Bifidobacterium infantis, Bifidobacterium longum, Lactobacillus rhamnosus, Lactobacillus acidophilus. Примадофилус Детский производства Nature’s Way (США), содержит 2х10 9 КОЕ в 3 г, разрешен к применению у детей с рождения. Рекомендуется принимать по 0,5–1 чайной ложке порошка 1 раз в день в день, растворив в 10 мл воды или любой другой жидкости. Препарат не содержит лактозы и устойчив к антибиотикам.
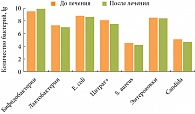
У всех обследуемых детей преморбидный фон был отягощен. 7 детей родились преждевременно на сроках беременности 32–36 недель, 18 детей – самостоятельно в срок, 12 детей – путем оперативного родоразрешения. Дети получали препарат Примадофилус в условиях стационара и после выписки из клиники. Наши исследования показали, что на фоне применения комплексного бактерийного препарата происходило восстановление оптимальных качественных и количественных показателей лактофлоры и бифидофлоры у детей в неонатальном и раннем постнатальном периодах. При этом количественный и качественный уровень других групп облигатно-анаэробных бактерий (бактеро-иды и клостридии) не претерпевал статистически значимых изменений. Применение комплексного препарата не предотвращало колонизацию кишечника детей, находящихся в стационаре, госпитальными штаммами бактерий. Не было обнаружено статистически значимых изменений в частоте встречаемости и количественном уровне дрожжеподобных грибов рода Сandida. Однако наблюдалась тенденция к уменьшению количественного уровня этих микроорганизмов. Выявление сохраняющегося высокого уровня обсеменения грибами на фоне лечения Примадофилусом обосновывает необходимость предварительного или фонового использования антимикотических препаратов.
Таким образом, пробиотический препарат Примадофилус способен эффективно восстанавливать молочнокислую флору. Применение препарата не приводит к элиминации условно-патогенных микроорганизмов, поскольку происходит постоянная контаминация микроорганизмами, колонизирующими объекты окружающей среды. Основными механизмами, участвующими в контроле качественного и количественного состава микроорганизмов кишечника, являются факторы естественной резистентности и иммунологической защиты, созревание которых происходит по мере взросления ребенка.

