Рак толстой кишки при воспалительных заболеваниях кишечника
- Аннотация
- Статья
- Ссылки

За последние 10 лет в России отмечен рост заболеваемости и смертности от злокачественных новообразований [5] (табл.).
Ежегодно в России диагностируют более 46 000 новых случаев РТК, при этом на 100 вновь выявленных больных приходится более 70 умерших [1]. Повышенный риск возникновения неоплазии толстой кишки отмечен у больных воспалительными заболеваниями кишечника (ВЗК), при этом РТК у них может встречаться до 10 раз чаще, чем в общей популяции [20, 27]. Заболеваемость РТК, в том числе при язвенном колите (ЯК) и болезни Крона (БК), выше в экономически развитых странах и имеет географические различия, составляя при ЯК 2 случая на 1000 в Дании, 5 на 1000 в США, а при БК – 1,4 в скандинавской популяции и 3,9 в Великобритании и Северной Америке [15, 32]. Существуют различия в заболеваемости среди взрослых и детей: 3 и 6 случаев на 1000 в год соответственно [19]. При БК риск развития РТК колеблется от 2,5 до 4,5, что выше, чем в общей популяции, но несколько ниже, чем у больных ЯК [15]. Смертность от РТК, ассоциированного с ЯК и БК, значительно выше, чем от спорадического колоректального рака, а 5-летняя выживаемость после оперативного вмешательства ниже [3, 35].
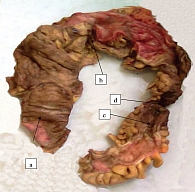
Для злокачественных новообразований толстой кишки, развившихся при ВЗК, характерны некоторые особенности: мультицентрический рост, раннее метастазирование, преимущественно низкодифференцированный гистологический тип и высокая инвазивность [3, 12]. Первично-множественные опухоли толстой кишки с мультицентрическим ростом могут возникать одновременно (синхронно) или последовательно (метахронно) (рис. 1).
Метастазирует РТК при ВЗК так же, как и спорадический колоректальный рак, – лимфогенным, гематогенным и трансплантационным путями в лимфатические узлы, печень, мозг, легкие, кости, брюшину, отмечается прорастание в соседние органы (малый таз).
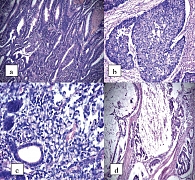
Морфологические варианты РТК при ЯК и БК включают (рис. 2): аденокарциному, слизистый рак, солидный рак, плоскоклеточный рак, недифференцированную форму, скиррозный рак, лимфому.
В качестве причин развития РТК рассматривают хроническое воспаление и длительную терапию препаратами иммуносупрессивной направленности.
Морфогенез РТК достаточно хорошо изучен. Он развивается в результате последовательных изменений: дисплазия/аденомааденокарцинома. Однако механизмы, ответственные за возникновение и накопление в эпителиальной клетке нарушений, изучены фрагментарно. В основе современных представлений о канцерогенезе лежит возможность различных канцерогенных агентов (химических, физических, вирусных, инфекционных) вызывать такие повреждения генома клеток, которые сопровождаются активацией клеточных онкогенов и/или инактивацией антионкогенов. Именно эти гены могут запускать деление клеток, участвовать в регуляции их пролиферации, дифференцировки и запрограммированной гибели – апоптозе. Клеточные онкогены (онкобелки или онкопротеины) кодируют синтез белков, стимулируют пролиферацию и замедляют апоптоз. Антионкогены, или гены-супрессоры рака, наоборот, тормозят пролиферацию клеток, и их потеря может привести к развитию рака [24].
Практически все генные мутации, участвующие в патогенезе спорадического РТК, обнаружены при злокачественной трансформации слизистой оболочки толстой кишки у больных ЯК [25]. В то же время особенностью неоплазии, ассоциированной с ВЗК, является более ранняя, чем при спорадическом РТК, мутация гена p53, приводящая к усилению пролиферативных процессов [7, 28].
Основными независимыми факторами риска РТК при ЯК считают продолжительность заболевания, протяженность воспаления в толстой кишке и первичный склерозирующий холангит (ПСХ) [43]. К дополнительным факторам риска относят начало болезни в раннем возрасте, РТК у родственников и дефицит фолиевой кислоты [41]. К факторам риска РТК при БК, помимо перечисленных выше, относят также хроническую кишечную непроходимость, хронический свищ (особенно параректальный) и, возможно, длительный прием 6-меркаптопурина [28].
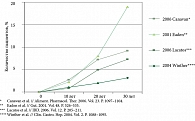
В 2001 г. опубликованы результаты анализа 19 исследований риска РТК при ЯК, где указано, что при длительности ЯК 10 лет риск составляет 2%, при 20-летнем стаже заболевания – 8%, при 30-летнем – риск неоплазии возрастает до 18% [19]. Успешное проведение профилактических мероприятий в ряде стран привело к снижению риска развития РТК у больных ВЗК (рис. 3). Риск злокачественной неоплазии у пациентов с длительным течением БК толстой кишки, не подвергшихся оперативному лечению, составил 2,9% при 10-летнем анамнезе заболевании, 5,6% – при 20-летнем, 8,3% – при длительности БК более 30 лет (с увеличением стажа заболевания риск будет возрастать) [15, 17] (рис. 3). Исследование, выполненное в Копенгагене, свидетельствует, что у 70% больных БК при длительности анамнеза более 15 лет после резекции толстой кишки риск РТК не изменился [29].
Доказанным фактом является высокая вероятность злокачественной трансформации слизистой оболочки толстой кишки (СОТК) у пациентов с распространенным колитом: большинство неоплазий развивается у пациентов с тотальным колитом – в 19 раз чаще, чем в общей популяции [41]. Бытует мнение, что при проктите риск РТК наиболее низкий (в 1,5 раза выше, чем в популяции), тогда как при левостороннем поражении толстой кишки частота риска повышается в 4 раза, и он появляется примерно на 10 лет позже по сравнению с панколитом [20]. В то же время имеются сведения о более раннем и частом выявлении РТК и дисплазии при левостороннем поражении толстой кишки [31].
Проблема развития РТК при сочетании ВЗК с первичным склерозирующим холангитом (ПСХ) заслуживает особого внимания [4]. Присоединение ПСХ повышает риск неоплазии на 50%. Отмечена более частая локализация карциномы в правых отделах толстой кишки, при этом обсуждается роль желчных кислот (нарушение желчеобразования и неполноценность состава желчи) в онкогенезе при ПСХ [41]. Кроме того, риск развития РТК сохраняется у пациентов и после трансплантации печени, составляя 1% на человека в год [30].
Наличие случаев РТК у родственников повышает риск развития не только спорадической карциномы толстой кишки, но и является фактором риска неоплазии у больных ВЗК [17]. Семейный анамнез РТК повышает вероятность малигнизации СОТК в 2 и более раз [10, 33].
До настоящего времени дискутируется вопрос о значении раннего возраста начала заболевания в развитии карциномы толстой кишки в случае ВЗК. Утверждение о повышенном риске развития РТК у больных с началом заболевания в раннем возрасте основано на исследованиях, согласно которым колоректальная карцинома обнаруживается у 20% больных ЯК через 10 лет после начала заболевания и у 40% через 35 лет с дебютом заболевания до 15 лет [20].
Положение European Crohn's and Colitis Organisation (ECCO) о риске РТК при ЯК:
- при длительном течении ЯК риск развития КРР выше по сравнению с общей популяцией (УД 2);
- при тотальном ЯК риск наиболее высок, при левостороннем ЯК – средний уровень риска, при проктите этот риск не повышен (УД 2);
- наиболее высокий риск у больных с ранним началом заболевания (дебют в возрасте < 20 лет), а также у больных ЯК, ассоциированным с ПСХ (УД 2);
- увеличивают риск КРР при ЯК стойкое воспаление и наличие КРР в семейном анамнезе (УД 3).
Дефицит фолиевой кислоты рассматривают как вероятный фактор риска развития спорадического рака толстой кишки и формирования аденоматозных полипов [26]. Фолаты, как эссенциальный кофактор, играют значительную роль в биосинтезе пуринов, что имеет существенное значение в синтезе и репликации ДНК [16]. В клетках неоплазии, где ускорены процессы репликации ДНК и деления клеток, прерывание путей метаболизма фолатов приводит к неэффективному синтезу ДНК и подавлению роста опухоли, чем объясняется терапевтический антиопухолевый эффект ряда антифолатных агентов (например, 5-фторурацила и метотрексата). Недостаток фолатов в нормальных тканях вызывает предрасположенность к неопластической трансформации, а добавление фолатов угнетает развитие опухоли. В ряде исследований установлен повышенный риск развития РТК у больных ЯК в условиях дефицита фолиевой кислоты [22].
Основным критерием злокачественной трансформации при ВЗК является дисплазия железистого эпителия [17]. Обнаружение в СОТК очага дисплазии считается фактором высокого риска РТК и в 43% случаев ассоциируется с наличием инвазивной карциномы [29]. Время, в течение которого дисплазия перерождается в карциному, неизвестно. Выявление дисплазии в условиях хронического воспаления и при наличии воспалительных полипов (псевдополипов) – непростая задача. Для ВЗК характерна высокая кинетика обновления эпителиальных клеток в связи с язвенными дефектами, и существует риск пропустить признаки дисплазии или ранней карциномы в обновляющемся эпителии. Наличие дисплазии должно быть подтверждено как минимум двумя независимыми морфологами в множественных повторных биоптатах из одного и того же участка толстой кишки.
Положение ECCO о наблюдении при ЯК гласит:
- при контрольной колоноскопии следует выполнять произвольные биопсии (по 4 на каждые 10 см) и прицельные биопсии из любых видимых поражений (УД 2b, СР B);
- хромоэндоскопия с окрашиванием метиленовым синим или индигокармином для эндоскопистов с соответствующей подготовкой служит альтернативой произвольным биопсиям и превосходит произвольные биопсии по частоте выявления неопластических очагов (УД 1b).
При БК следовать данной рекомендации затруднительно в силу сегментарности поражения толстой кишки, возможного наличия стриктур. Целесообразно выполнять прицельные биопсии из пораженных участков при хромоэндоскопии и эндомикроскопии.
Методы профилактики РТК при воспалительных заболеваниях кишечника
Колэктомия
Низкие показатели риска РТК при ВЗК характерны для населения скандинавских стран и обусловлены, прежде всего, высокой частотой превентивных колэктомий: 23% при 10-летнем анамнезе и 32% при длительности заболевания более 25 лет. В исследовании, выполненном в Копенгагене, низкий риск колоректального рака (RR = 1,1) объясняется также высокой хирургической активностью: колэктомия выполнена у 70% пациентов после 15 лет от начала заболевания [29]. Обнаружение дисплазии высокой степени при ВЗК является более объективным и определенным критерием для решения вопроса о превентивной операции. Тем не менее широко распространено мнение, согласно которому опасность развития РТК даже в случае выявления дисплазии не оправдывает риск осложнений, летальности и социальных последствий радикальных операций [34].
Химиопрофилактика
Перспективной и вероятно экономически выгодной считают медикаментозную профилактику РТК при ВЗК.
Методы химиопрофилактики преследуют следующие цели:
- регуляция процессов пролиферации и апоптоза в эпителии толстой кишки;
- регуляция и восстановление пула короткоцепочечных жирных кислот (КЖК) в толстой кишке;
- поддержание нормального микробиоценоза кишечника.
Регулировать процессы пролиферации и апоптоза можно с помощью препаратов 5-аминосалициловой кислоты (5-АСК). Предположение о возможной эффективности 5-АСК основано на том, что близкие к ней по механизму действия лекарственные средства – салицилаты и другие нестероидные противовоспалительные препараты (НПВП) – ингибируют клеточную пролиферацию и усиливают апоптоз малигнизированных клеток при раке и аденоматозных полипах толстой кишки [9]. Имеются данные о снижении риска колоректальных аденом при применении аспирина в течение 5–10 лет [14]. При применении селективного ингибитора циклооксигеназы-2 целекоксиба в дозе 400 мг/сут в течение 6 месяцев отмечено уменьшение количества и размеров полипов у больных семейным аденоматозным полипозом [40].
В основе антиканцерогенного действия НПВП и аминосалицилатов лежит принцип подавления циклооксигеназного и липооксигеназного путей метаболизма арахидоновой кислоты, синтеза простагландинов и лейкотриенов, ингибирования ядерного фактора κВ (NFκB) и MAP-киназы, снижения экспрессии bcl-2 на эпителиальных клетках и блокады окислительного стресса [9]. Существует предположение, что НПВП тормозят активацию канцерогенов, опосредованно ингибируя рецепторы, связанные с пероксисомами (PPARs) [23]. Аминосалицилаты, используемые как основные препараты для терапии обострений и профилактики рецидивов ВЗК, обладают сходным действием на опухолевые клетки.
Результаты контролируемых исследований демонстрируют влияние месалазина на пролиферацию и апоптоз клеток СОТК [44]. В одном из них отмечена активация апоптоза клеток аденокарциномы толстой кишки при использовании клизм с месалазином в течение 2 недель, при этом на темпы пролиферации препарат не влиял [13]. В другом исследовании при пероральном применении месалазина в дозе 1 г/сут в течение 2 недель у пациентов со спорадическими полипами отмечены как активация апоптоза, так и торможение пролиферации в нормальной слизистой оболочке толстой кишки [37].
Имеются сведения о снижении относительного риска РТК при назначении сульфасалазина у больных ЯК до 0,38 по сравнению с аналогичной по составу группой пациентов, не получавших поддерживающую терапию 5-АСК [21]. В контролируемом клиническом исследовании при длительном приеме месалазина и сульфасалазина у больных ЯК выявлено снижение риска развития РТК на 75–81% по сравнению с контрольной группой [19], при этом сульфасалазин оказался менее эффективным и вызывал существенные побочные эффекты при длительном лечении. Поэтому препаратом выбора для профилактики рецидива ВЗК и предупреждения злокачественной трансформации СОТК считают месалазин. Рекомендуемый длительный прием месалазина в дозе более 1 г/сут способствует снижению пролиферативной активности эпителия толстой кишки и уменьшению вероятности развития РТК при ВЗК [18].
Выбор препарата месалазина как для индукции и поддержания ремиссии при ВЗК, так и для профилактики РТК при этих заболеваниях определяется характеристикой энтеросолюбильного покрытия препарата 5-АСК, уровнем высвобождения активного вещества, протяженностью и локализацией воспалительного процесса. Так, известны три варианта энтеросолюбильных покрытий: эудрагитное (Асакол, Салофальк), акриловое (Месакол) и этилцеллюлозное (Пентаса). С точки зрения противовоспалительного эффекта при ВЗК, особенно при ЯК, согласно положению ЕССО, все месалазины равны по эффективности.
Особенность этилцеллюлозного покрытия Пентасы обеспечивает равномерное высвобождение препарата на всем протяжении желудочно-кишечного тракта, начиная с 12-перстной кишки [7]. Таким образом, Пентаса наравне с другими препаратами месалазина показана для лечения ЯК, терминального илеита и илеоколита при БК, но в случае поражения БК высоких отделов подвздошной, тощей и 12-перстной кишок Пентаса является единственным средством, обеспечивающим лечение высокого очага поражения.
ECCO определило следующее положение о профилактике РТК при ВЗК: иммунопрофилактика соединениями 5-АСК может уменьшать заболеваемость КРР у больных ЯК, и целесообразность ее проведения следует рассматривать у всех больных ЯК (УД 2).
Появились публикации, сообщающие об антинеопластическом действии урсодезоксихолевой кислоты (УДХК). Ее применение ассоциируется с низкой частотой малигнизации СОТК у больных ЯК в сочетании с ПСХ [8, 42]. Механизм действия УДХК в этом случае объясняется снижением в кишечнике содержания гидрофобных желчных кислот, образующихся под влиянием бактерий и обладающих канцерогенными свойствами. Кроме того, УДХК обладает мощным цитопротективным и антипролиферативным потенциалами, стимулирует апоптоз. Получены убедительные данные о снижении частоты дисплазии и карциномы толстой кишки при регулярном приеме 8–15 мг/кг УДХК у больных ЯК с ПСХ [36]. ЕССО рекомендует назначать УДХК больным ЯК с ПСХ для профилактики развития рака толстой кишки (УД 1b).
Существенную роль в регуляции процессов обновления эпителия толстой кишки играют короткоцепочечные жирные кислоты (КЖК), которые помимо многочисленных метаболических эффектов обладают антипролиферативным действием. Данное положение было подтверждено у больных ЯК, которым ректально вводили смесь КЖК и определяли степень пролиферации по индексу PCNA до и после лечения [38]. Установлено, что КЖК и, прежде всего, масляная кислота уменьшают число PCNA-позитивных, то есть пролиферирующих, клеток в эпителии кишечника. Именно масляная кислота считается «ключевым регулятором» пролиферации эпителия толстой кишки, контролирует процессы злокачественной трансформации колоноцитов, защищает клетки эпителия от повреждающего действия канцерогенов [38]. При ВЗК и неоплазиях кишечника наблюдается снижение концентрации масляной кислоты. Пациентам с ВЗК с высоким риском РТК необходимо обеспечивать полноценное содержание масляной кислоты в толстой кишке при помощи использования различных пищевых волокон (пектинов, целлюлозы, гемицеллюлозы) и лекарственных средств на основе КЖК. Пищевые волокна подвергаются в толстой кишке бактериальной ферментации, а конечным продуктом их метаболизма являются КЖК. Таким образом, пищевые волокна следует рассматривать как естественный источник КЖК, которые и обусловливают их антиканцерогенное действие [2]. Эпидемиологический корреляционный анализ показал, что применение высоковолокнистой диеты ассоциируется с низким риском РТК [39], благодаря чему их следует рекомендовать для профилактики колоректальной неоплазии при ВЗК в группах высокого риска.
При пероральном введении масляной кислоты она почти целиком абсорбируется в желудке и тонкой кишке, не достигая толстой кишки в должной концентрации. В настоящее время для профилактики РТК возможно применение средства, в состав которого входят масляная кислота в виде бутирата кальция и инулин. Инулин – хорошо растворимый природный олигосахарид, стимулирующий рост полезной бактериальной флоры, которая способна ферментировать инулин для синтеза эндогенной масляной кислоты. Инулин обладает стимулирующим эффектом на апоптоз кишечного эпителия. С помощью полимерной мультиматриксной системы высвобождение масляной кислоты и инулина происходит непосредственно в толстой кишке.
В настоящее время нет доказательной базы о длительности приема препаратов для профилактики РТК при ВЗК (5-АСК, УДХК, КЖК), но с точки зрения логики прием должен быть длительным, если не пожизненным. Обсуждается возможность применения статинов для лечения и профилактики РТК [11]. В качестве механизмов антиканцерогенного действия этой группы препаратов называют воздействие на апоптоз, снижение клеточной пролиферации, ангиогенеза.

