Реактивная гипертензия после комбинированной лазерной иридэктомии с адекватным медикаментозным сопровождением
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить уровень реактивной гипертензии после лазерной иридэктомии, выполненной
по комбинированной методике с соблюдением мер профилактики, включая медикаментозное сопровождение до и после операции, как у пациентов с сопутствующими соматическими заболеваниями и отягощенным аллергическим анамнезом, так и у пациентов без указанной патологии.
Материал и методы. Проанализированы результаты лечения 27 пациентов. С целью наиболее полного изучения анамнеза использовалась унифицированная анкета, включающая сведения об аллергических реакциях, инфекционных и аутоиммунных синдромах, других соматических заболеваниях и принимаемых лекарственных препаратах. Комбинированная лазерная иридэктомия выполнялась в два этапа за один визит. Первый этап – коагуляция в проекции лакун на периферии радужки, второй этап – формирование двух сквозных отверстий. Всем пациентам проводилось медикаментозное сопровождение по одинаковой схеме. Уровень реактивной гипертензии оценивался через час, на первые и седьмые сутки после вмешательства.
Результаты. Комбинированная лазерная иридэктомия вызывала реактивную гипертензию в ранние сроки после операции в 100% случаев. Уровень внутриглазного давления варьировался от 17 до 28 мм рт. ст. в зависимости от дополнительной офтальмологической и сопутствующей соматической патологии. У пациентов с сопутствующей соматической патологией и отягощенным аллергическим анамнезом уровень реактивной гипертензии был выше.
Выводы. Комбинированная лазерная иридэктомия с адекватным медикаментозным сопровождением
до и после вмешательства является эффективной, безопасной процедурой и позволяет достигать целевого внутриглазного давления в ранние сроки после операции.
Цель – оценить уровень реактивной гипертензии после лазерной иридэктомии, выполненной
по комбинированной методике с соблюдением мер профилактики, включая медикаментозное сопровождение до и после операции, как у пациентов с сопутствующими соматическими заболеваниями и отягощенным аллергическим анамнезом, так и у пациентов без указанной патологии.
Материал и методы. Проанализированы результаты лечения 27 пациентов. С целью наиболее полного изучения анамнеза использовалась унифицированная анкета, включающая сведения об аллергических реакциях, инфекционных и аутоиммунных синдромах, других соматических заболеваниях и принимаемых лекарственных препаратах. Комбинированная лазерная иридэктомия выполнялась в два этапа за один визит. Первый этап – коагуляция в проекции лакун на периферии радужки, второй этап – формирование двух сквозных отверстий. Всем пациентам проводилось медикаментозное сопровождение по одинаковой схеме. Уровень реактивной гипертензии оценивался через час, на первые и седьмые сутки после вмешательства.
Результаты. Комбинированная лазерная иридэктомия вызывала реактивную гипертензию в ранние сроки после операции в 100% случаев. Уровень внутриглазного давления варьировался от 17 до 28 мм рт. ст. в зависимости от дополнительной офтальмологической и сопутствующей соматической патологии. У пациентов с сопутствующей соматической патологией и отягощенным аллергическим анамнезом уровень реактивной гипертензии был выше.
Выводы. Комбинированная лазерная иридэктомия с адекватным медикаментозным сопровождением
до и после вмешательства является эффективной, безопасной процедурой и позволяет достигать целевого внутриглазного давления в ранние сроки после операции.
Можно выделить несколько тенденций, объясняющих необходимость применения мер профилактики развития реактивной гипертензии после лазерной иридэктомии. Первая – рост заболеваемости глаукомой в целом [1, 2] и закрытоугольной формой глаукомы в частности [2, 3]. В результате среди операций, выполняемых в лазерных офтальмологических подразделениях, увеличивается доля лазерной иридэктомии. Вторая – за помощью все чаще обращаются пациенты с сопутствующей соматической патологией (аутоиммунными, аллергическими, хроническими инфекционными и другими заболеваниями). Отягощенный анамнез повышает риск реактивной гипертензии после комбинированной лазерной иридэктомии (КЛИЭ). Третья – увеличение числа пациентов, которых не устраивают удлинение сроков реабилитации, дополнительные затраты и ограничения привычных нагрузок на период лечения из-за активного образа жизни или высоких профессиональных требований к остроте зрения. Изначально такие пациенты обращаются к офтальмологу только по поводу коррекции зрения (с помощью подбора очков или операции). Закрытие угла передней камеры глаза и синдром пигментной дисперсии могут протекать бессимптомно и не вызывать беспокойства. Не зная о диагнозе, пациенты ожидают от врача результатов лечения исходя из собственных представлений о состоянии зрения. Практикующие врачи в таких случаях часто прибегают к профилактической лазерной иридэктомии, не оценив предварительно местный и общий статус пациентов, что может вызвать развитие нежелательных послеоперационных осложнений и снизить эффективность процедуры. Хотя реальный риск осложнений при правильном проведении лазерной иридэктомии небольшой.
По нашим наблюдениям и данным литературы, в ранние сроки после профилактической лазерной иридэктомии из-за попадания пигмента радужки в трабекулярную сеть, а также выброса элементов крови в угол передней камеры глаза повышается внутриглазное давление (ВГД). Энергетическое воздействие лазера может приводить не только к кратковременному повышению ВГД, но и к отеку роговицы [4, 5], иридоциклиту. На фоне асептического воспаления из-за локального отека радужки реактивная гипертензия увеличивает риск образования гониосинехий в области периферической колобомы [6]. В небольшом проценте случаев рост ВГД регистрируется сразу после лазерного облучения и может протекать по типу острого приступа глаукомы. Однако, по данным некоторых исследователей, при ультразвуковой биомикроскопии, выполненной в ранние сроки после лазерной иридэктомии, в ряде случаев возникает увеальная эффузия [7–10] – скопление жидкости в супрахориоидальном пространстве между сосудистой оболочкой и склерой [11], что в свою очередь может стать причиной гипотонии [4]. Энергетическое воздействие лазера, анатомические особенности глаза и сопутствующие соматические заболевания аутоиммунной, инфекционной или аллергической природы влияют на результаты лазерной иридэктомии [12].
Рекомендуется применение комбинированных методик лазерного лечения для снижения энергетической нагрузки и риска развития послеоперационных осложнений. Для профилактики реактивной гипертензии, вызванной КЛИЭ, патогенетически обосновано использование нестероидных противовоспалительных препаратов и гипотензивных лекарственных средств.
Цель работы – оценить уровень реактивной гипертензии после лазерной иридэктомии, выполненной по комбинированной методике с соблюдением мер профилактики, включая медикаментозное сопровождение до и после операции, у пациентов с сопутствующими соматическими заболеваниями и отягощенным аллергическим анамнезом и без указанной патологии.
Материал и методы
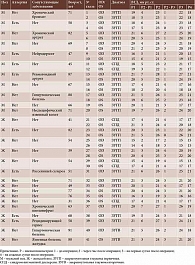
Проанализированы данные, полученные после выполнения КЛИЭ у 27 пациентов (41 глаз): 11 мужчин (средний возраст 68 лет) и 16 женщин (средний возраст 62 года). С целью наиболее полного изучения анамнеза использовалась унифицированная анкета, которая позволяла получить сведения об аллергических реакциях, инфекционных и аутоиммунных синдромах, других соматических заболеваниях и принимаемых лекарственных препаратах.
Пациенты были разделены на две группы. В первую группу вошли 14 человек с сопутствующими соматическими заболеваниями и аллергическими реакциями в анамнезе, во вторую – 13 человек без указанной патологии. Пациенты с заболеваниями в стадии декомпенсации не оперировались.
Основными показаниями для лазерной иридэктомии были первичная и вторичная закрытоугольная глаукома, синдром пигментной дисперсии. У 20 пациентов (32 глаза, 78%) диагностирована первичная закрытоугольная глаукома, у пяти (семь глаз, 17,1%) – синдром пигментной дисперсии, у двух пациентов (два глаза, 4,9%) выявлена вторичная закрытоугольная глаукома в связи с репозицией и подшиванием интраокулярной линзы.
Критерии исключения из исследования: острый приступ закрытоугольной глаукомы, некомпенсированное ВГД до лазерного вмешательства, неоваскулярная, травматическая глаукома, набухающая катаракта, а также показатели пахиметрии ниже 520 мкм и выше 570 мкм, поскольку эти состояния затрудняют оценку уровня реактивной гипертензии. Кроме того, в исследование не вошли пациенты с плоской радужкой, поскольку устранение относительного зрачкового блока при плоской конфигурации радужки не изменяет ширину угла передней камеры, измеряемой такими показателями, как дистанция открытия угла и трабекуло-радужковый угол, по данным ультразвуковой биометрии [13].
Пациенты проходили комплексное обследование: визометрию, пневмотонометрию, пахиметрию, биомикроскопию, офтальмо- и гониоскопию, компьютерную периметрию и оптическую когерентную томографию зрительного нерва и макулярной зоны.
Медикаментозное сопровождение лазерного вмешательства включало ряд мер.
- Инстилляции ингибитора синтеза простагландина препарата Неванак по одной капле два раза в день за два дня до процедуры с отменой на седьмые сутки после операции.
- Инстилляции 1%-ного пилокарпина однократно или двукратно за 30 минут до лазерной операции.
- Антибактериальный препарат Вигамокс местно (две капли), диуретик Диакарб 250 мг внутрь, гипотензивный препарат (блокатор карбоангидразы Азопт или бета-адреноблокатор Тимолол 5%) местно (две капли) однократно сразу после лазерной операции с учетом общих противопоказаний.
- Обязательное сохранение гипотензивного режима, если он был до операции.
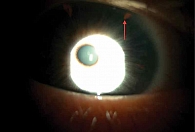
КЛИЭ выполняли в два этапа за один визит. Первый этап – коагуляция радужки при мощности 400–600 мВт с экспозицией 0,1–0,15 с при диаметре светового пятна в фокальной плоскости от 100 до 500 мкм. На 11 и 13 часах по периферии радужной оболочки, предпочтительно в проекции лакун, формировали два участка уплощения овальной формы с последующим развитием локальной зоны атрофии (рис. 1). Для манипуляции использовали офтальмологический лазер Visulas 532s (Carl Zeiss, Германия). На втором этапе в подготовленных участках излучением YAG-лазера Optimis II (Quantel Medical, Франция) формировали два сквозных отверстия. Перфорацию радужки достигали 2–5 импульсами с энергией в импульсе 3–5 мДж, длительностью 4 нс, диаметр светового пятна в фокальной плоскости системы наведения щелевой лампы составлял 10 мкм. Пневмотонометрию выполняли перед операцией, далее через час, на первые и седьмые сутки с помощью авторефкератотонометра Tonoref II (Nidek, Япония).
Результаты
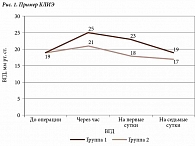
Показатели пневмотонометрии до КЛИЭ колебались от 14 до 21 мм рт. ст. (среднее значение 19 ± 2 мм рт. ст.) (таблица). Через час после лазерного вмешательства была выявлена реактивная гипертензия: уровень ВГД повысился на 4 ± 2 мм рт. ст., составив от 17 до 28 мм рт. ст. (среднее значение 23 ± 3 мм рт. ст.). На первые сутки после КЛИЭ уровень ВГД снизился в среднем на 2 ± 1 мм рт. ст., варьируя от 15 до 27 мм рт. ст. (среднее значение 21 ± 3 мм рт. ст.). На седьмые сутки он был ниже исходных данных на 1 мм рт. ст., составив от 13 до 21 мм рт. ст. (среднее значение 18 ± 2 мм рт. ст.). Случаев послеоперационной гипотонии не зафиксировано.
Таким образом, у всех пациентов отмечался подъем ВГД сразу после вмешательства. Вместе с тем уровень реактивной гипертензии отличался (рис. 2). Он был низким (до 4 мм рт. ст.) у пациентов без сопутствующей соматической патологии и отягощенного аллергического анамнеза, высоким (от 5 до 7 мм рт. ст.) – у пациентов с сопутствующей соматической патологией: ревматоидным артритом, гипертонической болезнью, хроническим пиелонефритом, неспецифическим язвенным колитом, нейродермитом, рассеянным склерозом и аллергическими реакциями в анамнезе. На первые сутки после операции в первой группе пациентов снижение ВГД было менее выраженным (в среднем 0–2 мм рт. ст.) по сравнению с пациентами второй группы (в среднем 3–4 мм рт. ст.).
Обсуждение
В результате проведенного комбинированного лечения уровень реактивной гипертензии не превысил отметку в 28 мм рт. ст. Все пациенты достигли целевого ВГД в ранние сроки после операции. Исходя из полученных данных, можно выделить основные факторы, обеспечивающие эффективность КЛИЭ.
Во-первых, применение КЛИЭ, включающей предварительную коагуляцию стромы, позволяет избежать геморрагических осложнений и подготовить участок уплощения для оптимальной перфорации радужки. Исключение попадания элементов крови в трабекулярную сеть и минимальные энергетические нагрузки при данной методике минимизируют уровень реактивной гипертензии в послеоперационном периоде.
Во-вторых, адекватное медикаментозное сопровождение до и после операции (использование нестероидных противовоспалительных и антибактериальных средств) блокирует воспаление в зоне воздействия и обеспечивает гипотензивный эффект. Входящий в состав Неванака непафенак проникает через роговицу и при помощи гидролаз превращается в активную форму амфенак, который ингибирует действие циклооксигеназы (простагландин-Н-синтазы) – фермента, необходимого для продукции простагландинов. Блокирование синтеза простагландинов уменьшает отек тканей, что способствует компенсации реактивной гипертензии после КЛИЭ.
В-третьих, применение унифицированной анкеты позволяет получить представление о состоянии здоровья пациентов, в том числе об иммунологических нарушениях, которые способны влиять на течение послеоперационного периода в виде выраженной офтальмогипертензии, а возможно, и гипотензии. У пациентов с признаками иммунной недостаточности (инфекционным, аллергическим, аутоиммунным синдромом) лазерное вмешательство может спровоцировать иридоциклит. Операционная микротравма приводит к образованию эндогенных факторов − продуктов распада клеток, и далее запускается воспалительный процесс. Вероятно, именно с воспалительным процессом связан более высокий уровень реактивной гипертензии у пациентов с ревматоидным артритом, хроническим пиелонефритом, неспецифическим язвенным колитом, хроническим бронхитом, нейродермитом и рассеянным склерозом. Механизм реализации иногда остается до конца не выясненным. Однако своевременная коррекция основного статуса и медикаментозное сопровождение до и после операции необходимы для прогнозирования результата КЛИЭ.
Гипертоническая болезнь в анамнезе также может сказаться на уровне гипертензии. Лазерная операция как стрессовый фактор способна спровоцировать резкий подъем артериального давления. Последующий прием гипотензивных препаратов, например антагонистов кальция, приведет к резкому расширению периферических артериол в результате блокады медленных кальциевых каналов в гладкомышечных клетках сосудов. При резком снижении экстравазального гидростатического давления усилится выход жидкости из капилляров в межтканевое пространство [14]. На фоне приема пилокарпина иридохрусталиковая диафрагма сместится кпереди. При этом возникнет недостаток объема в задней камере глаза и активируется так называемый вакуум-синдром [14]. Для восполнения недостающего объема произойдет транссудация плазмы из уже измененных сосудов хориоидеи [14]. Совокупность этих причин вызовет гипотонию за счет отслойки цилиарного тела [14]. В исследовании не было случаев гипотонии, поскольку в него не включались пациенты с острым приступом глаукомы и некомпенсированным артериальным давлением.
Выводы
Комбинированная лазерная иридэктомия вызывает реактивную гипертензию в ранние сроки после операции в 100% случаев.
Уровень реактивной гипертензии после КЛИЭ варьируется в пределах от 17 до 28 мм рт. ст. и зависит от наличия дополнительной офтальмологической и сопутствующей соматической патологии.
Комбинированная лазерная иридэктомия с адекватным медикаментозным сопровождением до и после вмешательства – эффективная и безопасная процедура, которая позволяет достичь целевого ВГД в ранние сроки после операции и избежать осложнений.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
E.I. Belikova, PhD, Prof., G.A. Sharova
Academy of Postgraduate Education FSBI FSCC FMBA of Russia
Ophthalmology Clinic of Dr. Belikova
Contact person: Galina A. Sharova, galina.shar@mail.ru
Relevance. An increase in the number of the patients diseases with the angle-closure form of glaucoma leads to an increase in the number of laser iridectomies. The presence of concomitant somatic pathology among patients seeking help has an effect on the results of surgical intervention, leading to an increase in the terms of rehabilitation.
Purpose – to evaluate the level of reactive hypertension after laser iridectomy, performed according to a combined technique with observance of preventive measures, including drug support before and after surgery both in patients with concomitant somatic pathology and aggravated allergic history, and without them present.
Material and methods. The analysis of the results of the clinical study was carried out on the basis of a combined laser iridectomy in 27 patients. For the purpose of the most complete history study, a unified questionnaire was used, including information
on allergic reactions, infectious and autoimmune syndromes, other somatic diseases and medications taken. Combined laser iridectomy was performed two stages in one visit. The first stage is coagulation in the projection of lacunae on the periphery
of the iris; at the second stage, two through holes were formed. All patients received medical support according to the given scheme. The level of reactive hypertension was evaluated 1 hour after surgery, on the first and seventh day after the intervention.
Results. Combined laser iridectomy causes reactive hypertension in the early stages after surgery in 100% of cases. Its level varies from 17 mm Hg up to 28 mm Hg depending on the presence of additional ophthalmic and concomitant somatic pathology. In the group of patients with concomitant somatic pathology and aggravated allergic history, the level of reactive hypertension was higher.
Conclusion. The use of a combined technique of laser iridectomy and adequate medical support before and after the intervention is an effective, safe procedure and allows you to achieve the target intraocular pressure in the early stages after surgery.

