Результаты адъювантной химиотерапии локального рака желудка
- Аннотация
- Статья
- Ссылки
- English
Цель нашего исследования – оценить влияние адъювантной химиотерапии по схеме XELOX на показатели выживаемости пациентов с диагнозом рака желудка и поражением регионарных лимфоузлов.
Материал и методы. Проанализированы данные пациентов с диагнозом рака желудка и поражением регионарных лимфоузлов, радикально оперированных по этому поводу с 2011 по 2015 г. в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Результаты. 127 (48,8%) больным из 260 пациентов, включенных в анализ, была назначена адъювантная химиотерапия по схеме XELOX. Пятилетняя выживаемость без прогрессирования составила 55,4 ± 4,4% в группе пациентов с поражением регионарных лимфоузлов, не получивших химиотерапию, и 65,6 ± 4,3% – в группе больных с поражением регионарных лимфоузлов, получивших химиотерапию. Пятилетняя общая выживаемость составила 67,8 ± 4,1 и 75,9 ± 3,9% соответственно. Токсический профиль комбинации XELOX был приемлемым, токсичность – регулируемой.
Выводы. Химиотерапия по схеме XELOX может быть рекомендована в качестве адъювантного лечения пациентам с диагнозом рака желудка и поражением регионарных лимфоузлов. Однако необходимы дальнейшие исследования роли адъювантной химиотерапии у пациентов без метастазов в регионарных лимфоузлах.
Цель нашего исследования – оценить влияние адъювантной химиотерапии по схеме XELOX на показатели выживаемости пациентов с диагнозом рака желудка и поражением регионарных лимфоузлов.
Материал и методы. Проанализированы данные пациентов с диагнозом рака желудка и поражением регионарных лимфоузлов, радикально оперированных по этому поводу с 2011 по 2015 г. в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Результаты. 127 (48,8%) больным из 260 пациентов, включенных в анализ, была назначена адъювантная химиотерапия по схеме XELOX. Пятилетняя выживаемость без прогрессирования составила 55,4 ± 4,4% в группе пациентов с поражением регионарных лимфоузлов, не получивших химиотерапию, и 65,6 ± 4,3% – в группе больных с поражением регионарных лимфоузлов, получивших химиотерапию. Пятилетняя общая выживаемость составила 67,8 ± 4,1 и 75,9 ± 3,9% соответственно. Токсический профиль комбинации XELOX был приемлемым, токсичность – регулируемой.
Выводы. Химиотерапия по схеме XELOX может быть рекомендована в качестве адъювантного лечения пациентам с диагнозом рака желудка и поражением регионарных лимфоузлов. Однако необходимы дальнейшие исследования роли адъювантной химиотерапии у пациентов без метастазов в регионарных лимфоузлах.




Актуальность исследования
Рак желудка является одной из наиболее актуальных проблем современной онкологии и занимает одну из лидирующих позиций по заболеваемости и смертности от онкологических заболеваний в мире. В 2018 г. в мире зарегистрировано свыше 1 000 000 новых случаев рака желудка и около 783 000 летальных исходов, связанных с заболеванием [1]. Уровень заболеваемости зависит от региона проживания [2]. В странах с высоким уровнем заболеваемости регистрируются более высокие показатели выживаемости, чем в странах с низким уровнем заболеваемости [3]. В России рак желудка находится на втором месте в структуре смертности и на шестом – в структуре заболеваемости злокачественными новообразованиями для лиц обоего пола. За 2017 г. в Российской Федерации диагностировано свыше 21 000 новых случаев заболевания раком желудка у мужчин и почти 16 000 – у женщин [4]. В большинстве случаев гистологически верифицированный рак желудка является аденокарциномой кишечного типа и локализуется в антральном отделе и теле желудка [5].
В настоящее время во всем мире хирургическое вмешательство остается единственным видом радикального лечения рака желудка. Однако в 40–60% случаев после такого лечения наблюдается рецидив заболевания [6]. Улучшить результаты лечения можно с помощью адъювантной химиотерапии. Так, результаты двух крупных азиатских исследований (ACTS-GC, CLASSIC) продемонстрировали улучшение показателей выживаемости при назначении химиотерапии после оперативного вмешательства [7, 8]. Тем не менее данные этих исследований требуют подтверждения. Кроме того, исследования выполнены в азиатской популяции пациентов. В связи с генетическими различиями, а также различиями в течении заболевания экстраполировать полученные результаты на европейскую популяцию нецелесообразно.
Целью нашей работы стала оценка результатов применения адъювантной химиотерапии с использованием комбинации XELOX (оксалиплатин, капецитабин) при локальном раке желудка. В задачи исследования входили оценка выживаемости без прогрессирования, общей выживаемости и определение спектра токсичности режима.
Материал и методы
Всего в исследование было включено 260 пациентов, прооперированных по поводу локального рака желудка, с гистологически подтвержденным поражением регионарных лимфоузлов. Пациенты были разделены на две группы. Первую группу составили 133 пациента, получивших только оперативное лечение, вторую – 127 больных, получивших адъювантную химиотерапию по схеме XELOX после оперативного вмешательства.
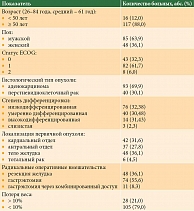
Характеристика пациентов первой группы (n = 133) представлена в табл. 1. Медиана возраста больных составила 61 (31–86) год. 16 (12%) пациентов были в возрасте < 50 лет, 117 (88%) в возрасте ≥ 50 лет. В первой группе насчитывалось 85 (71,43%) мужчин и 48 (28,57%) женщин. ECOG 0 имели 43 (32,3%), ECOG 1 – 82 (61,7%), ECOG 2 – восемь (5,71%) пациентов. В кардиальном отделе опухоль располагалась у 42 (31,6%) пациентов, в теле желудка – у 48 (36,1%), антральном отделе – у 37 (27,8%). Шесть (4,5%) пациентов имели тотальное опухолевое поражение желудка. Резекция желудка проведена 48 (36,1%) больным, гастрэктомия через абдоминальный и комбинированный доступ – 74 (55,6%) и 11 (8,3%) пациентам соответственно.
93 (69,9%) больных имели гистологический диагноз аденокарциномы, 40 (30,1%) – перстневидноклеточный рак. У 76 (57,1%) пациентов зарегистрирована низкодифференцированная опухоль, у 40 (30,1%) – умеренно дифференцированная, у 14 (10,5%) – высокодифференцированная. Трем (2,3%) пациентам установлен диагноз слизистой аденокарциномы. Потеря веса более чем на 10% за шесть месяцев отмечалась у 28 (21%) пациентов.
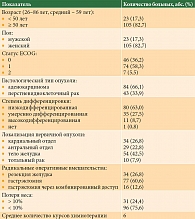
Характеристика больных второй группы (n = 127) представлена в табл. 2. Медиана возраста больных составила 59 (26–86) лет. 23 (17,3%) пациента были в возрасте < 50 лет, 105 (82,7%) в возрасте ≥ 50 лет. В этой группе насчитывалось 78 (61,4%) мужчин и 49 (38,6%) женщин. ECOG 0 имели 46 (36,2%), ECOG 1 – 74 (58,3%), ECOG 2 – семь (5,5%) пациентов. В кардиальном отделе опухоль располагалась у 34 (26,8%) больных, в теле желудка – у 54 (42,5%), антральном отделе – у 29 (22,8%). Десять (7,9%) пациентов имели тотальное опухолевое поражение желудка. Резекция желудка проведена 34 (26,8%) больным, гастрэктомия через абдоминальный и комбинированный доступ – 77 (60,6%) и 16 (12,6%) пациентам соответственно. 84 (66,1%) больных имели гистологический диагноз аденокарциномы, 43 (33,9%) – перстневидноклеточный рак. У 80 (63%) больных зарегистрирована низкодифференцированная опухоль, у 35 (27,6%) – умеренно дифференцированная, 11 (8,7%) – высокодифференцированная. У одного (0,8%) больного данные о дифференцировке опухоли отсутствовали. Потеря веса более чем на 10% за шесть месяцев отмечалась у 31 (24,4%) пациента. Всем 127 пациентам была назначена адъювантная химиотерапия по схеме XELOX.
Как уже отмечалось, все больные второй группы получили адъювантную химиотерапию по схеме XELOX: оксалиплатин 130 мг/м2 внутривенно капельно в первый день, капецитабин 2000 мг/м2 внутрь в 1–14-й дни 21-дневного цикла.
109 больных получили шесть курсов химиотерапии, 18 больных – четыре курса. Всего проведено 726 курсов химиотерапии. Токсичность данного режима оценивали у всех 127 больных. Частота нежелательных явлений, таких как нейтропения, тромбоцитопения, анемия, тошнота, рвота, диарея, стоматит, рассчитывалась как на количество больных, так и на количество курсов.
Гематологическая токсичность в группе комбинации XELOX была представлена нейтропенией, тромбоцитопенией и анемией (табл. 3). Нейтропения 1–2-й степени зарегистрирована у 22 (17,3%) больных (36/726 – 5% от общего количества курсов химиотерапии), нейтропения 3–4-й степени – у 17 (13,4%) пациентов (29/726 – 4% от общего количества курсов лечения). Все проявления нейтропении в этой группе были регулируемы и обратимы.
Тромбоцитопения 1–2-й степени отмечалась у 20 (15,7%) больных (88/726 – 12,1% от общего количества курсов химиотерапии), тромбоцитопения 3–4-й степени – у 14 (11%) пациентов (44/726 – 6,1% от общего количества курсов химиотерапии). Следует отметить, что ни у одного пациента с тромбоцитопенией 3–4-й степени не зафиксировано геморрагического синдрома.
У пяти (3,9%) больных группы комбинации XELOX имела место анемия 3-й степени, у 32 (25,2%) – анемия 1–2-й степени.
Частота возникновения негематологической токсичности в группе комбинации XELOX показана в табл. 4. У пяти (3,9%) пациентов зарегистрирована диарея 3-й степени, у четырех (3,1%) выявлен стоматит 3-й степени. Все осложнения были регулируемыми и обратимыми. У всех больных диареей и стоматитом 3-й степени была проведена редукция доз химиопрепаратов. В одном случае в связи с диареей 3-й степени потребовались экстренная госпитализация и проведение противодиарейной и инфузионной терапии.
Тошнота, рвота 1–2-й степени на фоне режима XELOX зарегистрированы у 19 (14,9%) пациентов после 97 (12,9%) курсов лечения. Однако тошнота 3-й степени отмечалась у восьми (6,3%) больных после лечения (1,2%). Явлений кожной токсичности, нефротоксичности в этой группе не наблюдалось.
Анализ возникшей на фоне лечения нейротоксичности показал, что данный побочный эффект проявлялся в основном периферической полинейропатией. Нейротоксичность 1–2-й степени отмечалась у 42 (33%) больных, 3-й степени – у 15 (11,8%) больных, в связи с чем терапия оксалиплатином у этих пациентов была завершена. Ладонно-подошвенный синдром 1–2-й степени у 35 (27,5%) больных не потребовал редукции дозы или отмены химиопрепаратов. Алопеция зафиксирована в 43,3% случаев, то есть почти у половины больных. У одного пациента зарегистрирована астения 3-й степени, в связи с чем химиотерапия была завершена досрочно. Еще у двух больных химиотерапию также пришлось прервать из-за выраженного демпинг-синдрома.
На основании этих данных можно сделать вывод, что токсический профиль комбинации XELOX был приемлемым, токсичность – регулируемой. Режим может быть рекомендован при адъювантной химиотерапии у пациентов с диагнозом рака желудка.
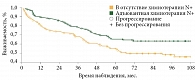
Мы провели тщательный анализ данных выживаемости и времени до прогрессирования в исследуемых группах. На рисунке 1 и в табл. 5 отражены результаты выживаемости без признаков заболевания в зависимости от объема поражения регионарных лимфоузлов и проведения адъювантной химиотерапии.
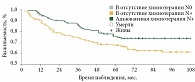
На рисунке 2 и в табл. 6 отражены показатели выживаемости без прогрессирования заболевания в зависимости от объема поражения регионарных лимфоузлов и проведения адъювантной химиотерапии.
Обсуждение результатов
Различия безрецидивной и общей выживаемости в группе пациентов с поражением регионарных лимфоузлов с добавлением адъювантной химиотерапии были статистически значимыми (p = 0,014 и p = 0,043 соответственно). Пятилетняя выживаемость без прогрессирования составила 55,4 ± 4,4% в группе пациентов с поражением регионарных лимфоузлов, не получивших химиотерапию, и 65,6 ± 4,3% в группе пациентов с поражением регионарных лимфоузлов, получивших химиотерапию. Пятилетняя общая выживаемость составила 67,8 ± 4,1 и 75,9 ± 3,9% соответственно.
Выводы
На основании сравнения результатов лечения можно сделать вывод об эффективности адъювантной химиотерапии у пациентов с поражением регионарных лимфоузлов. Токсический профиль комбинации XELOX был приемлемым, токсичность – регулируемой. Окончательный анализ полученных данных показывает, что этот режим может быть рекомендован в качестве адъювантной химиотерапии пациентам с диагнозом рака желудка и поражением локальных лимфоузлов.
A.A. Bobryshev, M.M. Davidov, M.N. Narimanov, S.B. Polikarpova, V.Yu. Kirsanov
I.M. Sechenov First Moscow State Medical University (Sechenov University)
Podolsk City Clinical Hospital
Contact person: Aleksandr A. Bobryshev, dr.abobryshev@mail.ru
Currently, a number of studies have been conducted evaluating the role of adjuvant chemotherapy in gastric cancer. However, these studies were conducted in the Asian patient population, and it is not reasonable to extrapolate the results to the European population.
The aim of our study is to evaluate the impact of adjuvant chemotherapy using the XELOX regimen on the survival rates of patients diagnosed with gastric cancer and regional lymph node lesions.
Material and methods. The data of patients diagnosed with gastric cancer and regional lymph node lesions that underwent radical surgery for this reason from 2011 to 2015 at the N.N. Blokhin Cancer Research Center of the Ministry of Health of the Russian Federation were analyzed.
Results. 127 (48.8%) patients out of 260 patients included in the analysis were prescribed adjuvant chemotherapy using the XELOX regimen. The five-year survival rate without signs of progression was 55.4 ± 4.4% in the group of patients with regional lymph node lesions who did not receive chemotherapy, and 65.6 ± 4.3% in the group of patients with regional lymph node lesions who received chemotherapy. The five-year overall survival rate was 67.8 ± 4.1 and 75.9 ± 3.9%, respectively. The toxic profile of the XELOX combination was acceptable, and the toxicity was regulated.
Conclusions. XELOX chemotherapy can be recommended as adjuvant treatment for patients diagnosed with gastric cancer in the presence of affected regional lymph nodes. However, further research is needed on the role of adjuvant chemotherapy in patients without metastases in regional lymph nodes.

