Роль Мабтеры в лечении рецидивов и резистентных форм В-клеточных неходжкинских лимфом
- Аннотация
- Статья
- Ссылки
По данным рандомизированных исследований, проведение высокодозной химиотерапии позволяет достичь 5-летней выживаемости у 35-51% больных с чувствительными рецидивами, что в 1,5-2 раза выше, чем при проведении стандартной химиотерапии второй линии (1). В то же время до 45-50% пациентов с рецидивом оказываются резистентными к индукционной химиотерапии, а около 40% больных, не ответивших ни на первую, ни на вторую линию химиотерапии, расцениваются как первично резистентные. Несмотря на то, что проведение химиотерапии II линии у ряда таких пациентов позволяет добиться полной ремиссии, в большинстве случаев она бывает кратковременной. Даже при использовании высокодозной химиотерапии 5-летняя выживаемость больных с первично резистентным течением или резистентными рецидивами лимфом высокой и промежуточной степени злокачественности составляет лишь 10-15% (2). Более того, в группе больных, расцениваемых на момент рефрактерного рецидива как имеющих средневысокий или высокий риск (международный прогностический индекс >2), проведение высокодозной химиотерапии не улучшает выживаемость по сравнению со стандартной терапией «спасения»(3). Так же неутешительны результаты лечения больных с лимфомами низкой степени злокачественности в 3-4 рецидиве или при резистентности к нескольким линиям терапии (4).
Попытки интенсификации режимов высокодозной химиотерапии, проведения 2-х и более высокодозных курсов увеличили частоту достижения полных ремиссий, однако это не привело к существенному улучшению отдаленных результатов лечения данной категории больных, что может быть обусловлено наличием клонов опухоли, абсолютно резистентных к химиотерапии или реинфузией жизнеспособных опухолевых клеток вместе с трансплантируемыми гемопоэтическими клетками. До последнего времени не существовало эффективного метода контроля минимальной остаточной опухоли, и большинство больных с рефрактерными неходжкинскими лимфомами рассматривались как кандидаты для проведения терапии сдерживания или симптоматического лечения.
В последние годы для лечения В-клеточных неходжкинских лимфом широко стали использоваться моноклональные антитела к антигену CD20-ритуксимаб (Мабтера). Антиген CD20 присутствует как на нормальных клетках лимфоидного ряда, начиная с пре-В и заканчивая В- лимфобластами, так и на их опухолевых эквивалентах, которыми представлены большинство В-клеточных лимфом (5). Ритуксимаб обладает отличным от химиопрепаратов механизмом действия и несравнимо низким уровнем токсичности, что теоретически позволяет рассматривать его как препарат для контроля минимальной остаточной болезни, резистентной к цитостатикам. Как показали исследования, данный препарат способен вызывать гибель CD20+ лимфомных клеток комплимент-зависимым путем (6), при помощи антитело-зависимой цитотоксичности (7), или индуцируя апоптоз (8). В исследованиях in vitro ритуксимаб оказывал синергидное действие с рядом цитостатиков (доксорубицин, флюдарабин, дексаметазон и т.д.) (9).
При лечении больных с В-клеточными лимфомами, экспрессирующими антиген CD20, ритуксимаб показал свою клиническую эффективность как в виде монотерапии, так и в комбинации с цитостатиками. В исследовании Coiffier B. et al. монотерапия ритуксимабом позволила добиться ремиссии у 31% больных с рефрактерным или рецидивирующим течением В-клеточных лимфом высокой и промежуточной степени злокачественности (10).
У не леченых пациентов с неходжкинскими лимфомами высокой и промежуточной степени злокачественности добавление ритуксимаба к стандартной химиотерапии по схеме СНОР позволило увеличить ее эффективность и добиться полной ремиссии у 75% больных (11).
В рандомизированном исследовании GELA LNH-98.5 у пожилых больных с диффузной крупноклеточной В-клеточной лимфомой проведение химиотерапии СНОР позволило добиться полной ремиссии у 62% больных, а использование комбинации СНОР+ритуксимаб – у 76% больных. Бессобытийная выживаемость больных, получивших комбинацию СНОР+ритуксимаб, была статистически значимо выше, чем у пациентов, получивших только СНОР (62% и 44%, соответственно). Положительное влияние ритуксимаба на выживаемость сохранилось и при стратификации по группам риска, согласно международному прогностическому индексу (12).
При лимфомах низкой степени злокачественности препарат также показал свою эффективность как в монотерапии (13), так и в комбинации с химиопрепаратами (14). У не леченных больных эффективность монотерапии ритуксимабом составила около 70%, хотя доля полных ремиссий и не превышала 20%. При использовании во II линии терапии препарат был эффективен у 48% больных. Ритуксимаб оказался эффективен и у пациентов, получавших этот препарат ранее. В ряде исследований была показана эффективность повторного применения ритуксимаба у пациентов, рецидивировавших после применения этого препарата. Частота и длительность ремиссии была даже несколько больше, чем при первом применении препарата (15).
Немаловажным преимуществом ритуксимаба является отсутствие у него перекрестной токсичности (особенно гематологической) с цитостатиками, используемыми при проведении как стандартной, так и высокодозной химиотерапии. Поскольку антиген CD20 не экспрессируется на стволовых клетках крови и плазмоцитах, ритуксимаб не вызывает подавления гемопоэза и снижения продукции антител.
Отсутствие воздействия на гемопоэтические клетки делает ритуксимаб привлекательным для использования с целью очистки трансплантата in vivo. Как показали исследования, использование ритуксимаба перед сбором периферических стволовых клеток крови (ПСК) не снижает эффективность сбора, однако значительно уменьшает риск контаминации гемопоэтического материала опухолевыми клетками (16).
Ритуксимаб показал свою эффективность и у больных с рецидивами агрессивных лимфом после высокодозной химиотерапии. Выбор методов терапии у данной категории больных крайне ограничен, что обусловлено риском развития глубокой и длительной миелосупрессии даже на фоне стандартной химиотерапии II линии. Проведение лечения ритуксимабом в данной группе больных позволило при хорошей переносимости получить 24% полных ремиссий с медианой продолжительности 10 месяцев (17).
В то же время, большинство ремиссий, достигаемых у пациентов с рефрактерными неходжкинскими лимфомами – частичные, и их продолжительность исчисляется месяцами, то есть использование данного препарата в монотерапии у данной категории больных приводит лишь к сдерживанию опухолевого роста. Учитывая наличие синергизма с цитостатическими препаратами и альтернативный механизм цитотоксичности, более перспективным представляется использование комбинации ритуксимаба с химиотерапией.
На основании этих данных мы предположили, что ритуксимаб может быть использован совместно с высокодозной химиотерапией для увеличения эффективности последней. Ритуксимаб предполагалось использовать на этапе получения ПСК (с целью очистки), перед высокодозной химиотерапией (с целью дополнительного противоопухолевого воздействия без увеличения токсичности) и в посттрансплантационном периоде (с целью контроля минимальной остаточной болезни). Для выявления эффективности и переносимости этой схемы было начато исследование по использованию Мабтеры в комбинации с высокодозной химиотерапией у больных с первично резистентным течением или рефрактерными рецидивами
В-клеточных неходжкинских лимфом, экспрессирующих CD20 антиген.
Материалы и методы
Анализу были подвергнуты результаты лечения всех больных с неходжкинскими лимфомами, получавшими высокодозную химиотерапию с трансплантацией аутологичных клеток предшественников гемопоэза в РОНЦ им. Н.Н. Блохина РАМН в период с января 1989 года по март 2005 года. За данный период высокодозное лечение получили 50 больных (20 женщин, 30 мужчин). На момент проведения высокодозной химиотерапии (ВХТ) средний возраст больных составил 32 года (от 16 до 58 лет).
Гистологический тип опухоли определялся на момент первичного диагноза и/или проведения ВХТ, и повторного пересмотра препаратов не проводилось. В связи с этим гистологический тип оценивался в зависимости от существовавшей на момент оценки классификации. Для унификации данных и дальнейшей оценки результатов больные были сгруппированы в зависимости от агрессивности опухоли. Лимфомы низкой степени злокачественности (фолликулярная лимфома) имели 3 пациента (6%), агрессивные лимфомы (мантийноклеточная, В-клеточная крупноклеточная, периферическая Т-клеточная) – 39 (78%) больных, крайне агрессивные лимфомы (из клеток предшественников, лимфобластная, Беркитта) –
8 больных (16%). В-клеточный фенотип опухоли имели 33 пациента (66%), Т-клеточный – 10 (20%), не уточненный – 7 больных (14%).
Все больные с фолликулярной лимфомой получили ВХТ после прогрессирования заболевания на фоне нескольких линий химиотерапии. Среди 47 пациентов с агрессивными и крайне агрессивными лимфомами первично резистентное течение имели 77% (36) больных, ранний рецидив – 19% (9), второй ранний рецидив – 2% (1) больных. У одного больного с крайне неблагоприятным прогнозом (2%) ВХТ была проведена в качестве консолидации первой полной ремиссии. Не считая индукции ремиссии перед ВХТ, до высокодозного лечения больные получили в среднем 2 (от 1 до 5) линии химиотерапии. Более 2-х линий химиотерапии получили 12 больных (24%). На фоне лечения, предшествовавшего индукционной химиотерапии или ВХТ, лишь 24% больных достигали частичной или полной ремиссии, у остальных наблюдалась лишь стабилизация болезни (13%) либо ее прогрессирование (63%). Перед началом индукционной химиотерапии или ВХТ (если индукция не проводилась) у всех больных было проведено рестадирование. На данном этапе IV стадию имели 38 больных (76%), III стадию – 9 (18%) больных, II – 3 (6%); симптомы интоксикации присутствовали у 20 больных (40%).
До ВХТ 46 (92%) больных получили реиндукцию ремиссии, под которой понималась стандартная химиотерапия II линии, целенаправленно проводимая (входящая в план высокодозного лечения) для оценки химиочувствительности опухоли и/или циторедукции перед ВХТ. В качестве режима реиндукции у 24 (48%) больных использовалась химиотерапия по схеме dexa-BEAM (дексаметазон, кармустин, этопозид, цитозар, алкеран), у 11 (22%) ифосфамид – содержащие режимы ICE (ифосфамид, этопозид, карбоплатин) или IVAM (ифосфамид, этопозид, цитозар, метотрексат), у 6 (12%) DHAP (дексаметазон, цисплатин, цитозар), у 4 (8%) – другие режимы. У 4 больных (8%) высокодозная химиотерапия была проведена без предварительной индукционной химиотерапии.
В качестве режима ВХТ 40 больных (80%) получили схему BEAM (кармустин 300 мг/м2, алкеран 140 мг/м2, этопозид 800-1000 мг/м2 и цитозар 800-1000 мг/м2). Режим CBV +/– митоксантрон (циклофосфамид 6 г/м2, кармустин 350-500 мг/м2, этопозид 1-1,5 г/м2 + митоксантрон 50 мг/м2) был использован у 3 больных (6%), прогрессировавших на фоне индукционной химиотерапии dеxa-BEAM. Второй курс высокодозной химиотерапии получили 3 (6%) больных, не ответивших полной ремиссией на первый курс ВХТ. В одном случае пациенту были проведены курсы BEAM и CBV, в двух других высокие дозы алкерана (140 мг/м2) и CBV. «Нестандартные» курсы высокодозной химиотерапии были проведены 4-м больным, получавшим лечение в первые годы функционирования отделения (по два курса высокими дозами мелфалана 140 мг/м2 получили 2 пациента, один курс высокими дозами мелфалана – 1 больной и курс dexa-BEAM с эскалацией доз цитозара и мелфалана – 1 больной).
В качестве трансплантата костный мозг (КМ) использовался у 4 больных (8%), клетки предшественники гемопоэза из периферической крови (КПГ ПК) у 30 (60%) больных, комбинированный трансплантат (КМ+КПГ ПК) – у 16 больных (32%). Среди пациентов, получавших КПГ ПК или комбинированный трансплантат (42 больных), среднее количество трансплантированных СД 34+ клеток составило 5,3х106/кг (от 0,01 до 26х106/кг). Учитывая крайне неблагоприятный прогноз ряда пациентов, у которых отсутствовали показания к альтернативным методам лечения (первично-прогрессирующее течение, резистентный рецидив), высокодозная химиотерапия проводилась, несмотря на малый сбор КПГ ПК. При сборе менее 1х106/кг дополнительно получали КМ и использовали комбинированный трансплантат, при сборе более 1х106/кг, но менее 2х106/кг вопрос о необходимости добавления к трансплантату КМ решался индивидуально. Доля больных с содержанием СD34+ клеток в трансплантате менее 1 х106/кг составила 19%, более 1х106/кг, но менее 2х106/кг – 28,6%. В посттрансплантационном периоде больные получали противоинфекционную, заместительную гемотрансфузионную и поддерживающую терапию в соответствии со стандартами, принятыми в период проведения ВХТ.
С сентября 2000 года для лечения больных с В-клеточными НХЛ и крайне неблагоприятным прогнозом (резистентный рецидив, первичная резистентность) на различных этапах высокодозного лечения стала использоваться Мабтера (ритуксимаб). Суммарно препарат получили 22 пациента (на этапе индукционной химиотерапии – 9 больных, перед сбором стволовых клеток и высокодозной химиотерапией – 19 больных, после восстановления гемопоэза – 15 больных). Из 22 пациентов 9 получили Мабтеру на 2-х этапах лечения, 6 – на 3-х. Кроме того, у 6 больных, не достигших полной ремиссии после ВХТ или имевших крайне высокий риск контаминации трансплантата, после восстановления гемопоэза было проведено 1-2 курса химиотерапии по схеме DHAP (с целью эрадикации минимальной остаточной болезни). Облучение остаточной опухоли или областей исходного массивного опухолевого поражения было проведено 13 больным (26%), достигшим полной или частичной ремиссии после проведения высокодозной химиотерапии.
Определения и статистический анализ
Первичная резистентность – прогрессирование в процессе химиотерапии I линии или в течение 3-х месяцев с момента ее окончания, отсутствие полной ремиссии после завершения химиотерапии I линии +/– лучевая терапия.
Ранний рецидив – рецидив заболевания через 3-12 месяцев после достижения полной ремиссии.
Реиндукция (индукция) ремиссии – химиотерапия II линии, целенаправленно (для оценки химиочувствительности и/или с целью циторедукции) проводимая перед ВХТ.
Общая выживаемость – выживаемость, исчисляемая методом Kaplan-Meyer, от момента проведения высокодозной химиотерапии до смерти от любой причины или даты последнего наблюдения.
Безрецидивная выживаемость – выживаемость, исчисляемая методом Kaplan-Meyer, у больных, достигших полной ремиссии, от момента проведения высокодозной химиотерапии до рецидива заболевания или даты последнего наблюдения.
Для сравнения кривых выживаемости использовался log-rank тест, статистически значимым считалось различие при р<0,05.
Непосредственные результаты лечения
Среди 46 больных, которым проводилась индукция ремиссии, в результате ее проведения полной ремиссии удалось добиться у 4 (8,7%), частичной – у 28 (60,9%), стабилизация была отмечена у 7 (15,2%) и прогрессирование – у 7 (15,2%). Непосредственно перед началом высокодозной химиотерапии (больные, получавшие и не получавшие индукцию) полная ремиссия сохранялась у 12% больных, частичная ремиссия – у 58%, стабилизация – у 14% и прогрессирование – у 16% пациентов. После проведения высокодозной химиотерапии были получены следующие результаты: полная ремиссия – 19 больных (43,2%), частичная ремиссия – 14 (31,8%), стабилизация – 4 (9,1%), прогрессирование – 7 (15,9%). У 6 больных эффект высокодозной химиотерапии не оценен в связи с ранней смертью или недостаточным временем наблюдения. После завершения всей программы лечения (дополнительная лучевая терапия, адьювантная иммунотерапия и/или химиотерапия) доля больных с полной ремиссией увеличилась до 62,5% (25 больных), частичная ремиссия сохранялась у 15% (6) больных, стабилизация – у 2 (5%) и прогрессирование – у 7 (17,5%). У 10 больных суммарный эффект не оценен по вышеперечисленным причинам.
Отдаленные результаты лечения
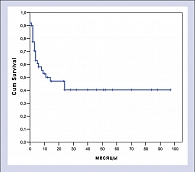
На момент проведения анализа (25.04.05 г.) медиана наблюдения за живущими (n=25) больными составила 23 месяца (от 1 до 97 месяцев).
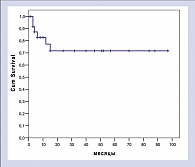
При данном периоде наблюдения прогнозируемая 5-летняя общая выживаемость составила 40,3% (медиана 14 месяцев). После 2-х лет наблюдения (11 больных) отмечено плато в общей выживаемости.
Токсичность лечения
Ранняя (100-дневная) токсическая смертность составила 14% (7 больных), при этом отмечена четкая тенденция к снижению токсической смертности в последние годы, что возможно обусловлено накоплением опыта работы и увеличением трансплантационной активности. С 2001 года до момента настоящего анализа ВХТ была проведена 29 больным (9 трансплантаций в год) и ранней токсической смертности отмечено не было.
Выводы и обсуждение
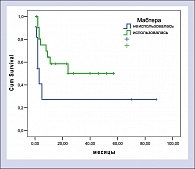
Большинство больных с резистентными лимфомами в настоящее время рассматриваются как кандидаты для проведения терапии сдерживания. Однако при проведении такого лечения пациент не имеет шансов на длительную ремиссию и, тем более, на выздоровление. К сожалению, проведение стандартной терапии II линии или высокодозной химиотерапии не приводит к существенному улучшению результатов лечения. Выбор тактики лечения обычно представляет большие трудности, так как больные с рефрактерными лимфомами обычно имеют плохое общее состояние и часто получают значительное количество курсов химиотерапии до «констатации» резистентности. Все это затрудняет проведение интенсивного лечения и тем более эскалацию доз цитостатиков в высокодозных режимах. Использование ритуксимаба совместно с высокодозной химиотерапией позволяет надеяться на улучшение результатов лечения, без существенного увеличения его токсичности. Как показало наше исследование, использование такого подхода позволяет получить длительные ремиссии даже у крайне неблагоприятной группы больных с рефрактерным течением заболевания и высоким IPI. Нам представляется целесообразным продолжение данного исследования.

