Соотношение окислительного стресса и умеренных когнитивных нарушений у пациентов с церебральным атеросклерозом: результаты проспективного когортного исследования
- Аннотация
- Статья
- Ссылки
- English
Материалы и методы. В проспективное когортное исследование были включены 106 пациентов с церебральным атеросклерозом и умеренными когнитивными нарушениями (УКН). Пациенты в течение 12 недель принимали стабильную терапию, направленную на коррекцию факторов сердечно-сосудистого риска. Оценка ОС проводилась методом хемилюминесценции липопротеинов (ЛП) сыворотки крови, УКН – с помощью Монреальской шкалы оценки когнитивных функций (МоСА) и индексов МоСА.
Результаты. 12-недельная стабильная терапия сосудистых рисков приводит к значительному улучшению показателей окислительного статуса. Выявлена корреляция между динамикой окислительных и когнитивных показателей на фоне стабильной терапии сосудистых рисков: индекс корреляции (r) между показателем резистентности ЛП к перекисному окислению липидов и индексом исполнительных функций составил 0,3 (р < 0,05), индексом внимания – 0,6 (р < 0,05), индексом памяти – 0,6 (р < 0,05). Индивидуальная позитивная динамика ОС ассоциирована с улучшением показателей памяти, внимания и исполнительных функций, а индивидуальная негативная динамика ОС сопровождается снижением вышеуказанных показателей.
Заключение. Проведенное исследование подтверждает вовлечение ОС в развитие УКН: коррекция окислительных нарушений сопровождается снижением когнитивного прогрессирования у пациентов с церебральным атеросклерозом.
Материалы и методы. В проспективное когортное исследование были включены 106 пациентов с церебральным атеросклерозом и умеренными когнитивными нарушениями (УКН). Пациенты в течение 12 недель принимали стабильную терапию, направленную на коррекцию факторов сердечно-сосудистого риска. Оценка ОС проводилась методом хемилюминесценции липопротеинов (ЛП) сыворотки крови, УКН – с помощью Монреальской шкалы оценки когнитивных функций (МоСА) и индексов МоСА.
Результаты. 12-недельная стабильная терапия сосудистых рисков приводит к значительному улучшению показателей окислительного статуса. Выявлена корреляция между динамикой окислительных и когнитивных показателей на фоне стабильной терапии сосудистых рисков: индекс корреляции (r) между показателем резистентности ЛП к перекисному окислению липидов и индексом исполнительных функций составил 0,3 (р < 0,05), индексом внимания – 0,6 (р < 0,05), индексом памяти – 0,6 (р < 0,05). Индивидуальная позитивная динамика ОС ассоциирована с улучшением показателей памяти, внимания и исполнительных функций, а индивидуальная негативная динамика ОС сопровождается снижением вышеуказанных показателей.
Заключение. Проведенное исследование подтверждает вовлечение ОС в развитие УКН: коррекция окислительных нарушений сопровождается снижением когнитивного прогрессирования у пациентов с церебральным атеросклерозом.






Введение
Окислительный стресс (ОС), являющийся неотъемлемым спутником старения, способствует прогрессированию цереброваскулярных заболеваний (ЦВЗ) и сопутствующих им когнитивных расстройств, которые становятся одной из наиболее частных причин инвалидности у лиц пожилого возраста [1].
Окисление липидов играет ключевую роль в патогенезе атеросклероза за счет повреждения эндотелия перекисно-модифицированными липопротеинами: их высокое патологическое сродство к «скэвенджер-рецепторам» макрофагов способствует превращению последних в «пенистые клетки» и накоплению их в атеросклеротических бляшках [2].
По сравнению с другими органами мозг более восприимчив к окислительному повреждению [3], а хроническая гипоперфузия мозга, обусловленная значительными изменениями цереброваскулярной регуляции, может ухудшать клеточные процессы, вызывая дисбаланс факторов эндогенной антиоксидантной системы и реактивных форм кислорода. В то же время окислительное повреждение сосудистой эндотелиальной клетки, глии и нейрона нарушает сосудистую функцию и нейрососудистое соединение, что может привести к формированию порочного круга в отношении дальнейшего уменьшения перфузии головного мозга [3–5]. Данные изменения приводят к появлению клинических синдромов, в частности когнитивных нарушений, прогрессирующих по мере утяжеления сосудистой недостаточности и коррелирующих с объемом пораженной ткани мозга [6].
Несмотря на наличие универсальных закономерностей, повреждающий эффект ОС всегда индивидуален, а особенности его течения определяются фоновым состоянием метаболизма мозга и реактивностью антиоксидантных систем [7]. В связи с этим клинический интерес представляет изучение влияния ОС на когнитивные функции, особенно возможностей его коррекции, что можно было бы рассматривать в качестве профилактики прогрессирования или предупреждения когнитивного снижения при ЦВЗ.
Нами проведено проспективное когортное исследование влияния стабильной 12-недельной сосудистой терапии на окислительные и когнитивные показатели у пациентов с церебральным атеросклерозом.
Материал и методы
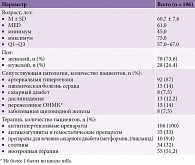
В проспективное когортное исследование были включены амбулаторные пациенты 45–75 лет с церебральным атеросклерозом (ЦА) и умеренными когнитивными нарушениями (УКН) (18–26 баллов по Монреальской шкале оценки когнитивных функций (МоСА)). Наличие ЦА подтверждено на основании следующих клинико-инструментальных характеристик:
- документированное сосудистое заболевание (атеросклероз и/или артериальная гипертензия);
- ультразвуковые признаки атеросклеротического поражения цереброваскулярного русла (по данным дуплексного сканирования магистральных артерий головы – МАГ);
- признаки морфологических изменений мозгового вещества по данным нейровизуализации (компьютерная томография/магнитно-резонансная томография).
Все участники исследования подписали информационный листок пациента и форму информированного согласия на участие в клиническом исследовании и использовали надежный метод контрацепции в ходе исследования.
В исследование не включались пациенты с наличием в анамнезе кровоизлияний, опухолей головного мозга, деменцией, воспалительными, атрофическими, демиелинизирующими, дегенеративными заболеваниями центральной нервной системы, декомпенсацией хронических соматических заболеваний, с неконтролируемой артериальной гипертензией, перенесенным острым нарушением мозгового кровообращения (ОНМК) менее чем за шесть месяцев до начала исследования (с оценкой по модифицированной шкале Рэнкина > 1).
В течение 12 недель исследования пациенты получали стабильную терапию, направленную на коррекцию сосудистых рисков, с неизменной дозой и комбинацией препаратов. Базовая терапия подбиралась индивидуально в каждом конкретном случае с учетом оценки категории сердечно-сосудистого риска [8] и включала антигипертензивные препараты (бета-адреноблокаторы, блокаторы кальциевых каналов, ингибиторы ренин-ангиотензиновой системы, диуретики), антиагреганты и антикоагулянты (ацетилсалициловая кислота, клопидогрел, дипиридамол, тиклопидин), статины, ноотропы, которые назначались согласно инструкции по применению.
В соответствии с поставленной целью всем пациентам определяли выраженность ОС и УКН исходно и через 12 недель от начала лечения. Параметры ОС измеряли методом хемилюминесценции (ХЛ) липопротеинов (ЛП) сыворотки крови, индуцированной ионами двухвалентного железа (Fe2+-индуцированной ХЛ) по методике Т.Н. Федоровой (2012) [9] с определением резистентности ЛП к перекисному окислению липидов (ПОЛ), уровня предобразованных продуктов (ПП) ПОЛ и способности ЛП к окислению.
УКН оценивали с помощью МоСА-теста [10], определяли общий балл МоСА (МоСА-Тotal) и МоСА-индексы по методике P. Julayanont [11]. Для расчета индекса исполнительных функций (ИИ) использовалась сумма баллов из пунктов:
- «создание альтернирующего пути», «часы», «внимание», «беглость речи», «абстракция», всего 13 баллов;
- индекса зрительно-конструктивных навыков (ИЗ) – «рисование куба», «рисование часов» и «называние животных», всего 7 баллов;
- индекса речи (ИР) – «называние животных», «повторение фразы», «беглость речи», всего 6 баллов;
- индекса внимания (ИВ) – «внимание», «повторение фразы» и «повторение слов», всего 18 баллов;
- индекса ориентации (ИО) – «ориентация», всего 6 баллов.
Индекс памяти (ИП) рассчитывался сложением количества слов при отсроченном воспроизведении, озвученных без подсказок, с подсказкой по категориям и подсказкой в виде множественного выбора, умноженного на 3, 2 и 1 соответственно, с оценкой от 0 до 15.
Методы статистики. Статистический анализ проведен в программной среде R 3.6.4. Применялись стандартные методы: для частотного анализа – точный критерий Фишера, для анализа непрерывных переменных – непараметрический критерий Вилкоксона (для медианных значений) или параметрический t-критерий Стьюдента (для средних значений). Выбор метода осуществлялся на основании результатов проверки на нормальность критерием Шапиро – Уилка. Приведены величины p-value и доверительные интервалы без поправки на множественность. Показатели представлены в виде среднего ± стандартное отклонение (М ± SD) и/или медиана (MED), первый и третий квартиль (Q1, Q3). Выполнено попарное сравнение средних и медианных значений в выделенных подгруппах. Различие между группами p < 0,05 принималось как значимое.
Исходные показатели пациентов. Включено 106 пациентов, средний возраст – 60,7 ± 7,6 года, 73,6% – женщины. Пациенты предъявляли жалобы на головную боль, головокружение, шум в голове, снижение памяти, работоспособности. ЦА, по данным ультразвуковой диагностики, проявлялся в виде сужения просвета МАГ различной степени выраженности (от гемодинамически незначимого стеноза до субкритического стеноза), морфологическая структура бляшек характеризовалась наличием признаков изъязвлений, кровоизлияний, отложений солей кальция, отмечались патологические деформации сонных артерий в виде извитости, перегибов, ангуляций, петель. При нейровизуализации у пациентов определялись диффузные атрофические изменения в виде расширения желудочковой системы или субарахноидальных пространств, признаки очаговых изменений серого и белого вещества в виде постишемических кист, субкортикального и перивентрикулярного лейкоареоза, лакунарные инсульты. Частота сопутствующих заболеваний и получаемая терапия представлены в табл. 1.
Показатели окислительного стресса. При базовой оценке окислительного статуса выявлены признаки недостаточности эндогенного антиоксидантного потенциала (среднее значение показателя резистентности ЛП к ПОЛ не достигало нижней границы нормы на 12,4 с), а также повышенного уровня окислительных процессов и продуктов ПОЛ (средние значения показателей уровня ПП ПОЛ и способности ЛП к окислению превышали верхние границы нормы на 6,7 и 22,3 mB соответственно) (табл. 2).
Через 12 недель стабильной терапии отмечалась позитивная динамика в виде статистически значимого повышения медианного показателя резистентности ЛП к ПОЛ (с 40 до 50 с; р < 0,001). Показатели уровня ПП ПОЛ и способности ЛП к окислению не претерпели значимых изменений на фоне лечения. Показатель резистентности ЛП к ПОЛ изменялся как в сторону увеличения (максимум до 54 с), так и в сторону уменьшения (минимум -30 с) (рис. 1). Принимая во внимание, что резистентность ЛП к ПОЛ является ведущим показателем для оценки состояния эндогенного антиоксидантного потенциала [9, 12–13], пациенты были разделены на две группы с учетом индивидуальной траектории по данному параметру на фоне лечения.
58 пациентов с позитивной динамикой ОС (увеличение показателя резистентности ЛП к ПОЛ на фоне лечения на ≥ 10 с) вошли в группу А, 48 пациентов с негативной динамикой ОС – в группу Б.
Для оценки взаимосвязи между когнитивными и окислительными нарушениями нами были проведены сравнительный анализ когнитивных показателей в группах А и Б и корреляционный анализ между динамикой показателя резистентности ЛП к ПОЛ и индексами МоСА через 12 недель стабильной терапии сосудистых рисков.
Результаты
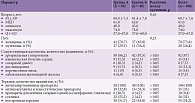
Исходные показатели пациентов двух групп представлены в табл. 3. Статистически значимых различий по возрасту и полу между группами не выявлено. Пациенты обеих групп получали сходную терапию, пациенты группы А чаще использовали статины (55,2 против 2% пациентов в группах А и Б соответственно; p < 0,05).
Значения медианных показателей резистентности ЛП к ПОЛ в сравниваемых группах исходно различались на 9,1 с; р < 0,05 (табл. 4). Значения показателей уровня ПП ПОЛ и способности ЛП к окислению исходно в группах А и Б не различались. Благоприятные изменения параметров ОС на фоне терапии в группе А выражались в виде прироста показателя резистентности ЛП к ПОЛ (дельта среднего значения составила 22,4 против 3,4 с в группах А и Б соответственно; р < 0,05). Помимо отрицательной динамики показателя резистентности ЛП к ПОЛ в группе Б наблюдалось прогрессирование ОС в виде тенденции к повышению показателя способности ЛП к окислению (Δ48,4 mB, р = 0,08) (рис. 2).
При оценке когнитивного фенотипа пациентов установлено, что исходные параметры МоСА-теста не различались между группами, за исключением ИП, медианное значение которого в группе А было выше на 1 балл; р < 0,05 (табл. 5). Выявлены мультидоменные расстройства когнитивных функций в виде преимущественного снижения показателей памяти (на 47/53%), исполнительных функций (на 33/30%), внимания (на 22/19%), речи (на 17/17%) и зрительно-конструктивных навыков (на 14/14%) в группах А и Б по сравнению с максимальными значениями индексов. Через 12 недель терапии у всех пациентов (n = 106) отмечалось повышение отдельных индексов МоСА: ИВ с 13,7 до 14,8 балла (р < 0,001), ИП с 7,4 до 8,1 балла (р < 0,001). По окончании терапии прирост ИВ и ИП наблюдался только в группе А (р < 0,05 – различия между показателями групп А и Б после лечения) (рис. 3).
При сравнении показателей после лечения между группами зафиксировано преимущество в группе А по приросту дельты средних показателей ИИ, ИВ и ИП – 0,4, 1,7 и 1,4 балла (-0,5, -0,6 и -0,7 балла в группе Б соответственно; р < 0,001) (рис. 3).
В ходе проведения корреляционного анализа между динамикой показателя резистентности ЛП к ПОЛ и индексами МоСА зафиксирована положительная связь умеренной степени выраженности с ИИ, ИВ и ИП. Так, индекс корреляции между показателем резистентности ЛП к ПОЛ и ИИ составил 0,3 (р < 0,05), ИВ – 0,6 (р < 0,05), ИП – 0,6 (р < 0,05).
Обсуждение
Оценка результатов 12-недельного наблюдения пациентов с УКН на фоне сердечно-сосудистых заболеваний (ССЗ), которые получали стабильную терапию, направленную на коррекцию сосудистых рисков, показала наличие связи между окислительными и когнитивными параметрами. Исходно у пациентов отмечались характерные признаки недостаточности эндогенного антиоксидантного потенциала (снижение показателя резистентности ЛП к ПОЛ ниже нормы) и преобладание окислительных реакций над восстановительными (значения уровня предобразованных продуктов ПОЛ и способности ЛП к окислению превышали норму). Через 12 недель наблюдения показатель резистентности ЛП к ПОЛ имел разнонаправленную индивидуальную динамику, что позволило выделить когорты пациентов с позитивными и негативными изменениями окислительного статуса. Ретроспективный анализ клинических характеристик позволяет предположить, что индивидуальная траектория окислительного статуса зависит от множества факторов. Среди них можно обсуждать модифицируемые коморбидные факторы сосудистого риска, влияющие на состояние окислительного статуса организма, и их медикаментозную коррекцию. Так, в настоящем исследовании отмечалась некоторая тенденция к преобладанию частоты сахарного диабета, дислипидемии у пациентов группы А, а также более частый прием этими пациентами статинов, обладающих собственным антиоксидантным действием, что могло повлиять на более выраженную положительную динамику ОС. Напротив, группа Б характеризовалась амнестическим типом УКН (исходное значение ИП ниже, чем у пациентов группы А: 8 и 7 баллов в группах А и Б соответственно; р < 0,05), что является неблагоприятным фактором в отношении прогрессирования УКН до деменции. Не исключено, что в группе Б окислительный статус был обусловлен не только сосудистыми факторами риска, но и развитием нейродегенеративного процесса.
Наиболее важной находкой исследования стало доказательство однонаправленных изменений когнитивных и окислительных параметров. Так, в группе А с позитивной динамикой ОС (которая проявлялась в виде прироста показателя резистентности ЛП к ПОЛ на 22,4 с, а также стабилизацией окислительных реакций и накопления продуктов ПОЛ) наблюдалось улучшение когнитивных показателей преимущественно за счет повышения значений МоСА-индексов, оценивающих внимание, память и исполнительные функции. В группе Б, которую составили пациенты с негативной динамикой ОС, имело место ухудшение со стороны когнитивных показателей преимущественно за счет снижения показателей исполнительных функций, внимания и памяти (дельта для ИИ, ИВ и ИП составила -0,5, -0,6 и -0,7 балла; р < 0,001 по сравнению с группой А). Проведенный корреляционный анализ также выявил наличие положительной связи умеренной степени выраженности между дельтой показателя резистентности ЛП к ПОЛ и дельтами индексов МоСА, отвечающих за память, внимание и исполнительные функции.
Как известно, в клиническом дебюте ЦВЗ среди УКН превалируют нарушения концентрации внимания, памяти и регуляторных когнитивных функций, что связано с разобщением связи лобных долей с подкорковыми и стволовыми отделами, а также недостатком мозгового кровообращения [14]. Как показало данное исследование, именно дефицит когнитивной сферы, связанной с «лобной» деятельностью (тест соединения букв и цифр, беглость речи, обобщения и др.), а также недостаток внимания и памяти отмечались у пациентов. Кроме того, выявленная взаимосвязь между окислительными нарушениями и показателями внимания, памяти и исполнительных функций может свидетельствовать об уязвимости данных когнитивных функций к процессам свободно-радикального окисления.
Степень атеросклеротического процесса у пациентов обеих групп варьировалась от начального до выраженного поражения артерий, однако взаимосвязь между окислительными и когнитивными нарушениями с учетом тяжести церебрального поражения и оценка ЦА в динамике в рамках данной работы не были запланированы, что можно расценивать как ограничение исследования. Известно, что реакции ОС и ишемического каскада потенцируют друг друга [15]. Клинические наблюдения свидетельствуют о том, что повышение активности эндогенных антиоксидантов и снижение способности липопротеиновых структур к окислению сопровождаются улучшением корковой перфузии у больных с инфарктами мозга [16]. При этом положительное действие антиоксидантов на кровоснабжение мозга может быть обусловлено нормализацией процессов сопряжения нейронов и сосудов [17]. В связи с этим представляется целесообразным проведение дальнейших, в том числе лонгитудинальных исследований, оценивающих влияние коррекции окислительных нарушений на выраженность атеросклеротического процесса. Это позволит расширить представления как о патогенетических механизмах повреждения мозговой ткани, так и возможностях нивелирования сосудистых факторов риска.
Заключение
Проведенное исследование подтверждает концепцию потенциального вклада ОС в развитие УКН. Показано, что индивидуальная позитивная динамика ОС ассоциирована с улучшением когнитивных функций, ответственных за память, внимание, исполнительные функции, а индивидуальная негативная динамика ОС сопровождается снижением указанных выше когнитивных показателей. Для профилактики и лечения УКН на фоне ССЗ включение в комплексную терапию препаратов с антиоксидантым действием представляется обоснованной стратегией.
O.V. Vorobyeva, PhD. Prof., K.V. Nikulina, V.V. Fateeva, PhD
Sechenov First Moscow State Medical University
Contact person: Ksenia V. Nikulina, ksenikk@mail.ru
Introduction. Oxidative stress (OS) underlies cerebrovascular diseases and cognitive decline, but its damage depends on individual reactivity of the antioxidant system. The results of a study of correcting vascular risks impact on oxidative and cognitive indicators in patients with cerebral atherosclerosis are presented.
Materials and methods. Patients with cerebral atherosclerosis and mild cognitive impairment (MCI), n = 106, were included. Patients received stable therapy for correcting cardiovascular risk factors during 12 weeks. The method of chemiluminescence of lipoproteins (LP) of the blood serum and the Montreal Cognitive Assessment (MoCA) including MoCA indices were used.
Results. It was noted that 12-week stable therapy leads to a significant improvement in the indicators of oxidative status. A correlation was revealed between the dynamics of oxidative and cognitive indicators: the correlation index (r) between the resistance to peroxide oxidation of lipids and the index of executive functions was 0.3 (p < 0.05), the index of attention – 0.6 (p < 0.05), the index of memory – 0.6 (p < 0.05). Individual positive dynamics of the OS was associated with an improvement in memory, attention and executive functions, and individual negative dynamics of the OS was accompanied by a decrease in the above indicators.
Conclusion. The conducted study confirms the involvement of OS in the development of MCI – correction of oxidative disorders is accompanied by a decrease in the progression of cognitive decline in patients with cerebral atherosclerosis.

