Состояние микробного метаболизма в толстой кишке после холецистэктомии
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследовано 40 пациентов, перенесших холецистэктомию по поводу желчнокаменной болезни. Больные были разделены на две группы. В первую вошли 20 пациентов с синдромом хронической диареи, во вторую – 20 пациентов без диареи. Контрольную группу составили 10 пациентов, сопоставимых по полу и возрасту с больными первой и второй групп, без заболеваний желудочно-кишечного тракта. У всех пациентов оценивали содержание КЖК в копрофильтрате методом газожидкостной хроматографии. Суточную экскрецию ЖК с калом определяли спектрофотометрическим ферментным методом.
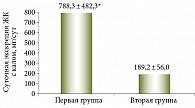
Результаты. В группе пациентов с хронической диареей суточная экскреция ЖК с калом составила 788,3 ± 482,3 мг/сут (р < 0,05), что значительно превысило результаты в контрольной (198,6 ± 64,3 мг/сут) и второй группах (189,2 ± 56,0 мг/сут).
Суммарный уровень КЖК в копрофильтрате оказался сниженным и в первой, и во второй группе. После оценки вклада ЖК в нарушение микробной экологии у пациентов с избыточной экскрецией ЖК с калом (первая группа) был проведен корреляционный анализ, который выявил достоверную обратную взаимосвязь между суммарным количеством КЖК и суточной экскрецией ЖК (r = -0,4333; p = 0,005). При сравнении структуры КЖК в двух группах пациентов установлен факт снижения концентрации бутирата и его доли (С4, %) в суммарной величине концентраций метаболитов в группе пациентов с диареей.
Заключение. У больных после холецистэктомии увеличение концентрации ЖК в кале способствует развитию особого вида секреторной диареи – хологенной диареи. У пациентов с хологенной диареей количественное и качественное изменение состава КЖК свидетельствует о дисбиотических нарушениях.
Материал и методы. Обследовано 40 пациентов, перенесших холецистэктомию по поводу желчнокаменной болезни. Больные были разделены на две группы. В первую вошли 20 пациентов с синдромом хронической диареи, во вторую – 20 пациентов без диареи. Контрольную группу составили 10 пациентов, сопоставимых по полу и возрасту с больными первой и второй групп, без заболеваний желудочно-кишечного тракта. У всех пациентов оценивали содержание КЖК в копрофильтрате методом газожидкостной хроматографии. Суточную экскрецию ЖК с калом определяли спектрофотометрическим ферментным методом.
Результаты. В группе пациентов с хронической диареей суточная экскреция ЖК с калом составила 788,3 ± 482,3 мг/сут (р < 0,05), что значительно превысило результаты в контрольной (198,6 ± 64,3 мг/сут) и второй группах (189,2 ± 56,0 мг/сут).
Суммарный уровень КЖК в копрофильтрате оказался сниженным и в первой, и во второй группе. После оценки вклада ЖК в нарушение микробной экологии у пациентов с избыточной экскрецией ЖК с калом (первая группа) был проведен корреляционный анализ, который выявил достоверную обратную взаимосвязь между суммарным количеством КЖК и суточной экскрецией ЖК (r = -0,4333; p = 0,005). При сравнении структуры КЖК в двух группах пациентов установлен факт снижения концентрации бутирата и его доли (С4, %) в суммарной величине концентраций метаболитов в группе пациентов с диареей.
Заключение. У больных после холецистэктомии увеличение концентрации ЖК в кале способствует развитию особого вида секреторной диареи – хологенной диареи. У пациентов с хологенной диареей количественное и качественное изменение состава КЖК свидетельствует о дисбиотических нарушениях.

Желчнокаменная болезнь (ЖКБ) встречается у 10–15% взрослого населения европейских стран [1]. Это объясняется изменением характера питания, образа жизни, а также внедрением современных диагностических методик.
В настоящее время лапароскопическая холецистэктомия является золотым стандартом при ЖКБ. Возросшая оперативная активность способствовала увеличению количества больных с различными вариантами течения постхолецистэктомического синдрома. Несмотря на большое количество клинических наблюдений и публикаций, вопросы о наличии данного синдрома и его классификации остаются дискутабельными.
По данным многих авторов, у 15–40% пациентов после холецистэктомии сохраняются клинические симптомы и различные патологические изменения в органах пищеварения [2, 3]. M. Fisher и соавт. описали диарею, связанную с избыточным поступлением желчных кислот (ЖК) в толстую кишку у 17% больных после лапароскопической холецистэктомии [4]. А.И. Парфенов рассмотрел хологенную диарею как вариант секреторной формы [5, 6].
В исследовании W. Wang и соавт., результаты которого были опубликованы в 2018 г., изучалась связь между изменением состава кишечной микробиоты после холецистэктомии и развитием колоректального рака [7]. Авторы предположили, что усиление бактериальной деконъюгации и дегидроксилирования ЖК приводит к увеличению доли вторичных ЖК, образующихся в толстой кишке под влиянием кишечной микрофлоры. Вторичные ЖК оказывают повреждающее воздействие на эпителий толстой кишки и тем самым повышают риск развития колоректального рака.
Изменение микробиоценоза кишечника выявляется у 79–89% пациентов с ЖКБ. После холецистэктомии снижается уровень облигатных симбионтов лакто- и бифидобактерий [8–11]. В процессе метаболизма кишечные микробы высвобождают короткоцепочечные жирные кислоты (КЖК), играющие важную роль в поддержании здоровья человека. Ключевыми из них являются бутират, пропионат и ацетат, образующиеся при микробном брожении непереваренных остатков пищи. Скорость и количество продукции КЖК зависят от вида и количества микрофлоры, присутствующей в толстой кишке, источника субстрата и времени транзита содержимого кишечника. Концентрация КЖК изменяется вдоль оси толстой кишки: самые высокие уровни в проксимальном отделе, самые низкие – в дистальном [12]. КЖК снижают рН толстой кишки. Повышение значений рН в толстой кишке приводит к увеличению активности ферментов, приводящих к избыточному образованию дезоксихолевой кислоты и, как следствие, усилению диареи [11].
Один из основных метаболитов – бутират участвует в поддержании нормального функционирования толстой кишки, обеспечивая колоноциты примерно 70% энергии. Как показывают результаты исследований, КЖК обладают противовоспалительным и антиканцерогенным действием, играют важную роль в поддержании метаболического гомеостаза в колоноцитах и защищают их от внешнего воздействия [13–19].
Таким образом, с помощью исследования метаболитов КЖК у пациентов после холецистэктомии можно оценить микробиоценоз кишечника и его влияние на энтерогепатическую циркуляцию.
Цель данного исследования – выявить взаимосвязь между содержанием КЖК (продуктов бактериального метаболизма в толстой кишке) и уровнем экскреции ЖК с калом после холецистэктомии.
Материал и методы
Обследовано 40 пациентов, перенесших холецистэктомию по поводу ЖКБ в срок от года до десяти лет.
Все больные были разделены на две группы. В первую вошли 20 пациентов (двое мужчин и 18 женщин, средний возраст – 59,1 ± 9,1 года) с синдромом хронической диареи, во вторую – 20 пациентов без диареи (трое мужчин и 17 женщин, средний возраст – 58,3 ± 8,6 года).
Для исключения онкологических, воспалительных и эндокринных заболеваний всем пациентам проведены следующие обследования: сбор жалоб и анамнеза, объективный осмотр, лабораторные исследования (общий и биохимический анализы крови, копрологическое исследование, посев кала на дисбактериоз), инструментальные исследования (ультразвуковое исследование органов брюшной полости, эзофагогастродуоденоскопия, ректороманоскопия и колоноскопия).
Контрольную группу составили 10 пациентов, сопоставимых по полу и возрасту с пациентами групп исследования, без заболеваний желудочно-кишечного тракта.
В копрофильтратах методом газожидкостной хроматографии определяли содержание КЖК: уксусной (С2), пропионовой (С3), масляной (С4), валериановой, капроновой и изоформ этих кислот.
Суточную экскрецию ЖК с калом оценивали спектрофотометрическим ферментным методом.
Статистическая обработка результатов выполнена с помощью пакетов программы Microsoft Excel 2010. Для параметрических переменных определяли среднее значение показателя по группе пациентов (М), стандартное отклонение (SD). Различие средних величин считалось достоверным при уровне значимости p < 0,05.
Результаты и их обсуждение
В первой группе суточная экскреция ЖК с калом составила 788,3 ± 482,3 мг/сут (р < 0,05), что значительно превысило результат контрольной группы – 198,6 ± 64,3 мг/сут. Избыточное количество ЖК, поступающих в толстую кишку через медиатор циклического аденозинмонофосфата, приводит к ингибированию всасывания и усилению секреции воды и электролитов, вызывая секреторную хологенную диарею.
У больных второй группы без диареи средний уровень суточной экскреции составил 189,2 ± 56,0 мг/сут, что не отличалось от показателей пациентов контрольной группы.
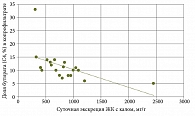
При сравнении средних значений суточной экскреции ЖК обеих групп выявлены достоверные отличия (рис. 1).
Суммарный уровень КЖК в копрофильтрате оказался сниженным в обеих группах. Однако снижение в первой группе было значительно больше, чем во второй. Это свидетельствовало об уменьшении метаболической активности микрофлоры толстой кишки у больных с хологенной диареей.
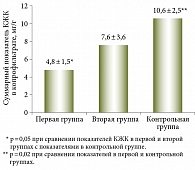
Средние значения суммарной концентрации КЖК в первой группе составили 4,8 ± 1,5 мг/г, что значительно отличалось от показателей контрольной группы – 10,6 ± 2,5 мг/г (p < 0,005). Во второй группе суммарные концентрации КЖК оказались несколько выше – 7,6 ± 3,6 мг/г, но также не достигли значений контрольной группы (10,6 ± 2,5 мг/г; p < 0,02) (рис. 2).
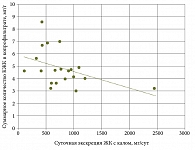
При оценке вклада ЖК в нарушение микробной экологии у пациентов с избыточной экскрецией ЖК с калом (первая группа) был проведен корреляционный анализ: выявлена достоверная обратная взаимосвязь между суммарным количеством КЖК и суточной экскрецией ЖК (r = -0,4333; p = 0,005) (рис. 3).
Полученные результаты подтвердили, что повышенное содержание ЖК влияет на уровень метаболической активности кишечной микробиоты, значительно снижая ее количество.
При сравнении структуры КЖК в двух группах (таблица) внимание привлек факт снижения концентрации бутирата и его доли (C4, %) в суммарной величине концентраций метаболитов в группе с хологенной диареей. При анализе полученных данных обнаружено, что среднее значение доли бутирата достигло 11,7 ± 4,6% (в группе контроля – 16,1 ± 5,1%).
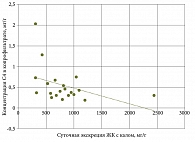
Установлена достоверная обратная корреляционная связь между концентрацией бутирата и концентрацией ЖК (r = -0,3998; p = 0,05) (рис. 4) и между его долей и концентрацией ЖК (рис. 5) у пациентов первой группы (r = -0,5311; p = 0,02).
В отличие от первой во второй группе корреляционной зависимости между абсолютной и относительной концентрацией бутирата и суточной экскрецией ЖК не выявлено. Установлено увеличение доли изокислот – метаболитов условно патогенных протеолитических бактерий (изомасляной, изовалериановой, изокапроновой) в обеих группах пациентов по сравнению с контрольной группой: у пациентов с диареей (первая группа) суммарная доля этих метаболитов составила 13,3 ± 7,5%, у пациентов без диареи (вторая группа) – 12,3 ± 5,9%, что достоверно выше, чем в контрольной группе – 5,9 ± 1,1% (р=0,002). Это подтверждает развитие дисбиотических изменений у пациентов, перенесших холецистэктомию.
По нашим данным, у части пациентов после холецистэктомии развивается диарейный синдром, обусловленный избыточным поступлением ЖК в толстую кишку. Кроме того, у таких пациентов имеют место количественные и качественные изменения состава КЖК в копрофильтрате, более выраженные в отношении масляной кислоты – важного фактора регуляции пролиферации и дифференцировки эпителия толстой кишки.
В исследовании И.Д. Лоранской и соавт. у большинства больных после холецистэктомии в разные сроки после операции отмечались клинические симптомы поражения толстой кишки (болевой синдром – 86,7% случаев, нарушение стула – 91,7%), а также дисбиотические нарушения кишечной микрофлоры (100% случаев) в отличие от больных ЖКБ и пациентов контрольной группы без патологии желчевыводящей системы. При гистологическом исследовании биоптатов толстой кишки в исследуемых группах наблюдались атрофия слизистой оболочки (66,7% случаев), очаги дисплазии эпителия (8,3%) с преобладанием поражения проксимальных отделов толстой кишки [11].
Сказанное позволяет предположить, что после холецистэктомии пациенты нуждаются в диспансерном наблюдении и обследовании с учетом имеющихся сведений о развитии у такой категории больных колоректального рака [20, 21].
В настоящее время опубликовано много работ, подтверждающих положительный эффект пищевых волокон. Применение пищевых волокон способствует увеличению производства КЖК, характеризующихся провоспалительными и противоопухолевами свойствами, путем их бактериальной ферментации в толстой кишке [22–24].
Результаты исследования КЖК позволяют с новых позиций рассмотреть взаимосвязь между микробиоценозом кишечника и изменением пула ЖК после холецистэктомии.
Выводы
У пациентов после холецистэктомии увеличивается концентрация ЖК в кале, что способствует развитию хологенной диареи.
У больных хологенной диареей количественное и качественное изменение состава КЖК свидетельствует о дисбиотических изменениях.
Наиболее значимые изменения КЖК у пациентов с хологенной диареей связаны с уменьшением содержания бутирата в просвете толстой кишки, что увеличивает риск развития дистрофических изменений в эпителиальном слое слизистой оболочки толстой кишки вследствие недостаточности энергообеспечения колоноцитов.
L.Kh. Indeykina, E.A. Sabelnikova, MD, PhD, S.Yu. Silvestrova, PhD, L.M. Krums, MD, PhD, A.I. Parfyonov, MD, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific and Practical Center
Contact person: Liliya Kh. Indeykina, l.indeykina@mknc.ru
The Purpose of this study is to identify the relationship between the amount of short-chain fatty acids in coprofiltrate and the level of bile acids in feces in patients after cholecystectomy.
Material and methods. 40 patients undergoing cholecystectomy due to cholelithiasis were examined.
All patients were divided into 2 groups: the first group included 20 patients with a chronic diarrhea syndrome, the second group consisted of 20 patients without diarrhea. The control group consisted of 10 patients without diseases of the gastrointestinal tract. All groups were comparable in terms of age and sex. Тhe content of short-chain fatty acids in coprofiltrates was determined by gas-liquid chromatography; daily excretion of bile acids (BA) with feces was determined using a spectrophotometric enzyme method in all patients.
Results. In the group of patients with chronic diarrhea, daily excretion of BA with feces was 788.3 ± 482.3 mg/day (p < 0.05), which significantly exceeded the result of the control group (198.6 ± 64.3 mg/day) and the result of the second group without diarrhea (189.2 ± 56.0 mg/day).The total level of fatty acids (FAs) in coprofiltrates was reduced in both groups of patients. To assess the contribution of BA to the disbalance of microbial ecology in patients with evaluated excretion of bile acids, a correlation analysis was carried out. A reliable inverse relationship between the total amount of FAs and daily excretion of BA: (r = -0.4333; p = 0.005) was established. By comparing the structure of fatty acids in two groups of patients, the fact of a reduced concentration of butyrate and its fraction (C4, %) in the total concentration of metabolites in the group of patients with diarrhea was revealed.
Conclusion. In patients after cholecystectomy, an increased concentration of bile acids in the feces contributes to the development of a special type of secretory diarrhea – cholera diarrhea. In patients with cholera diarrhea, a quantitative and qualitative change of the composition of short-chain fatty acids indicates dysbiotic disorders.

