Современная терапия остеоартрита
- Аннотация
- Статья
- Ссылки
- English
В настоящее время накапливается все больше данных о роли воспаления в деградации хряща и костной ткани, а также в формировании клинической симптоматики ОА. Необходимость подавления хронического воспалительного процесса обусловливает назначение медикаментозной терапии. Наиболее активно при ОА применяются две группы препаратов – нестероидные противовоспалительные препараты (НПВП) и симптоматические медленно действующие препараты, которые ранее часто неточно назывались хондропротекторами. Современные клинические рекомендации среди НПВП особо выделяют целекоксиб, среди симптоматических медленно действующих препаратов – глюкозамина сульфат и хондроитина сульфат, а также их комбинации из-за оптимального соотношения эффективности и безопасности. Российский и зарубежный опыт также позволяет обосновать применение нимесулида и диацереина как препаратов с уникальными механизмами действия, позволяющих индивидуализировать терапию ОА. Все эти препараты в России представлены качественными и доступными генериками, что позволяет существенно снизить расходы на лечение.
В настоящее время накапливается все больше данных о роли воспаления в деградации хряща и костной ткани, а также в формировании клинической симптоматики ОА. Необходимость подавления хронического воспалительного процесса обусловливает назначение медикаментозной терапии. Наиболее активно при ОА применяются две группы препаратов – нестероидные противовоспалительные препараты (НПВП) и симптоматические медленно действующие препараты, которые ранее часто неточно назывались хондропротекторами. Современные клинические рекомендации среди НПВП особо выделяют целекоксиб, среди симптоматических медленно действующих препаратов – глюкозамина сульфат и хондроитина сульфат, а также их комбинации из-за оптимального соотношения эффективности и безопасности. Российский и зарубежный опыт также позволяет обосновать применение нимесулида и диацереина как препаратов с уникальными механизмами действия, позволяющих индивидуализировать терапию ОА. Все эти препараты в России представлены качественными и доступными генериками, что позволяет существенно снизить расходы на лечение.
Введение
Остеоартрит (ОА), устаревшее остеоартроз, – широко распространенное во всем мире инвалидизирующее заболевание. Ранее патология считалась результатом повреждения и возрастного износа суставов, в настоящее время – результатом сложного взаимодействия локальных и системных факторов [1].
Распространенность ОА в популяции старше 65 лет составляет от 88 до 240 случаев на 100 тыс. в зависимости от локализации [2]. Согласно данным официальной статистики, в России с 2011 по 2016 г. отмечался прирост общей заболеваемости с 32,2 до 35,7 на 1 тыс. населения. При этом наибольшая доля случаев приходилась на лиц пенсионного возраста – в среднем 33,2% из расчета числа зарегистрированных больных на общую численность населения данной возрастной категории [3].
Бремя ОА для общества весьма велико, что в первую очередь связано с хронической болью [4]. Резко снижается качество жизни больных [2]. Значительную проблему представляет и терапия хронической боли, особенно у пожилых пациентов, из-за ограничения диапазона препаратов в связи с коморбидной патологией и риска лекарственных взаимодействий [5]. Сниженная мобильность пациентов, обусловленная как болевым синдромом, так и нарушением функции суставов, может осложнять течение сердечно-сосудистых заболеваний, сахарного диабета и т.д. [6].
К сожалению, приходится констатировать, что терапия болевого синдрома и других проявлений ОА до сих пор не разработана в достаточной степени. Существенная часть пациентов не удовлетворены результатами лечения. По данным рандомизированных клинических исследований, доля отвечающих на терапию составляет порядка 50% [7]. В реальной клинической практике аналогичная ситуация. Неадекватный контроль боли отмечается у 51,3–54,0% больных ОА [7–9].
В работе А.Е. Каратеева указан ряд объективных и субъективных факторов недостаточной эффективности анальгетической терапии при скелетно-мышечной боли [7].
- Фенотипическое разнообразие скелетно-мышечной боли – преобладание различных патогенетических механизмов (например, воспаления, биомеханических нарушений, элементов дисфункции ноцицептивной системы и др.).
- Особенности индивидуального ответа на фармакологические средства.
- Депрессия, тревожность.
- Неблагоприятный психологический настрой пациента (катастрофизация, потребительское поведение, негативный опыт предшествующей терапии).
- Метаболические нарушения (избыточная масса тела, сахарный диабет 2-го типа).
- Коморбидные заболевания, затрудняющие проведение адекватной терапии.
- Ошибки при назначении анальгетических препаратов (использование неправильных доз, короткие курсы, монотерапия, отсутствие адекватной профилактики лекарственных осложнений и т.д.).
Без изменения указанных факторов невозможно оказать реальную помощь пациенту.
В настоящее время перед медицинским сообществом стоит задача обеспечения максимально полного контроля над течением заболевания. Так, основная цель лечения ОА коленного сустава – достижение максимально высокого качества жизни пациентов в долгосрочной перспективе через контроль симптомов, предотвращение развития структурных повреждений, улучшение мобильности и самостоятельности [6].
Для выбора правильной стратегии ведения больных прежде всего важно знать патогенез ОА. С каждым годом накапливается все больше данных о роли воспаления в деградации хряща и костной ткани, а также в формировании клинической симптоматики, что и отражает термин «остеоартрит».
Согласно современным представлениям, развитие ОА ассоциируется с активацией механизмов врожденного иммунитета, в том числе связанных с повреждением молекулярных структур и рецепторами распознавания образов. Важное значение придается Toll-подобным рецепторам, которые связывают фрагменты деградировавших внеклеточных структур хряща, такие как низкомолекулярные гиалуронаны, тенасцин С, фибронектин, бигликан и аггрекан. Считается, что эти фрагменты могут играть роль триггера воспалительного ответа. К другим локальным триггерам воспаления относят активацию системы комплемента и стимуляцию клеток кристаллами гидроксиапатитов, которые присутствуют у большинства пациентов с ОА [10]. В дальнейшем активируется система провоспалительных цитокинов – интерлейкина 1β (ИЛ-1β), фактора некроза опухоли α (ФНО-α), что свидетельствует в пользу иммунного характера воспаления.
Провоспалительные цитокины повышают синтез клетками протеаз, особенно металлопротеиназ, снижают синтез протеогликанов, активность тканевого ингибитора металлопротеиназ, стимулируют выработку свободных радикалов оксида азота, что усиливает катаболические процессы в хряще. Воспаление распространяется не только на хрящ, но и на другие структуры сустава – синовиальную оболочку, субхондральную кость, связочный аппарат, приводя к развитию синовита, периостита и др. [11, 12]. Хроническое воспаление приводит к активации костной резорбции, обусловленной системой RANK/RANKL, обеспечивающей развитие, активность и выживаемость остеокластов. ИЛ-1β, ФНО-α и RANKL повышают активность транскрипционного фактора NF-κB в предшественниках остеокластов и других клетках, что приводит к костной ремодуляции [13].
Важную роль в патофизиологии ОА играет синовит. Такой симптом, как ночные боли, непосредственно связан с развитием синовита. Синовиальные макрофаги продуцируют катаболические и провоспалительные медиаторы, в результате чего нарушается баланс между восстановлением и деградацией хряща. Клинически выраженный синовит при ОА встречается нечасто. У большинства больных он верифицируется при ультразвуковом исследовании и магнитно-резонансной томографии (МРТ) [14].
Конечно, в патогенезе ОА сохраняются белые пятна. Например, по данным некоторых исследований, роль ИЛ-1β в повреждении хрящевой ткани неоднозначна [15]. Гиперпродукция провоспалительных цитокинов, в частности ИЛ-1β, при ОА носит несколько иной характер, чем при собственно иммуновоспалительных ревматических заболеваниях, таких как ревматоидный артрит и ювенильный хронический артрит. Однако она приводит к развитию низкоинтенсивного (low-grade) хронического воспаления, которое лежит в основе патогенеза ОА. В одной из последних работ, посвященных генетике ОА, показана связь между развитием и тяжестью ОА коленного сустава и некоторыми вариантами гена антагониста рецептора ИЛ-1 [16]. Несомненно, все эти механизмы вовлечены в процессы, происходящие в суставе. Доказано, что экспрессия специального рецептора, активируемого пролифератором пероксисом g, который стимулирует противовоспалительные и антикатаболические процессы на животных моделях остеоартрита, подавляется ИЛ-1β в остеоартритных хондроцитах человека [17].
Большое значение в развитии ОА отводится системным метаболическим нарушениям: ожирению, метаболическому синдрому, сахарному диабету. Они способны нарушать естественное течение локальной воспалительной реакции в суставе, вызванной механическим стрессом или повреждением. Жировая ткань накапливает и синтезирует многие провоспалительные медиаторы, в том числе адипонектин, висфатин, лептин. В связи с этим ОА развивается чаще и быстрее на фоне так называемого метаболического воспаления [18].
Комплексный подход к лечению
Существует целый ряд методов терапевтического воздействия на патологический процесс при ОА – начиная с нормализации массы тела, поведенческой терапии, лечебной физкультуры и завершая применением обогащенной тромбоцитами плазмы и аутологичной трансплантации хондроцитов.
Медикаментозная терапия в этом ряду занимает центральное место, поскольку необходимо подавлять хронический воспалительный процесс, особенно на ранней стадии болезни [18]. При ОА показано применение двух групп препаратов – нестероидных противовоспалительных препаратов (НПВП) и симптоматических медленно действующих препаратов (Symptomatic Slow-Acting Drugs in Osteoarthritis – SYSADOA), которые ранее часто неточно называли хондропротекторами [19]. Достаточно широко применяются анальгетики (парацетамол и др.), локальная внутрисуставная терапия глюкокортикостероидами и препаратами гиалуроновой кислоты.
В большинстве существующих клинических рекомендаций по ведению больных ОА указывается на необходимость комплексного подхода, когда одновременно или последовательно применяются разные медикаментозные и немедикаментозные методы. В этой ситуации в первую очередь необходимо обращать внимание на аспекты безопасности, включая оценку рисков медикаментозных нежелательных реакций, особенно у пожилых пациентов с выраженной коморбидностью.
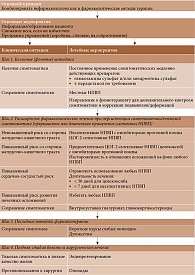
Так, в декабре 2019 г. опубликованы обновленные рекомендации и алгоритм ведения больных ОА Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases – ESCEO) [20, 21]. Согласно документу, лечение больных ОА должно проводиться с использованием как нефармакологических, так и фармакологических методов. В отношении медикаментозной терапии сохранен пошаговый подход (рисунок) [20]. Особое место в алгоритме отводится группе симптоматических медленно действующих препаратов, представленной глюкозамина сульфатом и хондроитина сульфатом, а также и их комбинацией. В отношении этих препаратов используется термин «хроническое применение», то есть неопределенно длительное по времени. Они также рекомендуются в качестве базисной терапии всем пациентам с симптоматическим ОА.
На втором этапе лечения при решении вопроса о назначении того или иного НПВП в зависимости от наличия факторов риска развития нежелательных реакций со стороны тех или иных органов и систем отдельно выделен целекоксиб. Данный препарат можно применять у больных с желудочно-кишечными и сердечно-сосудистыми рисками.
Важным с практической точки зрения аспектом является доступность медикаментозной терапии. Как было сказано ранее, ОА страдают преимущественно пожилые люди, которые относятся к наиболее социально незащищенным слоям общества во многих странах, в том числе в России. В связи с этим существует проблема вынужденной некомплаентности, когда пациенты не выполняют врачебные рекомендации из-за высокой стоимости препаратов. В исследовании, проведенном в Тайване, установлено, что в связи с особенностями страхового возмещения расходов на лекарства пониженные, то есть заведомо мало эффективные дозы глюкозамина сульфата принимало подавляющее большинство (99,3%) больных ОА [22].
Поэтому в области ревматологии, как ни в какой другой области медицины, так остро стоит вопрос о необходимости качественных и доступных генериков. Наличие на фармацевтическом рынке России подобных препаратов – комбинированного препарата глюкозамина сульфата и хондроитина сульфата КОНДРОнова (компания «Панацея Биотек Лтд.», Индия), а также целекоксиба Симкоксиба (компания «Симпекс Фарма Пвт. Лтд.», Индия) представляется важным социальным преимуществом. Весьма популярным генериком нимесулида в России является Нимулид (компания «Панацея Биотек Лтд.», Индия). Он был первым дженериком нимесулида на российском фармацевтическом рынке (с 1995 г.) и завоевал репутацию качественного препарата [23]. Дополнительные возможности в плане базисной терапии предоставляет препарат диацереина Артрокер (компания «ПАНБИО ФАРМ», Россия), также широко применяющийся при ОА.
Рациональное применение нестероидных противовоспалительных препаратов
Несомненно, НПВП являются одним из основных классов препаратов при ОА. Согласно международным и национальным клиническим рекомендациям, системные НПВП являются второй линией терапии при недостаточной эффективности простых анальгетиков (парацетамола) и топических НПВП (гели, мази, пластыри) [5]. Однако в реальной клинической практике в связи с ограниченными возможностями контроля болевого синдрома с помощью парацетамола системные НПВП зачастую назначаются сразу, что и определяет их центральное место в лечении ОА [24].
Считается, что все НПВП имеют сопоставимую эффективность в соответствующих дозах, однако различаются профилем безопасности в отношении желудочно-кишечного тракта, сердечно-сосудистой системы, почек и печени.
Рациональный подход к назначению НПВП предполагает соблюдение баланса прежде всего желудочно-кишечной и сердечно-сосудистой безопасности [25, 26].
Доступные НПВП принято подразделять на две категории: традиционные и коксибы.
Первые считаются в той или иной степени неселективными по отношению к двум основным изоформам циклооксигеназы (ЦОГ): ЦОГ-1 и ЦОГ-2. Применение традиционных НПВП связано с высоким риском развития нежелательных явлений со стороны желудочно-кишечного тракта [26]. Необходимо отметить, что внутри группы традиционных НПВП выделяют условно, или относительно, селективные ингибиторы ЦОГ-2, для которых концентрации, требующиеся для подавления активности этой изоформы, многократно ниже, чем требующиеся для ингибирования ЦОГ-1 [27]. К этой группе относятся мелоксикам, нимесулид, этодолак и др.
Коксибы демонстрируют выраженную селективность в отношении ЦОГ-2, что ассоциируется с меньшим риском НПВП-индуцированного поражения слизистой оболочки желудочно-кишечного тракта. Истинно селективными в отношении ЦОГ-2 являются целекоксиб, эторикоксиб. Отношение концентраций, в которых они тормозят активность ЦОГ-2 и ЦОГ-1, достигает десятков и сотен раз [28].
Следует еще раз подчеркнуть, что как селективные, так и относительно селективные ЦОГ-2 ассоциированы с достоверно меньшим риском развития побочных эффектов со стороны желудочно-кишечного тракта.
Как было отмечено ранее, при назначении НПВП также необходимо учитывать риск развития сердечно-сосудистых осложнений. Теоретически селективное подавление ЦОГ-2 без существенного влияния на ЦОГ-1 может приводить к дисбалансу синтеза тромбоксана А2 и простациклина, что повышает риск тромбоза сосудов. У пациентов с сердечно-сосудистой патологией это чревато повышением риска развития сердечно-сосудистых осложнений [29]. Сначала такое действие связывали только с некоторыми препаратами из класса коксибов (рофекоксибом, вальдекоксибом) [30], однако в дальнейшем было доказано, что все НПВП повышают сердечно-сосудистый риск [31–34], то есть это класс-специфический эффект НПВП и различие между препаратами носит, скорее, индивидуальный характер.
В Российских клинических рекомендациях 2018 г. по рациональному использованию НПВП [35] подробно описана стратегия выбора препарата и мониторинга его безопасности. Основные их положения следующие:
- все НПВП в адекватных противовоспалительных дозах (средних и максимальных терапевтических) при длительном применении сравнимы по эффективности (имеют равный обезболивающий потенциал);
- основные различия между НПВП находятся в области безопасности и переносимости, выбор конкретного препарата осуществляется для каждого пациента в отдельности на основе баланса риска развития нежелательных реакций со стороны желудочно-кишечного тракта и сердечно-сосудистой системы путем оценки факторов риска;
- при высоком риске нежелательных явлений со стороны желудочно-кишечного тракта предпочтение отдается селективным ЦОГ-2-ингибиторам, со стороны сердечно-сосудистой системы – неселективным препаратам;
- в случае сочетания рисков удовлетворительной безопасностью обладает целекоксиб (возможно, в сочетании с ингибиторами протонной помпы).
Целекоксиб
Согласно Российским клиническим рекомендациям 2018 г. [35] и рекомендациям ESCEO [20], целекоксиб занимает особое место среди НПВП благодаря оптимальному профилю безопасности.
Целекоксиб является высокоселективным ингибиторов ЦОГ-2. Препарат прошел обширные клинические испытания, в которых доказал эффективность и безопасность при разных ревматических заболеваниях. Несмотря на большую длительность применения, интерес к целекоксибу сохраняется, что обусловлено специфическими свойствами препарата, в частности высокой безопасностью в отношении желудочно-кишечного тракта и хорошим профилем сердечно-сосудистой безопасности [35].
Результаты новых, достаточно крупных исследований применения целекоксиба при ОА также заслуживают особого внимания. В двойном слепом рандомизированном клиническом исследовании у 388 пациентов с ОА коленного сустава лечение целекоксибом в дозе 200 мг/сут сравнивали с приемом ибупрофена в дозе 800 мг три раза в день и плацебо [36]. Продолжительность наблюдения составила шесть недель. Оба препарата оказались существенно лучше плацебо в отношении таких показателей, как боль, комплексный индекс выраженности ОА Университетов Западного Онтарио и МакМастера (Western Ontario and McMaster Universities Osteoarthritis Index – WOMAC) [37] и удовлетворенность пациентов лечением. Существенных различий между активными препаратами по влиянию на симптоматику не зафиксировано. Однако на фоне лечения целекоксибом нежелательные реакции со стороны верхних отделов желудочно-кишечного тракта наблюдались значительно реже, чем при приеме ибупрофена или плацебо, – 1,3, 5,1 и 2,5% случаев соответственно. В другом плацебоконтролируемом рандомизированном клиническом исследовании сравнивали эффективность и безопасность целекоксиба в дозе 200 мг/сут и напроксена в дозе 1000 мг/сут у 367 больных ОА коленного сустава [38]. Длительность наблюдения также составила шесть недель. Оба препарата в равной степени превосходили плацебо в отношении контроля боли, удовлетворенности пациентов лечением и динамики значений WOMAC. Нежелательные явления на фоне терапии существенно реже наблюдались в группе целекоксиба, чем в группе напроксена, – 13 и 24%. В группе плацебо таковых было 8%. На долю нежелательных реакций со стороны желудочно-кишечного тракта приходилось 3, 6 и 3% случаев соответственно.
Согласно данным Кокрановского обзора, целекоксиб превосходил плацебо и некоторые традиционные НПВП в отношении уменьшения боли и улучшения физической функции [39].
Фармакоэкономический анализ у 62 434 больных ОА, получавших целекоксиб, показал, что назначение его сразу после установления диагноза сопровождалось существенной экономией средств на лечение и потребление ресурсов системы здравоохранения, чем отсроченное назначение на шесть месяцев и более [40]. Это еще раз подтверждает важность активной противовоспалительной терапии у больных ОА.
Нимесулид
Один из популярных в России среди врачей и пациентов НПВП считается нимесулид. Он был введен в клиническую практику в начале 1980-х гг. и зарекомендовал себя как эффективный, хорошо переносимый и доступный препарат [5]. Молекула нимесулида в отличие от молекулы многих других НПВП обладает щелочными свойствами. Это позволяет нимесулиду легко проникать в очаги воспаления и накапливаться в них в более высокой концентрации, чем в плазме крови [5]. По селективности в отношении ЦОГ-2 нимесулид находится между мелоксикамом и целекоксибом [41], поэтому суммарно характеризуется достаточно высокой безопасностью.
Среди преимуществ нимесулида следует выделить [5]:
- высокую биодоступность;
- быстрое (через один – три часа) достижение пиковой концентрации в крови после перорального приема;
- дополнительные механизмы действия – способность подавлять активность металлопротеиназ, предотвращая разрушение гликопротеинового комплекса хрящевой ткани при ОА, фосфодиэстеразы 4, снижая активность макрофагов и нейтрофилов, а также определенный антигистаминный эффект;
- достаточно высокую безопасность в отношении желудочно-кишечного тракта и сердечно-сосудистой системы.
В крупных рандомизированных клинических исследованиях нимесулид в дозе 200 мг/сут был сопоставим или превосходил по эффективности препараты сравнения (этодолак 600 мг, диклофенак 150 мг, напроксен 750 мг) и, как правило, характеризовался лучшей переносимостью [42–44]. Согласно результатам крупных наблюдательных исследований, при лечении нимесулидом риск развития кровотечений в желудочно-кишечном тракте был более низким, чем при использовании других НПВП [5, 45, 46]. Кроме того, при оценке спонтанных сообщений нимесулид в отличие от неселективных ингибиторов ЦОГ ассоциировался с сокращением в два раза частоты нежелательных реакций [47].
В отношении проблемы гепатотоксичности, которая одно время так активно обсуждалась, установлено, что данная нежелательная реакция свойственна всем НПВП [5, 48].
Оценка относительного риска развития острой печеночной недостаточности, которая очень редко развивается по типу идиосинкразии, показала, что нимесулид менее опасен, чем парацетамол и ибупрофен, и фактически сопоставим по степени гепатотоксичности с диклофенаком и кетопрофеном [49].
Широкий спектр анальгетического и противовоспалительного действия нимесулида, отсутствие отрицательного влияния на хрящ и хорошая переносимость обусловливают использование его в комплексной терапии ОА [50].
Комбинированные препараты глюкозамина сульфата и хондроитина сульфата
В соответствии с рекомендациями ESCEO 2019 г., симптоматические медленно действующие препараты являются первой линией терапии ОА [20]. Вероятно, это еще более важно на относительно ранней стадии болезни, поскольку основное действие этого класса препаратов связано с постепенным подавлением катаболического воспаления, лежащего в основе прогрессирования ОА.
Симптоматические медленно действующие препараты обладают собственным, хотя достаточно умеренным, анальгетическим потенциалом и практически не вызывают серьезных нежелательных явлений [18]. К сожалению, их роль часто недооценивается. Так, в одном из последних обзоров по нехирургическому лечению ОА, подготовленном американскими ортопедами, из методов системной медикаментозной терапии упоминаются только НПВП [51].
Среди симптоматических медленно действующих препаратов наибольшая доказательная база по эффективности собрана в отношении рецептурных форм глюкозамина сульфата и хондроитина сульфата, а также их комбинаций [19].
Хондроитина сульфат – глюкозаминогликан, который является главным компонентом внеклеточного матрикса не только хряща, кости, связок, сухожилий, входящих в сустав, но и других тканей – сосудистой стенки, кожи. Для терапии используют два типа хондроитина сульфата: хондроитин-4-сульфат и хондроитин-6-сульфат.
Глюкозамин – аминомоносахарид, существующий в виде трех солей: глюкозамина гидрохлорида, глюкозамина сульфата и N-ацетилглюкозамина. Он присутствует в структуре молекул глюкозаминогликанов, гепарана и кератина сульфата, гиалуронана, а также клеточных мембран. Глюкозамина сульфат используется хондроцитами для синтеза протеогликанов, глюкозаминогликанов и гиалуроновой кислоты.
Глюкозамина сульфат и хондроитина сульфат оказывают анаболическое воздействие на структуру хряща, стимулируя синтез протеогликанов. Их антикатаболическое влияние заключается в ингибировании активности катаболических ферментов (стромелизина, эластазы, аггреканазы, коллагеназы и др.).
Противовоспалительный эффект хондроитина сульфата обусловлен подавлением стимулированного ИЛ-1 синтеза простагландинов, а глюкозамина сульфата – снижением уровня ИЛ-1 в синовиальной жидкости, подавлением синтеза оксида азота, а также образования супероксидных радикалов.
В многочисленных клинических исследованиях доказано, что глюкозамина сульфат и хондроитина сульфат обладают структурно-модифицирующим эффектом: стабилизируют ширину суставной щели, замедляют формирование эрозий, снижают риск эндопротезирования суставов.
В настоящее время разработаны комбинированные препараты глюкозамина сульфата и хондроитина сульфата, что способствует потенцированию действия каждого их компонента [11].
Эффективность комбинации «глюкозамина сульфат + хондроитина сульфат» при ОА доказана значительным количеством клинических исследований. Одним из наиболее часто цитируемых является многоцентровое двойное слепое рандомизированное клиническое исследование MOVES [52]. В нем эффект комбинации «глюкозамина сульфат + хондроитина сульфат» сравнивали с эффектом целекоксиба в дозе 200 мг/сут. В исследовании приняли участие 606 больных ОА коленного сустава. Продолжительность исследования составила шесть месяцев. Оба метода лечения продемонстрировали равную эффективность. Ответа на лечение по критериям OMERACT-OARSI достигли 79,7% в группе комбинированной терапии и 79,2% в группе целекоксиба [53].
Недавно были опубликованы результаты метаанализа, посвященного возможности достижения длительного контроля над болевым синдромом при ОА коленного сустава. В него были включены 47 рандомизированных клинических исследований с общим количеством пациентов 22 037. Возрастной диапазон участников – от 55 до 70 лет. Анализировались данные об анальгетиках, антиоксидантах, антиостеопоротических препаратах (бисфосфонатах и стронция ранелате), НПВП, препаратах для внутрисуставного введения (гиалуроновой кислоте и глюкокортикостероидах), симптоматических медленно действующих препаратах (глюкозамина сульфате и хондроитина сульфате) и др. Продолжительность наблюдения варьировалась от одного года до четырех лет. Уменьшение боли было верифицировано для целекоксиба и глюкозамина сульфата. Замедление сужения суставной щели доказано для глюкозамина сульфата и хондроитина сульфата, а также для стронция ранелата [54].
Комбинации «глюкозамина сульфат + хондроитина сульфат» хорошо сочетаются с НПВП, при этом может наблюдаться потенцирующее действие. Это было показано в достаточно большом российском наблюдательном исследовании в условиях клинической практики. В нем приняло участие 216 больных. Комбинация «глюкозамина сульфат + хондроитина сульфат» (КОНДРОнова®) в сочетании с нимесулидом в дозе 200–300 мг/сут была более эффективной, чем в отсутствие нимесулида [55].
Несомненным преимуществом комбинации «глюкозамина сульфат + хондроитина сульфат» является высокая безопасность и хорошая переносимость. В недавно опубликованном крупном метаанализе исследований показано, что среди всех SYSADOA именно глюкозамина сульфат, хондроитина сульфат, а также производное авокадо и сои не имеют повышенных рисков развития нежелательных реакций любого типа по сравнению с плацебо [56].
Диацереин
Диацереин является представителем группы симптоматических медленно действующих препаратов. Однако химически он связан с НПВП.
Механизм действия диацереина отличается от механизма действия НПВП. Он разнообразно регулирует экспрессию основных регуляторных белков, а также положительно воздействует на компоненты экстрацеллюлярного матрикса хрящевой ткани [57]. Диацереин обладает свойствами антагониста ИЛ-1β и способен замедлять разрушение суставного хряща и резорбцию субхондральной кости [5, 58, 59].
Основное патогенетическое действие диацереина и его активного метаболита реина при ОА заключается в ингибировании синтеза ИЛ-1β, подавлении экспрессии его рецепторов на поверхности хондроцитов, что способствует снижению чувствительности клеток к этому цитокину.
Внутриклеточно метаболит блокирует активацию и транслокацию NF-κB в ядро, снижая таким образом экспрессию NF-κB-зависимых генов, в том числе ответственных за продукцию провоспалительных цитокинов, оксида азота и металлопротеиназ, способствующих усиленному разрушению компонетов матрикса хряща.
Анаболическое действие препарата на хрящ проявляется повышением экспрессии тканевых факторов роста, влияющих на активность хондроцитов и их способность продуцировать протеогликан и коллаген, что способствует восстановлению структуры хряща [11].
В отношении противовоспалительного и иммуномодулирующего эффектов медленно действующих препаратов при ОА еще много вопросов.
Бесспорно, механизмы действия диацереина на продукцию провоспалительных цитокинов существенно отличаются от таковых собственно антицитокиновых генно-инженерных биологических препаратов. Так, в исследовании HUMOR не было показано ни клинического, ни структурно-модифицирующего эффекта адалимумаба при ОА кистей [60]. Другое моноклональное антитело лутикизумаб также продемонстрировало сомнительную эффективность в рандомизированном клиническом исследовании фазы IIа [61]. Поэтому до настоящего времени диацереин остается уникальным по механизму действия препаратом, зарегистрированным в нашей стране для лечения ОА.
Эффективность диацереина как медленно действующего симптоматического и структурно-модифицирующего средства доказана в серии хорошо организованных рандомизированных клинических исследований и признается авторитетными экспертными сообществами [62, 63]. В отечественной литературе также можно найти значительное количество наблюдательных исследований, посвященных оценке эффективности диацереина у больных первичным и вторичным ОА различной локализации [14, 64–66]. В них отмечен более благоприятный профиль безопасности препарата по сравнению с профилем безопасности традиционных НПВП.
Особый интерес могут представлять результаты российского открытого сравнительного шестимесячного исследования у больных ОА коленного сустава [65]. В него были включены 40 пациентов (30 женщин и 10 мужчин) в возрасте от 39 до 79 лет. При этом преобладали (64%) больные со второй рентгенологической стадией по Келлгрену – Лоуренсу. Одна половина больных принимала диацереин (Артрокер®) в дозе 50 мг/сут, другая – НПВП по требованию. Помимо оценки клинических параметров и качества жизни в данном исследовании применялся МРТ-контроль. В первой группе по результатам МРТ наблюдалось достоверное уменьшение выраженности синовита в отсутствие существенного изменения толщины хряща, во второй – сохранение синовита и уменьшение толщины хряща. Хотя количество пациентов в группах было невелико, результаты исследования позволили утверждать о структурно-модифицирующем потенциале препарата.
Диацереин обладает комплексным эффектом и при ОА тазобедренных суставов. В частности, было проведено наблюдательное исследование с участием 30 пациентов с ОА тазобедренных суставов второй и третьей стадий по Келлгрену – Лоуренсу [14]. Средний возраст больных составил 63,6 ± 5,8 года. Пациенты получали диацереин по 50 мг два раза в день. На фоне терапии значимо уменьшилась выраженность боли, а также значение WOMAC. Об отличной переносимости препарата сообщили 27,5% больных, хорошей – 65,5%, удовлетворительной – 7,0%.
Опубликован также клинический случай, продемонстрировавший возможность многолетнего эффективного применения диацереина у пожилых лиц с гонартрозом [67].
Несмотря на то что химически диацереин относится к НПВП, он существенно отличается от них профилем безопасности и может назначаться (конечно, при оценке соотношения пользы и риска) в тех случаях, когда НПВП противопоказаны. Следовательно, он может рассматриваться в качестве дополнительной опции у ряда пациентов. В ходе исследований продемонстрированы высокая безопасность диацереина в отношении желудочно-кишечного тракта и практическое отсутствие существенных сердечно-сосудистых рисков. Именно поэтому диацереин может быть препаратом выбора у больных с воспалительным фенотипом ОА при наличии значимой коморбидности [68].
При проведении генетических исследований установлено, что диацереин может обладать антиатеросклеротическим эффектом в связи с общностью патогенетических механизмов хронического низкоуровневого воспаления при ОА и атеросклерозе [58].
Вывод
Применение хорошо зарекомендовавших в лечении ОА медикаментозных средств из групп НПВП и симптоматических медленно действующих препаратов позволяет оказывать комплексное воздействие на состояние больных, а достаточно широкий спектр препаратов – индивидуализировать терапию для достижения максимальной эффективности и безопасности.
D.E. Karateev, MD, PhD, Prof.
Moscow Regional Research and Clinical Institute
Contact person: Dmitry E. Karateev, dekar@inbox.ru
Osteoarthritis (osteoarthrosis, OA) is a common rheumatic disease characterized by chronic pain, lowering of the quality of life and a deterioration in the course of comorbid pathology, therefore optimization of the treatment of OA is an important medical and social task. More and more data are accumulating on the importance of inflammatory mechanisms in the development of degradation of cartilage and bone tissue, as well as in the formation of clinical symptoms of OA. Drug therapy plays an important role in the treatment of symptomatic OA, due to the need to suppress the chronic inflammatory process. The most actively used are two groups of medications – non-steroidal anti-inflammatory drugs (NSAIDs) and Symptomatic Slow-Acting Drugs for Osteoarthritis (SYSADOA), which were previously often inaccurately called chondroprotectors. Modern clinical guidelines distinguish celecoxib among NSAIDs, glucosamine sulfate and chondroitin sulfate (and their combinations) among SYSADOA, as drugs with an optimal ratio of efficacy and safety. Russian and foreign experience also makes it possible to justify the use of nimesulide and diacerein as drugs with unique mechanisms of action that allow individualizing OA therapy. All of these drugs are represented by high-quality and affordable generics in Russia, which can significantly reduce treatment costs.