Современные подходы к диагностике и лечению синдрома портальной гипертензии
- Аннотация
- Статья
- Ссылки




Синдром портальной гипертензии (ПГ) развивается при нарушении кровотока на различных уровнях системы воротной вены и является одним из наиболее частых осложнений цирроза печени (ЦП), что приводит к более тяжелому течению вследствие развития кровотечений, асцита и спонтанного бактериального перитонита (СБП), шунтовой печеночной энцефалопатии (ШПЭ) и гепаторенального синдрома (ГРС). Несмотря на прогресс в подходах к диагностике и лечению, по данным шестинедельного наблюдения за пациентами после кровотечения из варикозно расширенных вен пищевода (ВРВП), смертность от рецидивирующего кровотечения составляет около 10–20%.
История создания объединенных рекомендаций, основанных на доказательной медицине, ведет свое начало с 1986 г. Первый съезд специалистов состоялся в г. Гронингене (Нидерланды), последующие встречи – в Италии и США. Американской ассоциацией по изучению болезней печени (American Association for the Study of Liver Diseases – AASLD) совместно с Американской коллегией гастроэнтерологов (The American College of Gastroenterology – ACG) разработаны практические подходы к ведению больных с ВРВП.
В дальнейшем совместно с Европейской ассоциацией по изучению болезней печени (European Association for the Study of the Liver – EASL) были опубликованы рекомендации по нерешенным проблемам ПГ. Последняя, пятая встреча экспертов (Baveno V) состоялась в г. Бавено (Италия) 21–22 мая 2010 г. (консенсусы носят название города Бавено с 1990 г.). В настоящее время рекомендации суммируют современные представления о патофизиологии и лечении ПГ и ее осложнений, основанные на данных контролируемых рандомизированных исследований и метаанализов [1]. В данной статье будут рассмотрены подходы к диагностике и лечению ПГ и ее осложнений – кровотечений из варикозно расширенных вен (ВРВ).
Классификация и механизмы развития портальной гипертензии
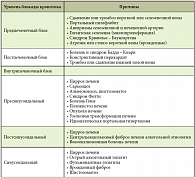
В соответствии с уровнем нарушения кровотока в системе воротной вены выделяют предпеченочную, постпеченочную и внутрипеченочную формы ПГ, а также блокаду кровотока внутри печени до уровня синусоидов (пресинусоидальную ПГ) и после синусоидов (постсинусоидальную ПГ). Причины развития ПГ представлены в таблице 1. Основным механизмом развития ПГ при ЦП является рост давления в портальной системе вследствие архитектурной перестройки печени, развития фиброза и узлов регенерации (механический фактор). Печеночно-клеточная недостаточность изменяет системную гемодинамику: выделение эндогенных вазодилататоров (глюкагона, вазоактивного интестинального пептида (ВИП), оксида азота (NO)) приводит к расширению сосудов органов брюшной полости, повышению сердечного выброса и кровотока в периферических тканях.
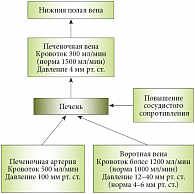
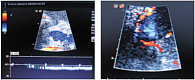
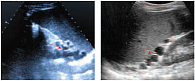
В терминальной стадии ЦП развивается артериальная гипотония. Определенную роль также играют эндотелиальная дисфункция и сброс крови по порто-системным коллатералям, обладающим высоким сосудистым сопротивлением. В дополнение к механическому фактору активная вазоконстрикция внутрипеченочных артерий приводит к росту на 20–30% внутрипеченочного сосудистого сопротивления. ПГ продолжает прогрессировать из-за растущего поступления крови, из-за недостаточного снижения давления в воротной вене в силу более высокого сопротивления коллатеральных сосудов. Параметры кровотока в сосудах печени при ПГ представлены на рисунке 1.
Последствия ПГ хорошо известны: асцит, спленомегалия и развитие коллатералей. Деление ПГ на стадии соответствует тяжести основного заболевания. Для более раннего выявления признаков ПГ у пациента с хроническим заболеванием печени (ХЗП) целесообразно обратить внимание на ее ранние симптомы (табл. 2). Коллатерали между системой воротной вены и системой нижней полой вены при ПГ можно разделить на 4 группы (табл. 3).
ВРВП выявляют примерно у половины больных ЦП. Частота появления ВРВП коррелирует с тяжестью ЦП (выявляется у 40% пациентов при ЦП класса A и у 85% – при ЦП класса С) [2]. Частота развития ВРВП составляет примерно 8% в год, при этом наиболее значимым прогностическим фактором является печеночно-венозный градиент давления (ПВГД), превышающий 10 мм рт. ст. при скрининге [3]. Примерно с такой же частотой происходит переход так называемых мелких вен в крупные. Главными факторами риска увеличения размера варикозного узла являются ЦП класса B или C, алкогольный генез цирроза, наличие так называемых «красных рубцов» (напоминающие следы от ударов плетью продольно расположенные расширенные венулы) [4]. Классификации варикозных вен учитывают их размер, а также расположение (для вен желудка). В российской медицинской практике наиболее принято выделение 4 стадий ВРВ. Классификация по А.К. Ерамишанцеву (1998) включает 4 стадии варикоза (по размеру варикозных узлов):
- 1-я стадия – 2–3 мм;
- 2-я стадия – 3–5 мм;
- 3-я стадия – более 5 мм;
- 4-я стадия – более 10 мм.
Классификация К.-J. Paquet (1983) выделяет 4 стадии варикоза:
- 1-я стадия – единичные вены, рентгенонегативные;
- 2-я стадия – единичные вены, не суживающие просвет;
- 3-я стадия – сужение пищевода венами, вены в нижней и средней трети пищевода, симптом «красного пятна»;
- 4-я стадия – полное заполнение просвета пищевода венами, множественные эрозии.
Классификация N. Soehendra, К. Binmoeller (1997) включает 3 степени варикоза (по диаметру ВРВ):
- 1-я степень – до 5 мм (располагаются в нижней трети пищевода);
- 2-я степень – 5–10 мм (располагаются в средней трети пищевода);
- 3-я степень – более 10 мм (расположены вплотную друг к другу).
Классификация Американской ассоциации по изучению болезней печени (AASLD) выделяет 3 стадии варикозно расширенных вен пищевода:
- 1-я стадия – маленькие вены, минимально возвышающиеся над слизистой пищевода;
- 2-я стадия – средние вены, извитые, занимающие менее трети просвета пищевода;
- 3-я стадия – крупные вены.
В международных классификациях предлагается использовать максимально упрощенное деление варикоза на 2 стадии – мелкие вены (до 5 мм) и крупные вены (более 5 мм), поскольку риски, связанные с кровотечением, одинаковы для средних и крупных вен [5]. Частота развития кровотечения составляет 5–15% в год, спонтанно оно прекращается у 40% больных, повторно, в отсутствие лечения, развивается примерно у 60% пациентов, в среднем в течение от 1 до 2 лет после первого эпизода [6]. Вероятность развития кровотечения определяют следующие факторы:
- размер варикозных узлов (напряжение стенки узла пропорционально диаметру);
- более поверхностное расположение вен в пищеводно-желудочном соединении;
- возрастание риска на поздних стадиях ЦП (класс B и C);
- окрашивание стенок варикозных узлов в красный цвет, пятна фибрина на узлах (феномен «красного пятна», или «пятна красной вишни», – участки красного цвета на «вершинах» варикозных узлов, выявляются примерно у половины больных; гематоцистные пятна – пузырьки красного цвета, соответствующие наиболее истонченным участкам варикозного узла; телеангиэктазии) [7].
ВРВ желудка (ВРВЖ) при ПГ встречается в меньшем проценте случаев, чем ВРВП (5–33%), при этом кровотечения развиваются примерно у четверти пациентов за двухлетний период. Классифицируются ВРВЖ в зависимости от локализации.
Гастроэзофагеальные вены (gastroesophageal veins, GOV) – ВРВ, переходящие из пищевода в желудок, – делятся на 2 типа:
- 1-й тип (GOV1) – проходят вдоль малой кривизны желудка (принципы лечения соответствуют принципам лечения ВРВП);
- 2-й тип (GOV2) – расположены в дне желудка, более протяженные и извитые.
Изолированные вены желудка (isolated gastric veins, IGV) развиваются в отсутствие расширения вен пищевода, делятся на 2 типа:
- 1-й тип (IGV1) – расположены в дне желудка, извитые (встречаются при тромбозе селезеночной вены);
- 2-й тип (IGV2) – проходят в теле желудка, антруме или вокруг привратника [8]. Наибольшую опасность представляют вены, расположенные в дне желудка (фундальные вены). Другими факторами риска являются размер узлов, класс ЦП, наличие симптома «красного пятна» [9].
Деление на степени ВРВЖ основано на том же параметре, что и деление ВРВП, – на размере узлов:
- 1-я степень – диаметр ВРВ не более 5 мм, вены едва различимы над слизистой желудка;
- 2-я степень – диаметр ВРВ 5–10 мм, вены имеют солитарно-полипоидный характер;
- 3-я степень – диаметр ВРВ более 10 мм, вены тонкостенные, полипоидного характера, представляют собой обширный конгломерат узлов.
Еще одним источником кровотечения является портальная гипертензионная гастропатия (до 50–78% больных с ПГ). Классификация Северного итальянского эндоскопического клуба (North Italian Endoscopic Club – NIEC, 1997 г.) выделяет 4 стадии:
- 1-я стадия – мозаичный рисунок слизистой розового цвета;
- 2-я стадия – наличие красных пятен (подслизистые сосудистые образования красного цвета);
- 3-я стадия – наличие вишневых пятен (подслизистые сосудистые образования с наличием кровоизлияний);
- 4-я стадия – наличие черных пятен.
При 2–4-й стадиях гастропатии кровотечение развивается практически у всех больных, поэтому лечение данного состояния является чрезвычайно важным в ведении пациентов с ПГ [1].
Диагностика портальной гипертензии
Для подтверждения диагноза ПГ необходимо выявить ее клинические симптомы и измерить давление в системе воротной вены. В настоящее время, к сожалению, не существует неинвазивного метода, более точного, чем принятое в качестве «золотого стандарта» измерение ПВГД, отражающего давление в системе воротной вены. ПВГД достоверно растет при увеличении степени ВРВП, определяет напряжение в стенке узла, то есть отражает (при определенных его значениях) риск развития кровотечения, поэтому снижение ПВГД должно этот риск уменьшить (объективная оценка эффективности лечения). При клинически значимой портальной гипертензии ПВГД достигает как минимум 10 мм рт. ст. Если ПВГД превышает 20 мм рт. ст. в течение суток после кровотечения, то риск раннего развития повторного кровотечения или трудно контролируемого кровотечения существенно возрастает (83% против 29% у больных с более низкими показателями ПВГД). Высоким становится и показатель смертности в течение первого года (64% против 20%) [10]. При одинаковом уровне давления степень риска зависит от размера узла: чем больше узел, тем выше риск [11].
Прямой связи между классом ЦП и ПВГД не установлено (отсутствует доказательная база, соответствующие исследования не проводились). С уменьшением ПВГД до 12 мм рт. ст. на фоне медикаментозного лечения ПГ (у пациентов, ответивших на терапию) снижается вероятность не только повторного кровотечения, но и развития асцита, СБП и смерти [12]. ПВГД измеряется как разница давления заклинивания в печеночных венах (ДЗПВ) и свободного давления в печеночных венах (СДПВ). Катетер проводят через правую бедренную вену и продвигают до заклинивания, как правило, в правую печеночную вену. Окклюзивная позиция определяется по отсутствию рефлюкса после инъекции 2 мл контраста и появлению синусоидограммы. Среднее из трех измерений используется в дальнейшем анализе. В случае если разница превышает 1 мм рт. ст., все измерения проводятся повторно. Не следует преуменьшать значение сбора анамнеза и осмотра пациента, позволяющих установить признаки ХЗП и последствия развития ПГ. В настоящее время используются следующие инструментальные методы для подтверждения наличия ПГ и установления степени ее тяжести и уровня обструкции:
- ультразвуковое исследование (УЗИ) органов брюшной полости с ультразвуковой допплерографией сосудов (УЗДГ) (табл. 4);
- эзофагогастродуоденоскопия (ЭГДС), рентгенография пищевода с барием;
- эндоскопическое УЗИ;
- фиброэластометрия, УЗИ/магнитно-резонансная томография (МРТ)/Фибротест);
- пункционная биопсия печени;
- печеночная венография и каваграфия;
- целиакография;
- компьютерная томография (КТ), МРТ, позитронно-эмиссионная томография (ПЭТ) органов брюшной полости.
В настоящее время в консенсусах обсуждаются вопросы неинвазивной диагностики ПГ и ВРВ (капсульная эндоскопия, КТ, МРТ, ПЭТ, фиброэластометрия и др.). В многоцентровом исследовании проведено сравнение капсульной эндоскопии с ЭГДС у 288 пациентов. Исследование не показало диагностической эквивалентности (разницы менее 10%) в определении числа ВРВП, чувствительность капсульной эндоскопии при идентификации средних и крупных ВРВП в сравнении с ЭГДС была ниже [14]. В аналогичном сравнительном исследовании КТ показала чувствительность при выявлении ВРВП, равную 90%, и специфичность 50%, а для вен желудка чувствительность составила 87%. Необходимы сравнительные исследования КТ, ЭГДС и капсульной эндоскопии [15].
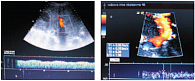
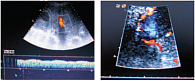
Сходной с КТ чувствительностью обладает эндоскопическое УЗИ. Эластометрия хорошо зарекомендовала себя в диагностике печеночного фиброза, но точность метода для диагностики ПГ является субоптимальной (чувствительность – 76%, специфичность – 78%). По результатам одного из многоцентровых исследований, не оправдал надежд и другой неинвазивный маркер – тромбоцитопения. Таким образом, используемые неинвазивные методы (количество тромбоцитов, размеры селезенки, диаметр воротной вены, эластометрия) при всей своей привлекательности не предоставляют удовлетворительной информации о наличии и степени ПГ [16]. На рисунках 2–5 представлен нормальный и измененный кровоток при ПГ.
Профилактика и лечение кровотечений из варикозно расширенных вен
Cхема терапии синдрома ПГ включает лечение основного заболевания, профилактику развития ПГ (так называемая препервичная профилактика), снижение давления в воротной вене, первичную и вторичную профилактику кровотечений из порто-системных анастомозов, лечение острого кровотечения. Воздействие различных методов лечения на параметры портального кровотока представлено в таблице 5. Вазоконстрикторы наиболее выраженно снижают портальный венозный кровоток, а также давление в воротной вене, но при этом повышают общее сосудистое сопротивление. Шунтирование, в частности наиболее оптимальные его варианты, имеет ряд противопоказаний и приводит к усугублению энцефалопатии. Эндоскопические методы лечения устраняют только последствия ПГ, не влияют на ее развитие и прогрессирование. Наиболее благоприятным, но слабым эффектом обладают вазодилататоры, но достаточно большое количество пациентов не переносят целевые дозы (табл. 5) [8].
Рекомендации по лечению и профилактике ПГ, принятые в США и странах Европы, практически идентичны. Консенсусы также включают рекомендации по диагностике и лечению внепеченочной обструкции воротной вены и синдрома Бадда – Киари. В вопросах профилактики развития ВРВ в основном обсуждаются два момента – использование бета-адреноблокаторов (БАБ) и наблюдение за пациентами. С учетом плохой переносимости БАБ не рекомендованы для рутинной профилактики. Пациенты с ЦП должны проходить эндоскопический контроль, при этом в ряде рекомендаций сроки контроля зависят от компенсации (1 раз в 3 года) или декомпенсации (1 раз в год) ЦП [8].
Первичная профилактика проводится с использованием в основном лекарственных препаратов. Метаанализ исследований с применением неселективных БАБ у пациентов с ВРВ малого размера показал очень низкую частоту возникновения кровотечений (7% за 2 года) и неэффективность использования БАБ для их профилактики [17]. В другом исследовании риск кровотечения был ниже у пациентов, которым начали профилактическое использование БАБ при малом размере ВРВ (12% за 5 лет), при большом размере ВРВ риск был выше – 22% за 5 лет, и БАБ замедлили трансформацию мелких вен в крупные (11% против 37% за 3 года в группе плацебо) [18].
Метаанализ 11 исследований, включавших 1189 пациентов, продемонстрировал значимое уменьшение риска кровотечения (30% в сравнении с 14% в группе плацебо) при использовании БАБ (пропранолола и надолола), что позволило избежать кровотечения у 1 из 10 больных [17]. Поэтому признано, что профилактическое использование БАБ необходимо при любом размере варикозных узлов (при малом – для больных с высоким риском кровотечений) или для предотвращения прогрессирования варикоза [19].
Селективные БАБ менее эффективны, чем неселективные, альтернативным препаратом может быть карведилол. Эффект препарата оптимально оценивать по снижению ПВГД. Дозы титруют до снижения ЧСС на 25% от исходной, затем назначают постоянное лечение. Поскольку давление в воротной вене не коррелирует с ЧСС, дозы необходимо приближать к максимально переносимым (15% пациентов либо не переносят БАБ, либо имеют противопоказания к ним). Начальная доза пропранолола составляет 20 мг 2 раза в день, надолола – 40 мг 1 раз в день, карведилола – 6,25 мг. При наличии асцита параллельно назначают фторхинолоны для профилактики СБП – норфлоксацин, ципрофлоксацин.
Второй обсуждаемый метод первичной профилактики – эндоскопическое лигирование. По сравнению с БАБ в части исследований лигирование показало большую эффективность при сравнимой смертности. Побочные эффекты встречались реже, но были более тяжелыми (лигатурные язвы, перфорация пищевода). Для проведения лигирования требуется, по меньшей мере, три эндоскопических сеанса. Оно должно проводиться каждые 2 недели до полной облитерации вен с последующим тщательным эндоскопическим контролем (через 1–3, а затем каждые 6–12 месяцев). Таким образом, выбор метода зависит от переносимости, побочных эффектов и предпочтений пациента [8]. Для первичной профилактики не рекомендованы:
- комбинация «БАБ + нитраты»;
- лигирование + БАБ;
- изосорбида мононитрат в монотерапии;
- шунтирование.
В отношении склеротерапии исследования дали противоречивые результаты: в ранних работах она была эффективной, в поздних – привела даже к большему риску смерти, чем плацебо [20]. Лечение острого кровотечения из ВРВП включает общие мероприятия по восстановлению внутрисосудистого объема, трансфузии эритроцитарной массы для поддержания уровня гемоглобина не ниже 8 г/дл, антибактериальную профилактику СБП фторхинолонами (норфлоксацин перорально, ципрофлоксацин или цефтриаксон внутривенно).
Также пациентам с тяжелой коагулопатией требуются трансфузии свежезамороженной плазмы, а при наличии тромбоцитопении – тромбоцитов. Использование рекомбинантного активированного фактора VII, применяемого у больных с гемофилией и антителами к 8-му и 9-му факторам, не дает дополнительного эффекта [21]. Пациентам в сроки до 12 часов от начала кровотечения должна быть проведена ЭГДС, в том числе для выполнения экстренных эндоскопических манипуляций по остановке кровотечения. Временно до выполнения шунтирования или лигирования/склеротерапии может быть выполнена баллонная тампонада пищевода, продолжительность которой ограничена, согласно рекомендациям, 1 сутками.
Необходимо незамедлительно начать лечение вазопрессорами в комбинации с эндоскопической терапией, длительность терапии – до 5 дней. По данным метаанализа 15 исследований, в которых сравнивали эффективность склеротерапии и фармакологических агентов (вазопрессин + нитроглицерин, терлипрессин, соматостатин, октреотид), оба подхода показали сходную эффективность при небольшом числе побочных эффектов при использовании медикаментов, что позволяет рекомендовать лекарственную терапию как терапию первой линии в лечении кровотечений [22]. Наиболее эффективным сосудосуживающим препаратом является вазопрессин. Среди его побочных эффектов следует отметить возможность развития ишемии миокарда и нарушений периферического кровотока, аритмий, артериальной гипертонии, ишемии кишечника. Используется синтетический аналог вазопрессина с большей активностью и значимо меньшим числом побочных эффектов – терлипрессин. Соматостатин и его аналоги (октреотид) ингибируют белки-вазодилататоры (главным образом глюкагон), оказывают локальное вазоконстрикторное действие. Результаты метаанализов октреотида противоречивы: проведенные исследования показали и развитие привыкания к препарату, и более кратковременное действие в сравнении с терлипрессином. В настоящее время считается целесообразным использовать октреотид в комбинации с эндоскопическим лечением [23].
Вторичная профилактика
Предотвращение повторного кровотечения из ВРВ является значимой медицинской проблемой, поскольку после первого эпизода может последовать рецидив кровотечения и смертельный исход. В отсутствие лечения повторное кровотечение развивается с частотой около 60% за 1–2 года и смертностью около 33% [6]. Профилактика должна начинаться не позднее чем через сутки после прекращения кровотечения. Пациенты, которым было проведено шунтирование, в дальнейшей профилактике не нуждаются. Необходимо также рассматривать пересадку печени у больных с индексом по классификации Чайлда – Турко – Пью ≥ 7 баллов и/или классификации MELD (Model of Endstage Liver Disease – Модель для терминальных стадий заболевания печени) ≥ 15. Наиболее эффективным для вторичной профилактики (как, впрочем, и для первичной) является использование БАБ или склеротерапии (закономерно характеризующейся более высокой частотой побочных эффектов): они предотвращают рецидив в 42–43% случаев [6] .
Логичным представляется использование комбинации БАБ и изосорбида мононитрата. К сожалению, при анализе данных рандомизированных исследований комбинированная фармакологическая терапия показала примерно такую же эффективность, как и монотерапия пропранололом, – частота повторного кровотечения составила 33–35% [6], при более плохой переносимости. Эндоскопическое лигирование необходимо повторять на 7-е и 14-е сутки до полной облитерации вен, то есть требуется от 2 до 4 сеансов, при этом медиана эффективности метода такая же, как и для медикаментозного лечения, – 32% [6]. Контрольная эндоскопия – через 3 и 6 месяцев. Осложнения процедуры достигают 14%, они обычно не тяжелые (дисфагия, дискомфорт в грудной клетке); возможны лигатурные язвы (иногда кровоточат, эффективно использование пантопразола). При сравнении фармакотерапии с лигированием были получены противоречивые результаты: в одном исследовании преимущество осталось за лекарственными препаратами, в другом – за лигированием, в третьем – эффективность была одинаковой [24].
В крупном метаанализе, включавшем 1860 пациентов из 23 исследований, было продемонстрировано преимущество комбинации БАБ и эндоскопических методов лечения по сравнению со склеротерапией и лигированием для предотвращения рецидивов кровотечения при одинаковой смертности [25]. У пациентов с эффективным (по уровню ПВГД) медикаментозным лечением использование эндоскопических методов представляется нерациональным. Для дифференцированного подхода необходима стандартизация измерения ПВГД, в том числе выбор оптимального временного интервала для измерения, который пока остается неясным.
В проводимых исследованиях повторно ПВГД измеряют в среднем через 90 дней после первого измерения (от 19 до 159 дней), при этом существует мнение, что значимость изменений ПВГД уменьшается с увеличением интервала между измерениями. Существующие стандарты не рекомендуют использовать для вторичной профилактики склеротерапию, поскольку ее эффективность такая же, как при лигировании, но с большим числом побочных эффектов [1].
Порто-системное шунтирование при высокой эффективности для профилактики кровотечений повышает риск печеночной энцефалопатии (ПЭ) и, как ни странно, не влияет на выживаемость пациентов. Проведенный метаанализ 11 исследований не показал преимуществ шунтирования в сравнении с эндоскопической терапией. Интересным представляется также тот факт, что комбинированная фармакологическая терапия при более низкой эффективности в отношении рецидива кровотечения приводит к снижению темпов развития ПЭ, аналогичному показателю выживаемости пациентов, а также к более частому клиническому улучшению при более низкой стоимости и неинвазивности. Поэтому шунтирование рекомендовано как терапия спасения у пациентов с отсутствием эффекта от медикаментозного лечения/лигирования, при подготовке к трансплантации печени. Считается, что новые стенты, в покрытии которых используется политетрафторэтилен (PTFE, polytetrafluoroethylene), – PTFE-покрытые стенты – могут повышать частоту энцефалопатии, поэтому требуется тщательный отбор пациентов для проведения данной операции [26].
Отдельную проблему представляет профилактика и лечение кровотечения из варикозных вен желудка, в связи с тем что эти вены труднодоступны для манипуляций из-за особенностей расположения, часто крупные и извитые. Лечение острого кровотечения включает вазоконстрикторы, эндоскопическую остановку кровотечения и антибиотики для профилактики бактериальных осложнений. До сих пор существуют противоречия по вопросу выбора метода профилактики ввиду малого количества клинических исследований. ВРВЖ (GOV1) лечатся по тем же принципам, что и ВРВП. Доказательная база для изолированных вен желудка очень мала, за исключением вен 1-го типа, поскольку методом терапии изолированного тромбоза селезеночной вены как причины ВРВЖ является удаление селезенки. Наиболее эффективным методом профилактики заболевания является введение в варикозные узлы под контролем эндоскопии адгезивных веществ, таких как N-бутил-цианоакрилат, изобутил-2-цианоакрилат, тромбин.
Недавно проведенный в Германии анализ ретроспективной когорты (131 пациент) показал очень высокую эффективность инъекций N-бутил-2-цианоакрилата – отсутствие рецидива через 1, 3 и 5 лет у 94,5, 89,3 и 82,9% больных соответственно. У большинства пациентов нужна всего одна процедура, нет ранних рецидивов/смертельных исходов. Тем не менее данный опыт нельзя без оговорок экстраполировать на все учреждения, поскольку для получения хороших результатов процедуры необходим достаточный опыт ее проведения [27]. Возможно лигирование вен желудка, использование БАБ. В отсутствие возможности введения адгезивных веществ в варикозные узлы или при неэффективности первой такой процедуры показано проведение трансъюгулярного чреспеченочного порто-системного шунтирования (TIPS), эффективность которого при ВРВЖ достигает 90%. При портальной гипертензивной гастропатии эффективно использование БАБ или проведение шунтирования (при наличии противопоказаний к применению БАБ) [8].

