Современные подходы к лечению пациентов с хронической болью. VII Съезд ревматологов России
- Аннотация
- Статья
- Ссылки
Научная программа мероприятия включала лекции ведущих профессоров России и стран СНГ, а также зарубежных коллег. Специалисты проанализировали состояние ревматологической службы РФ, организации медицинской помощи пациентам за четыре года, прошедшие с предыдущего съезда. Проведены также мастер-классы, пленарные заседания и постерные секции, посвященные патогенезу ревматических заболеваний, проблемам коморбидности, хронической боли, современным методам ранней диагностики и принципам противовоспалительной терапии.
Важным событием съезда стало единогласное избрание президентом Общероссийской общественной организации «Ассоциация ревматологов России» академика Российской академии наук Евгения Львовича НАСОНОВА. Особое внимание на съезде было уделено обсуждению различных аспектов боли.
Научная программа мероприятия включала лекции ведущих профессоров России и стран СНГ, а также зарубежных коллег. Специалисты проанализировали состояние ревматологической службы РФ, организации медицинской помощи пациентам за четыре года, прошедшие с предыдущего съезда. Проведены также мастер-классы, пленарные заседания и постерные секции, посвященные патогенезу ревматических заболеваний, проблемам коморбидности, хронической боли, современным методам ранней диагностики и принципам противовоспалительной терапии.
Важным событием съезда стало единогласное избрание президентом Общероссийской общественной организации «Ассоциация ревматологов России» академика Российской академии наук Евгения Львовича НАСОНОВА. Особое внимание на съезде было уделено обсуждению различных аспектов боли.




Хроническая боль у пациента с коморбидными заболеваниями
В настоящее время болевой синдром рассматривается как результат взаимодействия сразу нескольких факторов: тканевого повреждения, эмоциональных, когнитивных и социальных нарушений. Как отметила заведующая отделом метаболических заболеваний костей и суставов Научно-исследовательского института ревматологии (НИИР) им. В.А. Насоновой, д.м.н., профессор Людмила Ивановна АЛЕКСЕЕВА, значительная доля в структуре хронического болевого синдрома приходится на скелетно-мышечные боли.
Боль не только вызывает различные осложнения, но и усугубляет течение коморбидных заболеваний.
Проблема полиморбидности в настоящее время приобретает все большую значимость, поскольку количество пациентов с двумя и более патологиями неуклонно увеличивается. Указанная тенденция отмечается не только среди лиц пожилого возраста, но и среди молодых. Так, полиморбидность зафиксирована у 83% пациентов с болью, впервые обратившихся к врачам первичного звена1. У больных старше 65 лет среднее количество нозологий достигает семи2.
Наличие полиморбидности увеличивает риск смерти. Установлено, что у пациентов с остеоартритом и такими сопутствующими заболеваниями, как сахарный диабет, сердечно-сосудистые патологии и рак, риск смерти выше, чем в общей популяции3.
В формировании хронической боли участвуют дисфункциональный, невропатический и ноцицептивный механизмы. При ревматических заболеваниях ведущая роль принадлежит ноцицептивной боли – она вызывается воспалением и структурным повреждением тканей. Пусковым фактором признано воспаление.
Медиаторы воспаления индуцируют ответ соматосенсорного нейрона, который через задний рог спинного мозга передает соответствующую информацию в головной мозг. Персистирующее воспаление активирует нейрогенные механизмы. Изменяется фенотип нервных волокон.
Механизмы формирования боли находятся в состоянии динамического развития и со временем могут претерпевать существенные изменения.
Докладчик подчеркнула, что понимание механизмов формирования болевого синдрома позволяет проводить адекватную терапию.
Лечение боли желательно начинать на ранней стадии, чтобы она не переросла в хроническую и не развилась психогенная и нейропатическая боль, которую трудно купировать.
Современная стратегия терапии болевых синдромов предусматривает назначение препаратов с учетом этиологии, патогенеза и оценки выраженности боли. При ревматических заболеваниях, в частности остеоартрите, хорошо зарекомендовали себя нестероидные противовоспалительные препараты (НПВП) и опиоидные анальгетики. Возможно также применение антиконвульсантов (прегабалина, габапентина) и антидепрессантов.
На сегодняшний день препаратами выбора для лечения острой и хронической боли признаны НПВП. Выбор конкретного лекарственного средства обусловлен интенсивностью боли, степенью повреждения, длительностью действия повреждающего фактора, наличием сопутствующих заболеваний, коморбидных состояний или синдромов, характером проводимой терапии. Немаловажное значение имеет также психосоциальный и поведенческий статус пациента.
Механизм действия НПВП направлен на ингибирование циклооксигеназы (ЦОГ), которая представлена во многих тканях организма. Данный фермент отвечает за выработку биологически активных веществ: простагландинов, простациклинов, тромбоксанов и др. Некоторые НПВП ингибируют активацию и хемотаксис нейтрофилов, а также стимулируют синтез оксида азота (NO)4, 5.
Однако использование НПВП сопряжено не только с эффективным купированием болевого синдрома и улучшением качества жизни пациентов, но и с побочными реакциями. Вероятность их развития повышается при наличии коморбидных патологий.
Различия в тяжести и видах побочных эффектов препаратов группы НПВП обусловлены воздействием на разные ЦОГ – ЦОГ-1 и ЦОГ-2. В зависимости от избирательности подавления указанных выше изоферментов НПВП делятся на блокирующие оба изофермента (неселективные ингибиторы) и преимущественно ЦОГ-1 или ЦОГ-2 (селективные ингибиторы). Неселективные НПВП в большей мере связаны с такими побочными эффектами, как язвенная болезнь и желудочно-кишечное кровотечение.
Современный НПВП ацеклофенак – дериват фенилуксусной кислоты с коротким периодом полувыведения. Данный препарат обладает выраженным противовоспалительным эффектом, обусловленным подавлением синтеза интерлейкина 1 (ИЛ-1), фактора некроза опухоли альфа (ФНО-альфа), NO. Проведенные сравнительные исследования ацеклофенака и селективных НПВП продемонстрировали, что ацеклофенак умеренно ингибирует ЦОГ-1 и ЦОГ-2, с преимущественным угнетением экспрессии ЦОГ-2, поэтому более безопасен в отношении развития побочных эффектов по сравнению с другими НПВП6.
Данные метаанализа девяти популяционных исследований (2000–2008 гг.) относительного риска развития опасных желудочно-кишечных осложнений на фоне приема НПВП свидетельствуют о лучшем профиле переносимости ацеклофенака7.
В клиническом исследовании, проведенном в Европе, зафиксирован быстрый и продолжительный анальгетический эффект ацеклофенака у пациентов с различными ревматическими заболеваниями. В исследовании участвовали 23 407 пациентов. Улучшение общего состояния наблюдалось у 84%. 93,5% больных были удовлетворены лечением8.
В последние годы появились данные о риске развития основных сердечно-сосудистых событий на фоне приема НПВП. Установлено, что риск развития сердечно-сосудистых патологий увеличивается не только при длительном применении и больших дозах НПВП, но и в первые дни приема. Поэтому всем больным, которым назначают НПВП, рекомендуется поддерживать уровень артериального давления (АД) не выше 120/80 мм рт. ст. Согласно результатам крупного исследования SPRINT (проводилось под эгидой Национального института здоровья), контроль АД ≤ 120/80 мм рт. ст. способствует сокращению частоты сердечно-сосудистых событий на 30%, смертей – на 25%9.
Сердечно-сосудистые риски НПВП зависят от фармакологических особенностей препарата, продолжительности терапии и дозы. С негативным влиянием на сердечно-сосудистую систему прежде всего ассоциируются селективные ЦОГ-2. Поэтому при наличии сердечно-сосудистых рисков следует назначать полуселективные НПВП, в частности ацеклофенак. «Пациентам с ранее установленными сердечно-сосудистыми заболеваниями и высоким риском развития таковых любые НПВП следует назначать с особой осторожностью», – подчеркнула
выступающая.
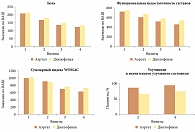
Далее профессор Л.И. Алексеева поделилась опытом применения ацеклофенака (препарата Аэртал®) и диклофенака. В крупном многоцентровом сравнительном рандомизированном исследовании больным остеоартритом коленных суставов назначали ацеклофенак (Аэртал®) 100 мг два раза в день и диклофенак 50 мг два раза в день. Эффективность и безопасность терапии оценивали в течение трех месяцев. Препараты продемонстрировали сопоставимую эффективность в отношении динамики выраженности боли, показателей функциональной недостаточности суставов по WOMAC (Western Ontario and McMaster University Osteoartritis Index), суммарного WOMAC. В группе Аэртала пациентов, у которых на фоне проводимой терапии улучшилось состояние, оказалось больше, чем в группе диклофенака (рис. 1).
В настоящее время на российском рынке появилась удобная форма ацеклофенака (препарата Аэртал®) – порошок для приготовления суспензии. Оценка эффективности такой формы ацеклофенака у 40 пациентов с остеоартритом коленных и тазобедренных суставов в реальной клинической практике в течение двух недель показала уменьшение интенсивности боли, скованности, улучшение функции суставов и уменьшение суммарного WOMAC на 18%. Кроме того, отмечалась хорошая переносимость терапии. Исследователи сделали вывод: препарат Аэртал® в форме порошка может быть рекомендован в качестве эффективного и безопасного средства, особенно лицам с ревматическими заболеваниями10.
Клиническая практика подтверждает возможность комбинированного применения препарата Аэртал® разных форм выпуска. Так, при остеоартрите можно сочетать препарат в форме порошка и 1,5%-ного крема. Последний предназначен для устранения боли и воспаления при тендинитах, миозитах, тендосиновитах, периартритах, ушибах, вывихах. Комбинированная терапия позволяет снизить дозу системного препарата.
Профессор Л.И. Алексеева подчеркнула, что целесообразность использования ацеклофенака при хронической боли у пациентов с мультиморбидной патологией обусловлена его фармакологическими свойствами, противовоспалительной и анальгезирующей активностью, а также лучшим профилем общей безопасности. При терапии Аэрталом не происходит накопления действующего вещества, не требуется коррекции дозы пациентам пожилого возраста и с хронической болезнью почек второй и третьей степени. Препарат изолированно и в сочетании с диуретиками не вызывает изменений АД и осмолярности мочи.
Поскольку боль при остеоартрите многокомпонентна и одним из таких компонентов является мышечный спазм, в схемы лечения помимо НПВП, анальгетиков, симптоматических препаратов замедленного действия следует включать миорелаксанты.
Толперизона гидрохлорид (Мидокалм®) – миорелаксант центрального действия, который успешно применяется для снятия мышечного спазма при заболеваниях опорно-двигательного аппарата. Исследования эффективности добавления Мидокалма к НПВП у пациентов с остеоартритом коленного сустава показали, что такая терапия способствует более быстрому снижению выраженности боли.
В заключение выступления Л.И. Алексеева отметила, что подход к лечению хронической боли должен быть комплексным. Необходимо учитывать механизм развития боли, ее выраженность, наличие сопутствующих заболеваний. Кроме того, следует применять современные методы фармакотерапии в силу их высокой эффективности и лучшей переносимости.
Алгоритм лечения скелетно-мышечной боли. Результаты исследования АЛИСА
Скелетно-мышечная боль является одной из наиболее частых причин обращения к врачу, временной и стойкой потери трудоспособности и снижения качества жизни. Как отметил заведующий лабораторией гастроэнтерологических проблем при ревматических заболеваниях НИИР им. В.А. Насоновой, д.м.н. Андрей Евгеньевич КАРАТЕЕВ, скелетно-мышечная боль – один из факторов, снижающих продолжительность жизни пациентов. Она возникает на фоне различных патологических состояний – остеоартрита крупных суставов, неспецифической боли в спине, ревматической патологии околосуставных мягких тканей11.
К сожалению, среди врачей отсутствует согласованность и преемственность в отношении методов лечения скелетно-мышечной боли. Актуальность проблемы диктует необходимость выработки общих принципов терапии исходя из понимания патогенеза боли. Работа в этом направлении ведется. Так, на сегодняшний день группа российских экспертов (ревматологов, неврологов, терапевтов, травматологов) рассмотрела проект единого алгоритма ведения больных со скелетно-мышечной болью. Использование этого алгоритма в клинической практике позволит облегчить работу врачей, повысить эффективность и безопасность терапии12.
В развитии болевого синдрома задействованы разные патогенетические механизмы. Воспаление признано ведущим фактором формирования болевого синдрома в области патологического процесса. В патогенезе скелетно-мышечной боли важную роль также играют мышечный спазм, энтезопатия, нарушение биомеханики. Вторичное нарушение биомеханики обусловливает изменение работы внутренних органов.
Еще одна важная составляющая формирования хронической скелетно-мышечной боли – дисфункция ноцицептивной системы. На данный феномен указывает частое несоответствие между достаточно умеренными структурными изменениями и выраженностью болевых ощущений.
Спектр терапевтических средств для купирования острой и хронической скелетно-мышечной боли достаточно широк. Он включает НПВП, опиоиды, миорелаксанты, флупиртин, местные анестетики и глюкокортикостероиды (ГКС) для инъекционной терапии, а также антидепрессанты и антицитокиновые препараты.
Докладчик подчеркнул, что НПВП – самый важный инструмент контроля боли в реальной практике. Препараты указанной группы обладают обезболивающей, противовоспалительной и жаропонижающей активностью. Они эффективны в купировании болевых симптомов различной этиологии.
Терапевтическая ценность НПВП снижается из-за риска развития серьезных побочных эффектов, прежде всего со стороны желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой системы. Однако при использовании НПВП подобные эффекты можно корректировать.
Коррекция факторов риска развития осложнений со стороны ЖКТ подразумевает уточнение показаний для использования антитромботических средств, отказ от курения, нормализацию питания, применение пробиотиков и эрадикацию Helicobacter pylori. Риск со стороны сердечно-сосудистой системы можно снизить за счет таких мер, как следование здоровому образу жизни (в частности, выполнение аэробных упражнений), отказ от курения, контроль массы тела, глюкозы и холестерина в крови, АД, эффективное антитромботическое и антигипертензивное лечение.
Таким образом, при оптимизации терапии НПВП необходимо учитывать возможный риск развития осложнений и предпринимать соответствующие меры профилактики.
При выборе НПВП, особенно для длительного применения, следует обращать внимание на соотношение эффективности и безопасности.
Среди современных НПВП одним из наиболее эффективных и безопасных по праву считается ацеклофенак.
Метаанализ 28 популяционных исследований показал, что ацеклофенак характеризуется минимальным риском развития желудочно-кишечных кровотечений, сравнимым с таковым целекоксиба13.
По результатам российского сравнительного исследования АЭРОПЛАН (Анализ Эффективности и Риска Осложнений При Лечении артрита Ацеклофенаком и Нимесулидом), у 60 больных ревматоидным артритом в течение четырех недель терапия ацеклофенаком (препаратом Аэртал®) вызывала нежелательные реакции со стороны ЖКТ в два раза реже, чем терапия нимесулидом (при сопоставимой эффективности). По данным эндоскопического исследования, эрозивно-язвенные изменения наблюдались достоверно чаще в группе нимесулида. Отрицательной динамики показателей АД в обеих группах зарегистрировано не было14.
Далее А.Е. Каратеев представил предварительные результаты программы АЛИСА (Анальгетическое Лечение с Использованием Системного Алгоритма)15. В рамках исследования проводилась ретроспективная оценка результатов последовательного назначения препаратов 3304 пациентам старше 18 лет со скелетно-мышечной болью. Основными причинами скелетно-мышечной боли были остеоартрит, неспецифическая боль в спине, ревматическая патология околосуставных мягких тканей. Перед назначением терапии оценивали уровень локальной боли по Числовой рейтинговой шкале (ЧРШ), наличие отека, гипертонус мышц. При исходной выраженности боли более четырех баллов по ЧРШ назначали системные НПВП, при выраженном гипертонусе мышц – миорелаксант, в случае выраженности локальной боли менее четырех баллов – НПВП локально и парацетамол. Пациентам с высоким сердечно-сосудистым риском рекомендовали трамадол, парацетамол и НПВП местно. После купирования боли лечение прекращалось. В случае развития побочных эффектов или отсутствия улучшения терапия изменялась (замена НПВП, введение ГКС, добавление миорелаксанта, антидепрессанта). Эффективность лечения контролировали каждые семь дней (всего четыре визита).
Анализ результатов показал, что 97,5% врачей назначали системный НПВП. В 93,7% случаев это был ацеклофенак (Аэртал®).
Отличительная особенность российской клинической практики – одновременное назначение системных и топических (в виде мазей и гелей) НПВП – в 59,1% случаев.
Миорелаксанты назначили 67,6% пациентов. Хондропротекторы получали 8,9% больных, парацетамол – 0,9%, ингибиторы протонной помпы – 15,2% больных.
Из миорелаксантов врачи отдавали предпочтение толперизону (Мидокалму) – 97,8%.
Через семь дней купирование боли зафиксировано у 30,5% пациентов, через 14 дней – у 64,6%, через 28 дней – у 76,9% пациентов.
Подавляющее большинство больных (88,4%) через четыре недели терапии оценили ее результат как «хороший» или «превосходный». Перевод на другой НПВП потребовался в 8,1% случаев, локальное введение ГКС – в 1,8%, назначение антидепрессанта или антиконвульсанта – в 1,5%, госпитализация – в 0,25% случаев.
Среди факторов, негативно влияющих на эффективность лечения, указаны возраст старше 65 лет, исходная выраженность боли более семи баллов.
Если у пациента через семь дней терапии отмечалось значительное уменьшение боли (менее четырех баллов), вероятность достижения благоприятного эффекта была в 2,5 раза выше, чем у пациентов, не ответивших на терапию в указанный период. Эти данные позволяют прогнозировать хороший результат в случае раннего начала терапии.
Применение миорелаксантов также ассоциировалось с достоверным повышением эффективности лечения скелетно-мышечной боли.
В заключение А.Е. Каратеев подчеркнул, что ацеклофенак является эффективным и относительно безопасным НПВП и может быть препаратом выбора для контроля скелетно-мышечной боли. Использование алгоритма лечения, основанного на комплексном патогенетическом подходе, обеспечивает эффективное и безопасное купирование скелетно-мышечной боли у большинства пациентов.
Влияние центральных миорелаксантов на краткосрочную эффективность лечебной физкультуры у пациентов с анкилозирующим спондилитом
Анкилозирующий спондилит (АС) – системное хроническое воспалительное заболевание аксиального скелета с частым вовлечением в патологический процесс энтезов и периферических суставов, а также других органов и систем. Терапия АС направлена:
- на максимальное улучшение качества жизни пациентов;
- достижение контроля над симптомами и воспалением;
- предотвращение прогрессирования структурных изменений;
- улучшение качества жизни и социальной активности пациентов.
Врач-ревматолог отделения физиотерапии и реабилитации НИИР им. В.А. Насоновой, к.м.н. Татьяна Васильевна ДУБИНИНА отметила, что лечебная физкультура – основной метод нефармакологического лечения АС. В последнее время большое внимание уделяется не только изучению эффективности данного метода реабилитации, но и способам мотивации больных к его использованию.
Приходится констатировать, что только каждый третий пациент регулярно занимается лечебной физкультурой (ЛФК). Главная причина отказа от занятий – убежденность, что такие занятия могут ухудшить состояние здоровья и не улучшат самочувствие. Нередко пациенты отказываются от физических занятий из-за неправильного выбора упражнений, высокой активности заболевания и выраженной боли.
Повысить приверженность к такому виду терапии можно путем пропаганды адекватных и имеющих доказательную базу методов лечебной физкультуры, информирования о частоте выполнения упражнений, влиянии их на активность заболевания и функциональные возможности16.
Наряду с немедикаментозными методами лечения АС применяют и медикаментозные. Согласно современным рекомендациям по ведению больных АС им показаны НПВП в качестве препаратов первой линии, анальгетики для контроля боли при недостаточной эффективности НПВП, наличии противопоказаний к их применению и/или плохой переносимости, локальное введение ГКС в очаги воспаления. В соответствии с рекомендациями Международной рабочей группы по изучению АС блокаторы ФНО должны назначаться пациентам с персистирующей высокой активностью заболевания и неэффективностью других методов лечения17, 18.
Упоминание о миорелаксантах в рекомендациях по лечению АС отсутствует. В то же время их применение целесообразно ввиду важной роли мышечного спазма в патогенезе неспецифической (скелетно-мышечной) боли в спине.
В амбулаторной практике миорелаксанты используются в сочетании с НПВП у 53,1% больных АС. От 40 до 82,2% пациентов с АС применяют их длительно19. Отсутствие четких рекомендаций делает их прием бесконтрольным и снижает терапевтические возможности.
Установлено, что добавление толперизона гидрохлорида (Мидокалма) к НПВП при лечении острой поясничной боли способствует увеличению количества больных, достигших минимальной выраженности боли или ее купирования, в 2,5 раза20.
Мидокалм® – препарат из группы центральных миорелаксантов, оказывающий миорелаксирующий, анальгетический и легкий сосудорасширяющий эффекты. Он снижает мышечный тонус, устраняет спазм периферических артерий, гипоксию, ишемию, улучшает микроциркуляцию в зоне спазма.
Далее докладчик привела данные исследования эффективности и переносимости толперизона гидрохлорида (Мидокалма) при АС21. Цель исследования заключалась в изучении краткосрочного эффекта и безопасности препарата у больных АС на фоне групповых занятий лечебной физкультурой.
В него включали пациентов с диагнозом АС, которые стабильно принимали НПВП до и во время исследования. В исследование не включали больных, которые применяли другие методы реабилитации и/или физиотерапевтического лечения, имели тяжелую степень функциональных нарушений.
Всего под наблюдением было 40 пациентов старше 18 лет. Все они находились на стационарном лечении в клинике НИИР им. В.А. Насоновой. Больных рандомизировали на две равные группы. Первая группа получала НПВП и выполняла ЛФК, вторая – наряду с указанными методами лечения принимала Мидокалм® в дозе 450 мг/сут. Группы были сопоставимы по половозрастным характеристикам, длительности заболевания, активности и функциональным нарушениям.
Комплекс упражнений лечебной физкультуры состоял из 15 упражнений, направленных на увеличение экскурсии грудной клетки и гибкости позвоночника. Частота повторов одного упражнения – от четырех до восьми, занятия проводились ежедневно, кроме выходных дней, в одно и то же время. Длительность занятий достигала 30 минут.
Продолжительность наблюдения – 14 дней.
Исходно и по окончании исследования анализировались следующие показатели: активность АС по BASDAI (Bath AS Disease Activity Index), функциональные нарушения по BASFI (Bath AS Functional Index), общая оценка активности болезни пациентом по ЧРШ, оценка эффективности лечебной физкультуры пациентом по ЧРШ (ноль – очень эффективная, десять – неэффективная), количество неблагоприятных реакций на фоне терапии Мидокалмом. Подвижность позвоночника определяли по BASMI (Bath AS Metrology Index). Кроме того, оценивалась экскурсия грудной клетки.
Результаты исследования продемонстрировали, что на фоне лечебной физкультуры в обеих группах достоверно увеличился объем движений при измерении экскурсии грудной клетки и выполнении модифицированного теста Шобера, уменьшились значения BASDAI и BASFI, а также общая оценка активности болезни пациентом по ЧРШ. При этом во второй группе увеличение подвижности позвоночника оказалось достоверно выше, чем в первой (рис. 2).
Достоверных различий в динамике индексов BASDAI и BASFI между группами не получено.
При выполнении тестов, входящих в BASMI, интенсивный прирост объема движений наблюдался уже после третьего занятия лечебной физкультурой. У пациентов первой группы он протекал скачкообразно, второй – более быстро и равномерно.
В первой группе оценка эффективности лечебной физкультуры по ЧРШ за время наблюдения достоверно не изменилась, во второй в конце исследования достоверно повысилась (p < 0,01).
Серьезных неблагоприятных реакций на фоне приема Мидокалма за период исследования не зарегистрировано. Однако двум пациентам потребовалось снижение дозы Мидокалма с 450 до 300 мг/сут из-за головокружения.
Предварительные данные краткосрочного исследования продемонстрировали, что добавление толперизона гидрохлорида (Мидокалма) в схему лечения больных АС способствует повышению эффективности лечебной физкультуры.
В заключение Т.В. Дубинина отметила, что требуются дальнейшие исследования эффективности миорелаксантов, в том числе толперизона гидрохлорида, при АС для разработки рекомендаций по использованию препаратов данного класса.
Заключение
Лекарственные средства первого ряда для купирования боли различной природы – НПВП. Не случайно их активно назначают при ревматических заболеваниях пациентам со скелетно-мышечной болью.
Основным действующим веществом препарата Аэртал® (компания «Гедеон Рихтер», Венгрия) является ацеклофенак. Клиническая эффективность ацеклофенака у пациентов с ревматическими патологиями, сопровождающимися болью, была доказана в ряде исследований. Терапия Аэрталом способствовала уменьшению боли, воспаления в суставах, длительности утренней скованности и улучшению общего самочувствия. Очевидные преимущества Аэртала – лучшая переносимость и относительно низкий риск развития серьезных осложнений со стороны ЖКТ по сравнению с другими НПВП.
Препарат Аэртал® выпускается в форме таблеток, порошка и крема для местного применения.
При хронической боли у пациентов с нарушениями опорно-двигательного аппарата применяются также миорелаксанты. Мидокалм® (толперизона гидрохлорид) – препарат из группы центральных миорелаксантов, оказывающий миорелаксирующий, анальгетический и менее выраженный сосудорасширяющий эффекты. Миорелаксирующее действие толперизона гидрохлорида основано главным образом на стабилизации клеточных мембран и блокировке каналов ионов натрия.
В терапевтических концентрациях препарат не влияет на сенсорные и двигательные функции центральной нервной системы, не вызывает седативного эффекта и мышечной слабости.
Препарат Мидокалм® показан для лечения патологически повышенного тонуса и спазмов поперечнополосатой мускулатуры, возникающих вследствие органических заболеваний центральной нервной системы и сопровождающих заболевания опорно-двигательного аппарата, такие как спондилез, спондилоартроз, шейные и поясничные синдромы, артриты крупных суставов. Препарат можно применять в восстановительный период после ортопедических и травматологических операций, а также в составе комбинированной терапии облитерирующих заболеваний сосудов.

