Современные подходы к назначению прогестерона в практике акушера-гинеколога
- Аннотация
- Статья
- Ссылки

Изучение гормонов яичника, и особенно гормонов желтого тела, началось в первой половине XX века. В Германии была высказана гипотеза, позже нашедшая подтверждение, согласно которой желтое тело яичников является эндокринным органом и вырабатывает вещество, необходимое для принятия маткой плодного яйца. Этот гормон был открыт независимо друг от друга несколькими научно-исследовательскими группами. В 1933 г. G.W. Corner и W.M. Allen выделили несколько компонентов желтого тела, одним из которых был прогестерон [1, 2]. В 1940 г. R.E. Marker выделил натуральный прогестерон, молекулярное строение которого было идентично прогестерону человека, из ямса, или сладкого картофеля. Однако только в 1971 г. W.S. Johnson удалось синтезировать прогестерон в лабораторных условиях без применения растительного или животного сырья. Многочисленные работы по изучению влияния прогестерона и его аналогов на различные органы и ткани позволили разработать серию гестагенных препаратов, предназначенных для гормонозаместительной терапии, коррекции менструального цикла и репродуктивной функции, лечения некоторых гинекологических заболеваний, а также предупреждения нежелательной беременности [3].
Прогестерон – естественный стероидный гормон, который вырабатывается желтым телом яичника, плацентой, надпочечниками. В начальной фазе постовуляторного периода, когда наблюдается кратковременное падение концентрации стероидов в крови, лопнувший фолликул начинает заполняться лютеальными клетками, имеющими желтую окраску и богатыми липидами. Биохимическая специализация лютеальных клеток такова, что под влиянием лютеинизирующего гормона (ЛГ), действующего через систему аденилатциклазы, они продуцируют большое и постепенно возрастающее количество прогестерона и эстрогенов [4].
Концентрация прогестерона в плазме крови зависит от целого ряда факторов: размера желтого тела, а точнее количества лютеиновых клеток в нем, их функциональных способностей и васкуляризации железы. Поддерживают жизнедеятельность желтого тела два основных гормона, имеющих гомологичную структуру, – ЛГ и хорионический гонадотропин. Прогестерон способствует выработке фолликулостимулирующего гормона (ФСГ), в малых дозах активирует, а в больших – угнетает выделение ЛГ. При повышенном уровне эстрогенов прогестерон уменьшает чувствительность матки к ацетилхолину, адреналину, эстрогенам. Под влиянием прогестерона происходит развитие альвеол в молочных железах, эндометрий подвергается секреторной трансформации и инициируется его отторжение. Прогестерон способствует обратному развитию аденоматозной гиперплазии, увеличивает потенциал покоя в гладкомышечных клетках, тем самым расслабляет гладкую мускулатуру матки и подавляет сократимость маточных труб. Прогестерон обеспечивает увеличение секреции слоя слизистой, выстилающей фаллопиевы трубы. Секрет, продуцируемый слизистой, служит питательной средой для оплодотворенной делящейся яйцеклетки, продвигающейся по фаллопиевым трубам, прежде чем наступит ее имплантация в матке.
При наступлении беременности концентрация прогестерона растет до 7-й недели гестации, после чего несколько снижается, а с 10-й недели уровень прогестерона постепенно снова увеличивается вплоть до момента родов. На ранних сроках беременности основным источником прогестерона является желтое тело, при этом пик его секреции приходится на 6-ю неделю гестации. Как было показано в экспериментах на животных, удаление желтого тела до 6-й недели беременности во всех случаях приводит к выкидышу. После 16 недель беременности секреция прогестерона плацентой становится достаточной, чтобы продолжать развитие беременности. Таким образом, адекватное функционирование желтого тела является неотъемлемым условием развития и прогрессирования беременности, особенно в первые 6 недель гестации.
Следует отметить, что только натуральный прогестерон является субстратом для восстановленных 5-альфа- и 5-бета-метаболитов, оказывающих присущее им специфическое действие на половую дифференцировку плода, на кожу, клетки мозга и миометрий. Прогестерон регулирует уровень андрогенов двумя способами: через конкурентное подавление 5-альфа-редукции андрогенов и через 5-альфа-прегнандион (5-альфа-метаболит прогестерона), который конкурентно подавляет связывание дигидротестостерона с его рецепторами. Блокада 5-альфа-редуктазы не изменяет прямого действия тестостерона, но физиологически регулирует его преобразование в активную форму – дигидротестостерон, а этот механизм чрезвычайно важен для половой дифференцировки с 12-й до 28-й недели беременности. Таким образом, прогестерон является единственным безопасным прогестагеном для применения на ранних этапах развития беременности [4].
В различные периоды жизни женщин влияние прогестерона на клеточном и тканевом уровнях имеет свои особенности. Количество прогестероновых рецепторов, стимулирующее влияние эстрогенов, зависит от возраста. В пубертатном периоде из-за еще не установившегося циркадного ритма выброса рилизинг-гормона ЛГ даже при овуляторных циклах желтое тело функционирует неполноценно, и, соответственно, прогестерон секретируется в небольшом количестве. Максимальное влияние прогестерона отмечается в репродуктивном периоде женщины. Следствием недостатка прогестерона в организме женщины является нарушение менструального цикла, бесплодие и привычное невынашивание беременности [4].
Большинство влияний прогестерона на овуляцию, процессы имплантации яйцеклетки в матке осуществляется посредством прогестероновых рецепторов, синтезированных в репродуктивном тракте. Аддитивные эффекты прогестерона опосредованы наличием рецепторов к нему в гипоталамусе, гипофизе, молочных железах, костях, желудочно-кишечном тракте, мочевом пузыре, уретре, тимусе и сердечно-сосудистой системе. Ген прогестеронового рецептора локализован в хромосоме 11q22 и представлен изоформами А, В и С. Выделяют 2 типа прогестероновых рецепторов (ПР-А, ПР-В). Соотношение А- и В-рецепторов в тканях-мишенях определяет характер ответа на прогестерон и вариабельность эффекта гестагенов. Стимуляция ПР-А способствует подавлению процессов пролиферации. ПР-В опосредуют антагонистическое влияние на клетки. Обе конформации прогестеронового рецептора имеют домен, образующий связь со стероидом. В настоящее время определено, что активация прогестероновых рецепторов способствует запуску транскрипции около 1800 генов, 60 из которых имеют специфичную функциональную направленность в отношении репродуктивной системы. При активации прогестероновых рецепторов типа В увеличиваются уровни агонистов/вспомогательных белков рецептора трансформирующего фактора роста бета (transforming growth factor beta, TGF-бета) и рецептора эпидермального фактора роста (epidermal growth factor, EGF). Данные рецепторы с помощью внутриклеточных сигнальных механизмов запускают деление клетки через репликацию ДНК, антиоксидантный ответ, стабилизацию митотического веретена деления. Прогестерон имеет родственную связь не только с прогестероновыми рецепторами эндометрия, но также и с рецепторами эстрадиола, кортизола, тестостерона и альдостерона. Прогестерон способен конкурировать с альдостероном за рецепторы, расположенные в почках и в большей степени в миометрии и стенках артерий [5].
Систематический анализ физиологических эффектов прогестерона, осуществляемых посредством транскрипции генов, не специфичных для репродуктивной системы, продемонстрировал их разнонаправленный характер. Например, активация транскрипции обонятельных рецепторов способствует обострению обоняния у беременных. Усиление экспрессии рецепторов эпидермального фактора роста отражает влияние прогестерона на процессы пролиферации и дифференцировки эпидермиса [6].
Анксиолитический эффект и формирование доминанты беременности являются результатом усиления транскрипции серотониновых рецепторов и опосредуются 5-альфа-метаболитом прогестерона 5-альфа-прегнанолоном, связывающим ГАМК-рецепторы головного мозга. Чрезмерная стимуляция данных рецепторов активирует синтез ГАМК в головном мозге и может привести к когнитивной дисфункции и перестройкам эмоционального статуса женщины. Метаболит прогестерона – 5-альфа-прегнанолон – обладает антидисфорической активностью, участвует в регулировании процессов сна и бодрствования и, возможно, оказывает нейропротекторный эффект после повреждения мозговой ткани, модулирует процессы канцерогенеза в головном мозге [6].
Токолитический эффект прогестерона в отношении мышц матки и регуляция артериального давления осуществляются благодаря снижению содержания уровня простагландинов и опосредуются 5-бета-метаболитами – 5-бета-прегнандионом и прегнанолоном. Коррекцию артериального давления можно проводить с целью профилактики развития преэклампсии. Прогестерон в физиологической концентрации благоприятно влияет на активность макрофагов и пролиферацию клеток эндотелия и гладкой мускулатуры стенки артерий [6].
Состояние иммунотолерантности во время беременности на фоне повышенного уровня прогестерона обеспечивает благополучное прогрессирование беременности и развитие плода. Прогестерон-индуцированный блокирующий фактор (progesterone induced blocking factor, PIBF), синтезирующийся в ответ на взаимодействие прогестерона с прогестероновыми рецепторами, является пусковым фактором в развитии иммуносупрессии во время беременности. Прогестерон модулирует процесс дифференцировки Т-лимфоцитов в направлении Th2, контролирует цитотоксичность клеток – естественных киллеров (natural killer cell, NK-клетки) и синтез провоспалительных цитокинов (интерлейкины (ИЛ) – ИЛ-4, ИЛ-6, ИЛ-10) [6].
Прогестерон оказывает на эндотелий сосудов защитное действие, которое реализуется только при физиологических уровнях прогестерона. Усиленная стимуляция рецепторов эндотелия в процессе лечения синтетическими прогестинами приводит к изменению его функции путем влияния на вазодилатацию, транспорт липидов, адгезию белков и, как следствие, к изменению морфологического состояния сосудистой стенки. Следует отметить, что синтетические гестагены хорошо переносятся пациентами, но их прием противопоказан во время беременности, у пациенток с нарушением функции печени, у больных с раком молочной железы, заболеваниями сосудов головного мозга и дисфункцией коронарных артерий, у женщин с отягощенным анамнезом по возникновению тромбоэмболии, а также у курящих женщин [6, 7].
В настоящее время ни один из синтетических прогестинов (кроме дроспиренона) не обладает антиальдостероновым действием, и ни один из них (включая дидрогестерон) не способен к образованию 5-альфа- и 5-бета- восстановленных метаболитов, необходимых для осуществления физиологических эффектов прогестерона. Все синтетические прогестины создавались по принципу их высокой аффинности и длительности взаимодействия с прогестероновыми рецепторами, в результате оказалось, что слишком сильная связь синтетических прогестинов с рецепторами эндотелия увеличивает риск развития сердечно-сосудистых заболеваний у приматов и людей. В отличие от синтетических прогестинов, натуральный прогестерон превращается в функционально активные метаболиты. 20-альфа-гидроксипрогестерон и 17-гидроксипрогестерон пролонгируют фармакологические эффекты прогестерона. 5-альфа-прегнандион имеет сродство к рецепторам тестостерона, ингибируя действие последнего, уменьшает митотический потенциал клеток эндометрия. 5-бета-прегнандион блокирует утеротоническое действие окситоцина. Прегнанолон и аллопрегнанолон являются агонистами ГАМК-рецепторов и оказывают анксиолитическое действие [4].
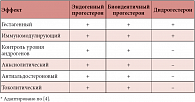
С момента открытия и до настоящего времени прогестерон широко используется в практике акушера-гинеколога. Более подробные исследования влияния прогестерона на различные органы и ткани позволили дополнить список показаний к его применению. Изучению основных эффектов и безопасности применения биоидентичного прогестерона в сравнении с синтетическими прогестинами посвящено множество крупных рандомизированных контролируемых исследований. В таблицах 1 и 2 представлены основные биологические эффекты прогестерона и синтетических прогестинов [2–4, 8–10, 12].
Биоидентичный прогестерон, в отличие от синтетических аналогов, имеет полное сходство с молекулой эндогенного прогестерона. Именно это свойство и обеспечивает целый ряд его уникальных свойств и незначительное количество побочных эффектов.
Недостаточность желтого тела (нарушение лютеиновой фазы менструального цикла) – это состояние, при котором желтое тело образует прогестерон в количествах, недостаточных для имплантации оплодотворенной яйцеклетки и ее развития в эндометрии. К недостаточности желтого тела может привести любое нарушение роста и развития фолликула. Недостаточность желтого тела почти всегда проявляется нарушениями менструального цикла, предменструальным синдромом, привычным самопроизвольным выкидышем на ранних сроках или преждевременными родами на поздних сроках беременности, реже – первичным бесплодием. Коррекция неполноценной функции желтого тела с помощью прогестерона является патогенетически оправданной [9].
H.M. Fatemi и соавт. в своем исследовании проводили сравнительный анализ влияния дидрогестерона в форме для перорального приема и интравагинально введенного микронизированного прогестерона на процесс секреторной трансформации эндометрия и гормональный профиль у женщин с преждевременным угасанием функции яичников. На фоне вагинального применения микронизированного прогестерона на 21-й день цикла гистологическая картина эндометрия соответствовала полноценной секреторной трансформации у 83% женщин, на фоне использования перорального дидрогестерона – только у 17% (р < 0,05) [11].
В двойном слепом плацебоконтролируемом многоцентровом исследовании, продолжительность которого составила 3 года, было определено, что у беременных женщин с короткой шейкой матки ежедневное интравагинальное применение прогестерона в дозе 200 мг с 24-й по 34-ю неделю беременности достоверно снижает частоту встречаемости спонтанных преждевременных родов практически в 2 раза [12].
В 2001 г. S. Wyatt опубликовал результаты метаанализа, посвященного определению эффективности различных схем применения микронизированного прогестерона (per os по сравнению с per vaginum или per rectum) и прогестинов (дидрогестерон, медроксипрогестерона ацетат, норэтистерона ацетат) у женщин с различными вариантами предменструального синдрома. Использование пероральной формы прогестерона оказалось на 30% эффективнее прогестерона с другими путями ведения и прогестинов соответственно (р < 0,05) [13].
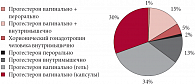
В 2009 г. на основании опроса специалистов 97 центров экстракорпорального оплодотворения из 35 стран представлены данные анализа 50 000 циклов лечения в рамках программы экстракорпорального оплодотворения (ЭКО). Как продемонстрировано на рисунке, 34% опрошенных применяли прогестерон вагинально в виде геля или крема, 30% – в виде вагинальных капсул, 15% сочетали вагинальные формы с внутримышечными инъекциями прогестерона. Таким образом, вагинальные формы прогестерона предпочтительны и более удобны в качестве гормонозаместительной терапии в программе ЭКО [14].
В заключение необходимо отметить, что женщинам, желающим забеременеть, особенно с помощью вспомогательных репродуктивных технологий, для поддержания функции желтого тела может быть назначен только биоидентичный прогестерон; оптимальным способом применения остается вагинальный. Синтетический прогестин не может заменить прогестерон при беременности. У всех беременных синтетические прогестины увеличивают риск нарушения контроля сократимости матки и, возможно, рождения недоношенного ребенка. Прогестерон является ключевым гормоном для обеспечения рецептивности эндометрия в фазу «окна имплантации», создания оптимальных условий для адгезии и инвазии плодного яйца и дальнейшего нормального развития беременности.
Пероральный прием способствует быстрому поступлению прогестерона в плазму крови и более выраженному нейропротекторному и анксиолитическому эффекту, что наиболее актуально у пациенток с предменструальным синдромом.
У женщин в период пременопаузы (с близкой к норме секрецией эндогенного эстрадиола, но короткой или недостаточной фазой желтого тела) пероральное применение микронизированного прогестерона является эффективным методом купирования симптомов и устранения последствий недостаточности прогестерона (менструальные расстройства, вторичная аменорея, гиперплазия эндометрия).
У женщин в постменопаузальном периоде использование прогестагенов не должно сопровождаться увеличением риска развития сердечно-сосудистых заболеваний. Следовательно, оптимальным видом терапии будет пероральное применение прогестерона, который в адекватных дозах не снижает уровень липопротеидов высокой плотности, не влияет на метаболизм глюкозы и не устраняет благоприятного влияния эстрогенов на артериальную стенку (вазодилатация, перенос липопротеидов низкой плотности, активность макрофагов и их адгезия, пролиферация клеток гладкой мускулатуры, поддержание структуры соединительной ткани). Прогестерон в сочетании с трансдермальными эстрогенными препаратами снижает митотическую активность эпителиальных клеток молочной железы и тем самым снижает риск развития рака молочной железы (по сравнению с лечением только эстрадиолом). Именно поэтому показаны хорошие результаты комплексной заместительной гормональной терапии при применении прогестерона с любым эстрогенным компонентом.
Таким образом, накопленный отечественный и зарубежный опыт свидетельствует о том, что, несмотря на все возрастающее число синтетических прогестинов, использование микронизированного прогестерона остается актуальным и безопасным в практике акушера-гинеколога. С момента появления натурального прогестерона для перорального и вагинального применения его препараты заняли лидирующее положение и сегодня остаются средствами выбора в репродуктологии.
