Современный подход к лечению герпесвирусных инфекций у беременных
- Аннотация
- Статья
- Ссылки
- English

Введение
В структуре вирусных инфекций лидирующие позиции занимает герпесвирус. Восемь представителей семейства Herpesviridae из 100, известных в настоящее время, способны инфицировать человека. Герпесвирусные инфекции у беременных представляют актуальную проблему здравоохранения, поскольку их роль в формировании перинатальной патологии очевидна [1–3].
Наиболее коварным представителем семейства Herpesviridae считается цитомегаловирус (ЦМВ) человека. В большинстве случаев вызываемая им инфекция протекает субклинически, без специфических симптомов, вследствие чего ее своевременная диагностика затруднена.
Как правило, врожденная ЦМВ-инфекция является результатом антенатальной трансплацентарной передачи вируса от матери с первичной или реактивированной инфекцией. Высокий 50%-ный риск перинатальной передачи ЦМВ при острой ЦМВ-инфекции у беременной связан с незрелостью адаптивного и противовирусного иммунитета плода. При реактивированной форме инфекции у беременной этот показатель значительно ниже – 5%. Кроме того, риск инфицирования плода ЦМВ зависит от патологии течения беременности (гестоз, фетоплацентарная недостаточность), способа родоразрешения. 15–20% младенцев инфицируются внутриутробно, 80–85% – интранатально [4].
К плоду ЦМВ попадает через пупочный кровоток. Распространяясь по различным органам, ЦМВ приводит к генерализации инфекции. Находясь в сосудистом русле, вирус достигает ворсин хориона или плаценты и при повреждении эпителия плодной оболочки проникает в околоплодные воды. Частота трансплацентарного инфицирования ЦМВ новорожденных колеблется от 0,2 до 14% [5].
Возможен и трансцервикальный путь инфицирования плода (3–5%). Частота обнаружения ЦМВ в генитальном тракте беременных, по данным разных авторов, – 7,4–9,7% [5, 6].
До настоящего времени окончательно не решена проблема терапии герпесвирусных инфекций во время беременности. Активизация герпесвирусной инфекции в ранние сроки беременности представляет наибольшую опасность для развивающегося эмбриона. Однако не все известные противовирусные химиопрепараты могут быть использованы у беременных из-за высокой токсичности и потенциального негативного влияния на детородную функцию. Сложность поиска адекватных схем терапии обусловлена жесткими требованиями к безопасности противовирусных средств, исключающими риск нежелательного воздействия на плод [7–9]. Не случайно клинические исследования и поиск схем иммунокорригирующей терапии, способствующей подавлению или снижению активности инфекции во время беременности, продолжаются.
Одним из приоритетных направлений исследовательской работы сотрудников НИИ вирусологии им. Д.И. Ивановского (в настоящее время входит в состав ФНИЦЭМ им. Н.Ф. Гамалеи) на базе ИКБ № 1 г. Москвы является разработка новых диагностических и профилактических препаратов при герпесвирусных инфекциях, а также их клиническая апробация. На протяжении многих лет беременным, направляемым в акушерское отделение ИКБ № 1 г. Москвы для сохранения беременности или родоразрешения, проводятся комплексное вирусологическое и иммунологическое обследование, лечение активных форм герпесвирусной инфекции (ЦМВ-инфекция, герпесвирусная инфекция, ассоциированная с вирусом простого герпеса 1-го и 2-го типов). Кроме того, осуществляются обследование детей, рожденных женщинами с разными формами герпесвирусных инфекций, и клиническое наблюдение в течение раннего неонатального периода.
Целью иммунокорригирующей терапии является установление контроля иммунной системы организма по недопущению активизации инфекции. Лечению подлежат беременные, у которых обнаружен инфекционный вирион в крови, моче или соскобе со слизистой оболочки шейки матки, в сочетании со специфическим маркером активной инфекции – антителами класса М [10].
Лечение беременных с активными формами ЦМВ-инфекции направлено:
- на ликвидацию активности инфекции;
- прекращение вирусной репликации и экскреции;
- элиминацию анти-ЦМВ IgM-антител из крови;
- трансформацию реактивированной и персистирующей форм инфекции в латентную форму.
Как известно, у большинства доноров в крови содержатся специфические антитела к ЦМВ вследствие широкого распространения вируса в популяции. Поэтому с целью пассивной иммунопрофилактики и лечения ЦМВ-инфекции у беременных применяют иммуноглобулины – гипериммунные препараты, содержащие антитела к ЦМВ [11–13]. Иммуноглобулины оказывают иммуномодулирующее и антитоксическое действие и активируют фагоцитарные реакции. Положительный эффект иммунотерапии у беременных на фоне применения нормального иммуноглобулина человека выражается в элиминации вируса и рождении детей без клинических признаков врожденной ЦМВ-инфекции.
Иммуноглобулин для внутримышечного введения вводят по 3,0 мл/сут в течение трех дней, затем по 1,5 мл/сут в течение четырех дней.
Способность интерферона подавлять репликацию вируса в организме человека и слабая индукция при ЦМВ-инфекции послужили основанием для применения препаратов интерферона или его индукторов [14–17]. На фоне применения интерферонов, в частности препарата Виферон®, с противовирусной и иммуномодулирующей целью у беременных с ЦМВ-инфекцией отмечается положительный терапевтический эффект (табл. 1). Виферон® вводили по следующей схеме: по одному суппозиторию 500 000 МЕ ректально два раза в сутки через 12 часов в течение десяти суток (суточная доза 1 000 000 МЕ), далее по одному суппозиторию 500 000 МЕ дважды в неделю – десять суппозиториев.
Материал и методы исследования
В акушерское отделение ИКБ № 1 г. Москвы на протяжении нескольких лет было направлено в общей сложности 636 беременных в возрасте от 15 до 45 лет на разных сроках беременности с диагнозом ЦМВ-инфекции для сохранения беременности и родоразрешения.
Для определения формы ЦМВ-инфекции использовали серологические (выявление специфических анти-ЦМВ антител классов IgG и IgM в сыворотке крови посредством непрямой иммунофлуоресценции) и вирусологические (выявление антигена ЦМВ в культуре фибробластов легких эмбриона человека, зараженных кровью и/или мочой беременных (быстрый культуральный метод с инкубацией 48 часов)) методы. Для обнаружения антигена ЦМВ использовали моноклональные антитела к предраннему рр72 и раннему рр65 антигенам. Детекция антигена проводилась непрямым методом иммунофлуоресценции.
У 60 пациенток определена ДНК цитомегаловируса в соскобах со слизистой оболочки шейки матки методом полимеразной цепной реакции (ПЦР). Этот метод основан на выявлении генома ЦМВ в образцах материала, полученного от пациентов.
Сочетание вирусологических и серологических методов оптимально, поскольку позволяет не только диагностировать ЦМВ-инфекцию, но и определить ее активность.
Результаты и их обсуждение
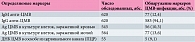
Маркеры ЦМВ выявлены у 620 (97,5%) из 636 пациенток (табл. 2).
Антитела к ЦМВ класса IgM имели место в 12,4% случаев, класса IgG – в 94,1%. Следует отметить, что IgM-антитела всегда выявлялись одновременно с антителами класса IgG.
Антиген ЦМВ в клеточной культуре, зараженной кровью, обнаружен у 10,3% обследованных, антиген ЦМВ в клеточной культуре, зараженной мочой, – у 13,6%.
В соскобе со слизистой оболочки шейки матки методом ПЦР определена ДНК ЦМВ у 9,1% беременных. У двух серопозитивных женщин обнаружены антиген ЦМВ в моче и ДНК ЦМВ в соскобе со слизистой оболочки шейки матки.
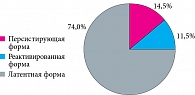
В соответствии с принятой в нашей клинике классификацией, у беременных, находившихся под наблюдением, выделены три формы ЦМВ-инфекции (рис. 1). Преобладала латентная форма инфекции, без признаков репликации вируса – 459 (74,1%) пациенток.
Под реактивацией вирусной инфекции понимают возобновление у серопозитивного пациента репродукции вируса, находившегося ранее в латентном состоянии. Реактивированная форма инфекции диагностирована у 71 (11,5%) беременной при выявлении специфических IgM-антител в сочетании с антицитомегаловирусными IgG-антителами (в большинстве случаев) и одновременным обнаружением других маркеров ЦМВ-инфекции.
Выделение вируса из клинических материалов и наличие специфических антител класса IgG в отсутствие антицитомегаловирусных IgM-антител обозначаются как персистирующая форма ЦМВ-инфекции в стадии продуктивной репликации. Она зарегистрирована у 90 (14,5%) пациенток.
Входящие в группу риска по внутриутробной передаче ЦМВ беременные с реактивированной и персистирующей формами инфекции подлежали лечению.
С целью разработки новых схем лечения беременных с герпесвирусными инфекциями было проведено рандомизированное контролируемое клиническое исследование. В ходе исследования сравнивали две схемы терапии, анализировали результаты включения в комплексную терапию беременных с ЦМВ-инфекцией в качестве иммуномодулирующего и интерферонкорригирующего компонента препарата Виферон®. Рандомизация больных проводилась методом случайной выборки.
Лечение получили 71 беременная с реактивированной формой ЦМВ-инфекции и 90 пациенток с персистирующей формой ЦМВ-инфекции на 15–39-й неделе гестации.
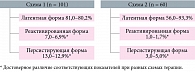
С целью прекращения вирусной экскреции и элиминации специфических IgM-антител из крови, конверсии реактивированной и персистирующей форм инфекции в латентную 101 беременной с активной формой ЦМВ-инфекции назначали нормальный человеческий иммуноглобулин для внутривенного введения в дозе 25,0 мл № 3 через день (схема 1, рис. 2). Препарат переносился хорошо, каких-либо побочных явлений не зафиксировано.
Через четыре недели после окончания лечения пациенткам повторно провели вирусологическое и серологическое обследование. После терапии трансформация активных форм ЦМВ-инфекции в латентную наблюдалась в 81 (80,2%) случае. Реактивированная форма диагностирована у семи (6,9%), персистенция вируса сохранялась у 13 (12,9%) пациенток.
Нормальный человеческий иммуноглобулин назначали в сочетании с препаратом Виферон®, суппозитории ректальные, по 500 000 МЕ 60 беременным (схема 2, рис. 2). Виферон® вводили по схеме: по одному суппозиторию 500 000 МЕ ректально два раза в сутки через 12 часов в течение десяти суток (суточная доза 1 000 000 МЕ). Далее по одному суппозиторию 500 000 МЕ дважды в неделю – десять суппозиториев. Оба препарата переносились хорошо, каких-либо побочных явлений не зафиксировано. После лечения трансформация активных форм ЦМВ-инфекции в латентную отмечалась у 56 (93,3%) пациенток. Реактивированная форма диагностирована у одной (1,7%) (р < 0,05), персистенция вируса сохранялась у троих (5,0%) (р < 0,05).
Возраст и данные преморбидного анамнеза беременных, получавших схемы 1 и 2, были сопоставимы. Это позволило провести сравнительный статистический анализ.
Заключение
Конверсия форм ЦМВ-инфекции у беременных, получавших разные схемы терапии, отображена на рис. 2. Клиническую эффективность двух представленных схем лечения активных форм ЦМВ-инфекции у беременных можно считать сопоставимой. Максимальные значения элиминации ЦМВ были зарегистрированы на фоне применения нормального человеческого иммуноглобулина в сочетании с препаратом Виферон®. Все 24 пациентки с сохраняющейся активной формой ЦМВ-инфекции, подтвержденной репликацией ЦМВ и наличием маркеров активности инфекционного процесса, получили второй курс лечения в соответствии со схемой 2. Результаты диагностического исследования через четыре недели после окончания курса иммунотерапии показали, что конверсия активных форм ЦМВ-инфекции в латентную после повторного курса лечения по схеме 2 произошла у всех пациенток. Это свидетельствовало об эффективности комбинации двух препаратов с разным механизмом действия по предотвращению внутриутробного инфицирования, улучшении прогноза для плода и новорожденного. Схему 2 можно рекомендовать в качестве средства выбора.
L.B. Kisteneva, S.G. Cheshik, N.R. Revazyan, L.N. Bondareva, V.V. Malinovskaya, L.V. Kolobukhina, N.A. Malyshev, A.V. Devyatkin
Federal Research Center of Epidemilogy and Microbiology named after the honorary academician N.F. Gamaleya
Contact person: Lidiya Borisovna Kisteneva, lidia.kisteneva@gmail.com
In our study, we included Viferon® as immunomodulating and interferon-correcting agent into the combination therapy of pregnant women with cytomegalovirus infection. Viferon® was applied as follows: per one rectal 500 000 ME suppository twice a day, with 12-hour interval, for 10 days (daily dosage – 1 000 000 ME). Then, Viferon® was administered per 500 000 ME twice a week, total 10 suppositories. The results of the study demonstrated positive therapeutic effect after administering Viferon®.

