Статины являются краеугольным камнем первичной и вторичной профилактики сердечно-сосудистых осложнений у пациентов с повышенным уровнем холестерина липопротеинов низкой плотности (ХС ЛПНП) и ХС не липопротеинов высокой плотности (ХС неЛПВП) [1–3]. Накоплены убедительные доказательства, что у таких пациентов статины снижают риск инфаркта миокарда, инсульта и сердечно-сосудистой смерти на 25–30% [4–6]. В 2008 г. анализ результатов исследования JUPITER (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin) показал небольшое, но статистически значимое увеличение частоты новых случаев сахарного диабета (СД), репортированного врачами, в группе пациентов, получавших розувастатин, по сравнению с группой плацебо [7, 8]. Впоследствии были проанализированы данные других рандомизированных клинических исследований (РКИ) с использованием статинов для оценки их потенциального влияния на риск развития СД. В результате Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) в 2012 г. приняло решение дополнить инструкции по применению всех статинов информацией о повышении уровня гликозилированного гемоглобина (HbA1c) и уровня глюкозы плазмы натощак на фоне терапии статинами [9].
Дискуссия о диабетогенном риске статинов не утихает. Ключевыми остаются следующие вопросы:
- вызывают ли статины СД, и является ли этот эффект классовым и дозозависимым;
- каково соотношение «польза/риск»;
- какие пациенты, получающие статины, подвержены наибольшему риску развития СД;
- каковы возможные механизмы развития СД;
- существуют ли (нужны ли) стратегии предупреждения развития СД на терапии статинами;
- надо ли менять тактику лечения пациента статинами при развитии у него СД?
Взаимосвязь терапии статинами и риск развития новых случаев СД. Соотношение «польза/риск»
До настоящего времени не проведено ни одного РКИ, специально запланированного для изучения связи между терапией статинами и риском развития СД. Однако результаты анализа подгрупп, post-hoc анализов, метаанализов РКИ и наблюдательных исследований предоставляют определенную информацию.
Считается, что дебаты по проблеме начались после опубликования результатов исследования JUPITER – РКИ по первичной профилактике у 17 802 пациентов среднего возраста с уровнем ХС ЛПНП < 130 мг/дл, но повышенным уровнем высокочувствительного С-реактивного белка > 2 мг/дл. Комбинированную первичную конечную точку составляли такие события, как инфаркт миокарда, инсульт, нестабильная стенокардия, артериальная реваскуляризация, сердечно-сосудистая смерть. Лечение розувастатином (Крестором) 20 мг/сут по сравнению с терапией плацебо позволило снизить риск первичной конечной точки на 43% при повышении риска новых случаев СД (репортированного врачами) на 25% [7].
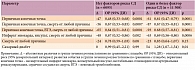
Был выполнен post-hoc анализ исследования JUPITER для оценки соотношения «польза (от снижения риска сердечно-сосудистых осложнений) / риск (развития новых случаев СД)» [10]. В исследование не включали лиц с известным СД, но многие пациенты исходно имели основные факторы риска развития СД, такие как метаболический синдром, нарушенная гликемия натощак, индекс массы тела (ИМТ) > 30 кг/м2, HbA1c > 6%. У пациентов с одним и более фактором риска развития СД терапия розувастатином по сравнению с таковой плацебо способствовала снижению риска первичной конечной точки на 39% (p = 0,0001) и повышению риска СД на 28% (p = 0,01). Так, на 54 новых случая СД приходилось 134 предотвращенных сердечно-сосудистых события. У пациентов без факторов риска СД терапия розувастатином ассоциировалась со снижением риска первичной конечной точки на 52% (p = 0,0001) без повышения риска СД (p = 0,99) (табл. 1) [10, 11].
Анализ, ограниченный только пациентами, у которых за период наблюдения развился СД, показал снижение сердечно-сосудистого риска на фоне терапии розувастатином по сравнению с плацебо (относительный риск (ОР) 0,63; 95% доверительный интервал (ДИ) 0,25–1,60), сопоставимое с таковым в целом в исследовании (ОР 0,56; 95% ДИ 0,46–0,69). Абсолютная польза от снижения риска сердечно-сосудистых осложнений на терапии розувастатином превышала риск развития новых случаев СД у пациентов с факторами риска развития СД и без таковых.
N. Sattar и соавт. представили метаанализ 13 РКИ с использованием статинов против плацебо или обычной практики с участием 91 140 пациентов, не имевших СД при включении в исследования [12]. За время наблюдения (в среднем четыре года) у пациентов, получавших статины, было зарегистрировано на 174 новых случая СД больше (2226 и 2052). Взвешенный ОР развития СД составил 1,09 (95% ДИ 1,02–1,17) при отсутствии гетерогенности между исследованиями (I2 = 11,2%). Различий между изученными статинами (аторвастатин 10 мг/сут, ловастатин 20–40 мг/сут, правастатин 10–40 мг/сут, розувастатин 10–20 мг/сут, симвастатин 20–40 мг/сут) в отношении диабетогенного потенциала не выявлено. Число пациентов, которых необходимо лечить статинами в течение четырех лет, чтобы развился один случай СД (NNH – number needed to harm), составило 255.
Экстраполируя данные метаанализа Cholesterol Treatment Trialists [13], авторы пришли к выводу, что лечение статинами в течение четырех лет 255 пациентов позволит предотвратить 5,4 коронарного осложнения (коронарная смерть или несмертельный инфаркт миокарда) из расчета снижения уровня ХС ЛПНП на 1 ммоль/л (38,7 мг/дл). В действительности эта оценка не отражает в полной мере пользу статинов, поскольку не учитывает их эффект в снижении риска инсульта и артериальной реваскуляризации, тем большего, чем выше доза.
В метаанализе пяти РКИ с участием 32 752 пациентов, исходно не имевших СД, проанализирована взаимосвязь интенсивного режима терапии статинами (аторвастатин 80 мг или симвастатин 80 мг) по сравнению с обычным режимом (аторвастатин 10 или 20 мг, правастатин 40 мг, симвастатин 20 или 40 мг) и риском развития СД [14]. СД чаще развивался у пациентов, получавших более высокие дозы статинов по сравнению с обычными (1449 (8,8%) и 1300 (8,0%)). Взвешенный ОР развития СД составил 1,12 (95% ДИ 1,04–1,22). Гетерогенность между исследованиями отсутствовала (I2 = 0%). Этот метаанализ существенно расширил представления о риске СД, ассоциированном с терапией статинами, продемонстрировав дозозависимость этой связи. Число пациентов, которых необходимо лечить высокими дозами статинов в течение одного года для развития одного случая СД, составило 498 (соответствует NNH = 125 в течение четырех лет по сравнению с приведенными выше данными N. Sattar). Число пациентов, которых необходимо лечить в течение одного года для предотвращения одного сердечно-сосудистого осложнения (NNT – number needed to treat), составило 155. Таким образом, если 498 пациентов в течение одного года лечить статинами в высоких дозах по сравнению с терапией обычными дозами, то удастся предотвратить 3,2 сердечно-сосудистого осложнения. При этом СД разовьется только в одном случае.
Результаты метаанализов РКИ свидетельствуют, что терапия статинами ассоциирована с умеренным, но статистически значимым повышением риска развития новых случаев СД на 10–12%, причем этот риск несколько выше при использовании интенсивных режимов статинотерапии. Наряду с этим метаанализы РКИ (как и многочисленные отдельные исследования) убедительно показывают, что статины снижают риск инфаркта миокарда, инсульта, коронарной реваскуляризации и сердечно-сосудистой смерти на 25–30%. Это снижение риска сердечно-сосудистых осложнений выражено в большей степени при терапии более высокими дозами статинов. Итак, расчетные данные свидетельствуют, что польза существенно превышает риск: несколько предотвращенных сердечно-сосудистых осложнений на один новый случай СД, ассоциированного с терапией статинами или интенсификацией терапии статинами.
Какие пациенты, получающие статины, подвержены наибольшему риску развития СД?
Поскольку повышение риска развития СД на терапии статинами можно считать установленным фактом, особое значение приобретает выделение групп пациентов, получающих статинотерапию, с наибольшим риском развития СД.
Результаты post-hoc анализа исследования JUPITER показали, что риск развития новых случаев СД, ассоциированного с терапией статинами, у женщин был существенно выше, чем у мужчин (50%; p = 0,008 и 13%; p = 0,29 соответственно) [15]. Важный вывод о более высоком риске развития СД на фоне терапии статинами у пожилых пациентов сделан на основании результатов метаанализа N. Sattar и соавт. Не установлено связи риска развития СД с исходным ИМТ или процентным снижением ХС ЛПНП [12].
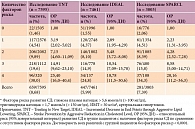
Множественный регрессионный анализ трех исследований в отдельности и целом, выполненный D.D. Waters и соавт., позволил выявить факторы, существенно повышающие риск развития СД: глюкоза плазмы натощак > 5,6 ммоль/л (> 100 мг/дл), триглицериды натощак > 1,7 ммоль/л (> 150 мг/дл), ИМТ > 30 кг/м2, артериальная гипертония. Риск СД возрастал по мере увеличения количества факторов риска, имеющихся у пациента (табл. 2) [16].
Некоторые пациенты обладают более высокой чувствительностью к эффектам статинов. Так, у азиатов по сравнению с лицами белой расы обычно наблюдается усиленный ответ на терапевтические дозы препаратов. Это может быть обусловлено генетическими различиями в метаболизме статинов (различиями в уровне и активности печеночных ферментов и транспортеров). В ходе исследования Women’s Health Initiative с участием 153 840 женщин в постменопаузе отмечалось повышение риска развития СД, ассоциированного с терапией статинами, на 75% (на 45% после учета других влияющих факторов – возраста, ИМТ и т.д.) [17]. Подгрупповой анализ, основанный на оценке расовой/этнической принадлежности, показал увеличение риска СД у азиатов на 78% (ОР 1,78; 95% ДИ 1,32–2,40), у лиц белой расы – на 49% (ОР 1,49; 95% ДИ 1,38–1,62). Предполагается, что азиаты в большей степени подвержены риску развития СД, ассоциированного с терапией статинами.
Следует принимать во внимание сопутствующую терапию, которая также может обладать диабетогенным эффектом. В исследовании NAVIGATOR (Nateglinide and Valsartan in Impaired Glucose Tolerance Outcomes Research), изучавшем влияние валсартана и натеглинида на развитие СД у пациентов с нарушенной толерантностью к глюкозе и другими сердечно-сосудистыми факторами риска, совместное использование тиазидных диуретиков и статинов ассоциировалось со значительным увеличением риска развития СД в отличие от сочетания с бета-блокаторами или блокаторами медленных кальциевых каналов [18].
В проспективном контролируемом исследовании терапия аторвастатином приводила к значительному увеличению инсулинорезистентности у женщин с cиндромом поликистозных яичников [19].
Таким образом, для оценки индивидуального риска развития СД, ассоциированного с терапией статинами, необходимо учитывать следующие факторы [20]:
- глюкоза плазмы натощак > 5,6 ммоль/л (> 100 мг/дл);
- триглицериды плазмы натощак > 1,7 ммоль/л (> 150 мг/дл);
- ИМТ > 30 кг/м2;
- артериальная гипертония.
К дополнительным факторам риска относятся:
- семейный анамнез сахарного диабета 2 типа;
- женский пол;
- пожилой возраст (особенно при терапии высокими дозами статинов);
- принадлежность к азиатской расе;
- длительность терапии статинами;
- сопутствующая терапия диабетогенными препаратами;
- синдром поликистозных яичников.
Учитывая эти факторы риска, врачу следует убеждать пациентов, принимающих статины, строго соблюдать немедикаментозные меры – придерживаться здорового питания, выполнять регулярные физические нагрузки.
Пациентов, получающих терапию статинами, особенно имеющих факторы риска развития статин-индуцированного СД, необходимо подвергать скринингу на наличие СД в соответствии с национальными рекомендациями [21]. Сахарный диабет может быть диагностирован на основании уровня глюкозы плазмы натощак, перорального глюкозотолерантного теста и HbA1c [21].
Рекомендации по началу терапии статинами у пациентов без известного СД сводятся к следующему [22].
- Оценить факторы риска развития СД и сердечно-сосудистых заболеваний. У пациентов с факторами риска СД определить глюкозу плазмы натощак и HbA1c до начала терапии статинами.
- Подчеркивать значение поддержания массы тела при соблюдении принципов здорового питания и регулярной физической активности до начала и во время терапии статинами для снижения риска развития СД и сердечно-сосудистых заболеваний. Оценивать массу тела в стандартных условиях (натощак, в легкой одежде, без обуви) на каждом визите.
- Использовать статины для снижения сердечно-сосудистого риска в соответствии с действующими рекомендациями при отсутствии противопоказаний.
- В случае развития СД на фоне терапии статинами поддерживать массу тела и назначать гипогликемическую терапию по показаниям для контроля гликемии и HbA1с.
Как влияет терапия статинами на контроль гликемии у пациентов с СД?
Несмотря на то что пациентов с СД включали во многие РКИ, в ходе которых применяли статины, публикации результатов исследований редко содержат данные о влиянии терапии статинами на показатели контроля гликемии. В исследовании CARDS (Collaborative Atorvastatin Diabetes Study) сравнивали эффективность терапии аторвастатином 10 мг (n = 1410) с таковой плацебо (n = 1428) в отношении риска сердечно-сосудистых осложнений у пациентов с СД 2 типа без сердечно-сосудистых заболеваний [23]. Исходно средние значения (стандартное отклонение) HbA1c в группах аторвастатина и плацебо составляли 7,9% (1,4) и 7,8% (1,4) соответственно. Через четыре года терапии средние значения HbA1c достигли 8,3% (1,5) и 8,1% (1,5) в группах аторвастатина и плацебо. Эти результаты предполагают несколько большее повышение уровня HbA1c у пациентов, получавших терапию аторвастатином, но интерпретировать их следует с осторожностью. Данные об уровне HbA1c через четыре года были получены только для пациентов, завершивших исследование. Причем на результаты могли повлиять различная частота преждевременного прекращения участия в исследовании и изменения антидиабетической терапии.
В исследовании HPS (Heart Protective Study) сравнивали эффективность симвастатина 40 мг (n = 10 269) с таковой плацебо (n = 10 267) у пациентов высокого сердечно-сосудистого риска, 5963 из которых имели СД [24]. Исходный уровень HbA1c измеряли в случайной выборке пациентов с СД (n = 1087). Средние значения (стандартная ошибка среднего значения) HbA1c исходно составляли 6,99% (0,11) и 7,06% (0,06) в группе симвастатина и плацебо, через 4–6 лет наблюдения – 7,14% (0,06) и 7,17% (0,06) соответственно. Различий между группами симвастатина и плацебо в отношении уровня HbA1c не выявлено – 0,15% (0,09) и 0,12% (0,09).
Y. Zhou и соавт. выполнили метаанализ 26 РКИ (3232 пациента, период наблюдения от четырех недель до четырех лет), посвященных сравнению эффекивности терапии статинами с таковой плацебо или обычной практикой в отношении параметров контроля гликемии [25]. В целом не обнаружено существенного влияния терапии статинами на уровень HbA1c или концентрацию глюкозы плазмы натощак. Терапия аторвастатином ассоциировалась с умеренным повышением уровня HbA1c (средневзвешенные различия составили 0,20%; 95% ДИ 0,08–0,31). В то же время терапия симвастатином ассоциировалась с умеренным снижением уровня HbA1c (-0,26%; 95% ДИ -0,48–-0,04). Не установлено значимого влияния на уровень HbA1c при терапии ловастатином, розувастатином и церивастатином. Данные об эффективности питавастатина, правастатина, флувастатина отсутствуют.
Наиболее исчерпывающие данные о влиянии терапии статинами на уровень гликемии и HbA1c получены в исследовании JUPITER, хотя они относятся к пациентам без СД [7, 8]. Значимых различий между группами в динамике уровня глюкозы плазмы натощак не выявлено: среднее значение (стандартное отклонение) изменений составило 3 (18,3) мг/дл в группе розувастатина и 3 (17,3) мг/дл в группе плацебо. Однако повышение уровня HbA1c за период наблюдения оказалось достоверно (p < 0,001) более выраженным у пациентов, получавших розувастатин (0,30% [0,35]), по сравнению с пациентами группы плацебо (0,20% [0,40]). Причем такие различия имели место в течение каждых 12 месяцев наблюдения. Эти данные получены при post-hoc анализе, и многие влияющие факторы могли быть не учтены. Поэтому для окончательных выводов необходимы дополнительные исследования.
Итак, результаты выполненных РКИ не позволяют убедительно говорить об эффективности статинов в отношении контроля гликемии у пациентов с ранее диагностированным СД. Имеющиеся данные свидетельствуют о том, что, если и есть отрицательное влияние статинов на гликемию, то очень незначительное (среднее повышение 0,3%) и может быть нивелировано коррекцией антидиабетической терапии.
Каковы возможные механизмы развития СД на фоне терапии статинами?
Данные клинических исследований, посвященных изучению влияния терапии статинами на гомеостаз глюкозы с применением референсных методов, ограниченны. В метаанализе 16 исследований (n = 1146) W. Baker и соавт. оценивали влияние статинов на чувствительность к инсулину [26]. Пациенты получали терапию аторвастатином 10–40 мг/сут (пять исследований, n = 315), правастатином 10–40 мг/сут (три исследования, n = 164), розувастатином 10–40 мг/сут (пять исследований, n = 419), симвастатином (пять исследований, n = 369). Объединенный анализ не выявил значимого влияния статинов на чувствительность к инсулину. Однако результаты поданализов показали, что терапия правастатином ассоциировалась с умеренным улучшением чувствительности к инсулину (0,342 стандартное отклонение; 95% ДИ 0,032–0,651), симвастатином – с ухудшением (-0,321 стандартное отклонение; 95% ДИ -0,526–-0,177), терапия аторвастатином или розувастатином не приводила к существенным изменениям чувствительности к инсулину.
Следует отметить, что только в трех из 16 исследований, включенных в метаанализ, использовались референсные методы для оценки чувствительности к инсулину (гиперинсулинемический эугликемический клэмп и минимальная модель). В то же время в большинстве исследований применялись нечувствительные методики (определение глюкозы и инсулина натощак с вычислением индексов HOMA – homeostasis model assessment, QUICKI – quantitative insulin sensitivity check index).
В рандомизированном исследовании (с активным контролем), которое не было включено в метаанализ W. Baker и соавт., у 39 пациентов с инсулинорезистентностью и смешанной дислипидемией до и после трех месяцев лечения гемфиброзилом 1200 мг или розувастатином 40 мг оценивали чувствительность к инсулину с применением референсного метода (модифицированного теста подавления инсулина). Розувастатин не влиял на концентрацию глюкозы в устойчивом состоянии по сравнению с исходным (среднее изменение 1,61%; 95% ДИ -2,44–-5,67%) по сравнению с гемфиброзилом (среднее изменение 3,61%; 95% ДИ -0,44–7,66%) [27].
После метаанализа W. Baker опубликованы результаты еще нескольких исследований с противоречивыми результатами [28]. Однако только в одном из этих исследований использовали эугликемический клэмп для оценки чувствительности к инсулину. В нерандомизированном исследовании изучали чувствительность к инсулину у пациентов, получавших или не получавших терапию статинами (аторвастатином и розувастатином), во время проведения аортокоронарного шунтирования (по 60 пациентов в группе) [29]. Исходно средние значения (стандартное отклонение) чувствительности к инсулину в группе терапии статинами и контрольной группе не различались: 4,9 (1,8) и 5,2 (1,8) мг/кг/мин. В обеих группах значения чувствительности к инсулину снизились во время оперативного вмешательства. Причем значения в группе статинов были на 20% ниже, чем в контрольной группе: 2,9 (1,3) и 3,7 (1,5) мг/кг/мин, p < 0,05.
Данных клинических исследований с применением референсных методов, оценивающих влияние статинов на функцию бета-клеток поджелудочной железы или продукцию глюкозы печенью, нет.
На основании анализа результатов экспериментальных исследований и исследований с культурами клеток предложены различные гипотезы, которые могли бы объяснить связь терапии статинами с развитием СД [30–32], однако клиническое значение этих клеточных механизмов остается неопределенным.
- Дисрегуляция клеточного ХС приводит к нарушенной секреции инсулина, вызванной нарушением функционирования потенциалзависимых кальциевых каналов в бета-клетках поджелудочной железы. В результате уменьшается слияние гранул инсулина с клеточной мембраной.
- Нарушение функции митохондрий в миоцитах, адипоцитах, бета-клетках поджелудочной железы приводит к снижению секреции инсулина и увеличению периферической инсулинорезистентности.
- Сниженная экспрессия транспортера глюкозы в адипоцитах (GLUT4) способствует увеличению периферической инсулинорезистентности.
- Индукция мышечной слабости в условиях сниженной физической активности приводит к снижению расхода энергии.
- Сохранение саркопении (атрофии скелетных мышц) при старении приводит к повышению периферической инсулинорезистентности.
Какой должна быть тактика врача при развитии СД у пациента, получающего терапию статинами?
Сахарный диабет является эквивалентом коронарной болезни сердца по сердечно-сосудистому риску и требует соответствующих терапевтических вмешательств, в том числе лечения статинами. Существуют убедительные доказательства, что терапия статинами ассоциируется со снижением риска сердечно-сосудистых осложнений у пациентов с СД 2 типа. Метаанализ CTT включал 18 686 пациентов с СД из 14 РКИ по первичной и вторичной сердечно-сосудистой профилактике, большинство из которых имело СД 2 типа (n = 17 220) [33]. За средний период наблюдения 4,3 года зарегистрировано 3247 основных сердечно-сосудистых осложнений (несмертельный инфаркт миокарда, инсульт, коронарная смерть и коронарная реваскуляризация). Терапия статинами ассоциировалась со снижением риска основных сердечно-сосудистых осложнений на 21% при снижении ХС ЛПНП на 1 ммоль/л (ОР 0,79; 95% ДИ 0,72–0,86). Уменьшение риска сердечно-сосудистых осложнений у пациентов с СД и без него сопоставимо. В целом у пациентов с СД статины снижают уровень ХС ЛПНП на 22–40%, что сопровождается существенным уменьшением десятилетнего риска сердечно-сосудистых осложнений.
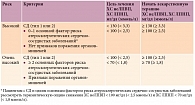
Действующие национальные и европейские рекомендации по дислипидемии, СД предполагают назначение статинов пациентам с СД по диагнозу с достижением целевого уровня ХС ЛПНП < 1,8 или < 2,5 ммоль/л в зависимости от наличия очень высокого/высокого риска (табл. 3) [1, 2, 21].
В рекомендациях Национальной липидной ассоциации США (National Lipid Association – NLA) уточнены критерии СД 2 типа высокого и очень высокого риска в зависимости от наличия основных факторов риска атеросклеротических сердечно-сосудистых заболеваний и поражения органов-мишеней, а также обозначена новая первичная цель терапии – атерогенный ХС неЛПВП (наряду с ХС ЛПНП) (табл. 4) [34].
К основным факторам риска атеросклеротических сердечно-сосудистых заболеваний относятся [34]:
1) возраст (мужчины и женщины ≥ 45 лет);
2) семейный анамнез ранней коронарной болезни сердца:
- у мужчин (родственников первой линии) в возрасте младше 55 лет;
- у женщин (родственников первой линии) в возрасте младше 65 лет;
3) курение в настоящее время;
4) артериальная гипертония (артериальное давление ≥ 140/90 мм рт. ст. или антигипертензивная терапия);
5) низкий уровень ХС ЛПВП:
- мужчины < 40 мг/дл (< 1,0 ммоль/л);
- женщины < 50 мг/дл (< 1,3 ммоль/л).
О поражении органов-мишеней свидетельствуют альбуминурия (альбумин/креатинин в моче ≥ 30 мг/дл), хроническая болезнь почек, ретинопатия [34].
При отсутствии противопоказаний первым выбором является терапия статинами высокой или умеренной интенсивности (табл. 5). Терапия статинами умеренной интенсивности приводит к снижению уровня ХС ЛПНП на 30–50%, а высокой интенсивности – к снижению ХС ЛПНП ≥ 50%, хотя межиндивидуальные различия могут быть существенно выражены [34].
Заключение
Терапия статинами ассоциирована с повышенным риском развития СД. Диабетогенный эффект статинов является класс-эффектом и дозозависимым эффектом. Наибольшему риску СД, ассоциированному с терапией статинами, подвержены особые группы пациентов – женщины, пожилые, азиаты, имеющие повышенный уровень глюкозы плазмы и триглицеридов натощак, ИМТ > 30 кг/м2. Таким пациентам до начала и во время терапии статинами целесообразно проводить скрининговые обследования на выявление СД в соответствии с действующими рекомендациями.
Точные механизмы развития СД на фоне терапии статинами пока не установлены. Поскольку во всех группах пациентов польза статинов в отношении снижения риска сердечно-сосудистых осложнений существенно превышает риск развития новых случаев СД, тактика назначения статинов не должна изменяться.