Вертеброгенная пояснично-крестцовая радикулопатия: современные подходы к диагностике и лечению
- Аннотация
- Статья
- Ссылки
- English
![Рисунок. Грыжи межпозвонковых дисков: срединные (А), парамедианные (Б), латеральные (В) [10]](/upload/resize_cache/iblock/5e6/195_350_1/levin_pic.jpg)

Эпидемиология
Пояснично-крестцовая радикулопатия – один из наиболее тяжелых вариантов вертеброгенных болевых синдромов, который характеризуется особенно интенсивной и стойкой болью, обычно сопровождающейся резким ограничением подвижности [1, 2].
Пояснично-крестцовая радикулопатия возникает примерно у 3–5% лиц в популяции. Заболеваемость мужчин и женщин примерно равна, однако ее пик у мужчин приходится на возраст от 40 до 50 лет, а у женщин – от 50 до 60 лет. Риск развития вертеброгенной радикулопатии повышен у лиц, занимающихся тяжелым физическим трудом, курящих, имеющих отягощенный семейный анамнез. Регулярная физическая активность может снижать риск радикулопатии, но у тех, кто начал заниматься ею после эпизода дискогенной боли в спине, риск может повышаться [3–8].
Хотя на долю радикулопатии приходится около 5% случаев боли в спине, именно она является наиболее частой причиной стойкой утраты трудоспособности. Острая боль в спине (при включении всех ее вариантов) самостоятельно проходит в течение шести недель у 90% пациентов. Между тем не менее чем у 30% пациентов с радикулопатией боль сохраняется дольше этого срока [4, 9].
Этиология
Самой частой причиной пояснично-крестцовой радикулопатии является грыжа межпозвонкового диска. У пациентов молодого возраста ввиду более высокого внутридискового давления пульпозное ядро легче проникает между поврежденными волокнами фиброзного кольца, что обусловливает частое развитие дискогенной радикулопатии в этой возрастной категории. Грыжи межпозвонковых дисков, способные компримировать корешок, условно подразделяются на три типа (рисунок):
1) латеральные (смещаются в сторону межпозвонкового отверстия);
2) парамедианные (медиолатеральные);
3) срединные [2, 5, 10, 11].
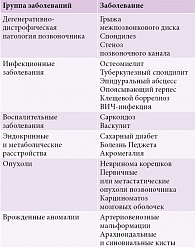
У пожилых людей радикулопатия чаще вызвана сдавлением корешка в области латерального кармана или межпозвонкового отверстия вследствие формирования остеофитов, гипертрофии суставных фасеток, связок или иных факторов. Опухоли, инфекции, дисметаболические спондилопатии в совокупности объясняют не более 1% случаев радикулопатии [3, 4, 11, 12]. Причины пояснично-крестцовой радикулопатии приведены в табл. 1.
Патогенез
В инициации боли при грыже диска решающую роль может играть механическая компрессия корешка и/или спинномозгового ганглия. Однако стойкое поддержание интенсивного болевого синдрома связано не столько с механическими факторами, сколько с вторичными токсическими, дизиммунными и дисметаболическими процессами, которые запускаются внедрением диска в эпидуральное пространство и воздействием материала, высвобождаемого из пульпозного ядра [13–15].
По данным клинико-нейровизуализационных сопоставлений, интенсивность боли не коррелирует со степенью протрузии диска или механической деформацией корешка [16]. Экспериментальные данные показывают, что ключевую роль в развитии корешковой боли могут играть воспалительные изменения в компримированном корешке и особенно в соответствующем спинномозговом ганглии, связанные с выделением фосфолипазы A2, оксида азота, простагландина E2, фактора некроза опухоли альфа, интерлейкинов и т.д. Эти вещества могут продуцироваться клетками диска и воздействовать на корешок при условии тесного контакта между ними.
Воспалительные процессы может запускать иммунная реакция, в свою очередь инициируемая контактом двух чужеродных тканей (диска и периневральной ткани), которые в норме не соприкасаются друг с другом. В результате это ведет к ирритации нервных волокон, нарушению микроциркуляции, интра- и экстраневральному отеку, изменению нейрофизиологических характеристик корешка или блокаде проведения по нему, аксональной дегенерации и повреждению шванновских клеток [16–18]. Кроме того, нервные волокна корешков могут становиться более сенсибилизированными к давлению. В любом случае именно воспалительными процессами при компрессионной радикулопатии вследствие грыжи диска можно объяснить эффективность эпидурального введения кортикостероидов. Корешковый синдром часто сопровождается формированием на периферии (в мышцах ягодицы, бедра, голени) болезненных и триггерных точек, которые могут играть самостоятельную роль в поддержании болевого синдрома и, следовательно, требовать инактивации при лечении [12].
Болевой синдром при вертеброгенной радикулопатии носит смешанный характер. Ноцицептивный механизм связан с раздражением ноцицепторов в наружных слоях поврежденного диска и окружающих его тканях, в том числе твердой мозговой оболочке, а также в спазмированных мышцах. Невропатический компонент болевого синдрома связан с повреждением и ирритацией нервных волокон корешка вследствие его компрессии, воспаления, отека, ишемии, демиелинизации и аксональной дегенерации. Хронически протекающая радикулопатия обычно сопровождается также психогенным компонентом болевого синдрома, роль которого в хронизации боли исключительно велика [19, 20].
Клиническая картина
Клинически пояснично-крестцовая радикулопатия характеризуется остро или подостро развивающейся пароксизмальной (стреляющей или пронизывающей) или постоянной интенсивной болью, которая хотя бы эпизодически (например, при приеме Ласега) иррадиирует в дистальную зону дерматома (корешковый болевой синдром, или радикулалгия). Боль в ноге обычно сопровождается болью в пояснице, но пациенты молодого возраста могут испытывать боль только в ноге.
Боль может развиться внезапно после резкого неподготовленного движения, подъема тяжести или падения. В анамнезе у таких пациентов часто бывают указания на повторные эпизоды рефлекторной боли (люмбалгии или люмбоишиалгии). Поначалу боль может быть тупой, ноющей, но она постепенно нарастает, реже сразу достигает максимальной интенсивности. Если радикулопатия вызвана грыжей диска, боль, как правило, усиливается при движении, натуживании, подъеме тяжести, сидении в глубоком кресле, длительном пребывании в одной позе, кашле и чихании, надавливании на яремные вены и ослабевает в покое, особенно если больной лежит на здоровом боку, согнув больную ногу в коленном и тазобедренном суставах.
При осмотре спина часто фиксирована в согнутом положении. Нередко выявляется сколиоз, усиливающийся при наклоне кпереди, но пропадающий в положении лежа. Он чаще всего обусловлен сокращением квадратной мышцы поясницы. При латеральной грыже сколиоз направлен в здоровую сторону, при парамедианной – в больную. Наклон кпереди резко ограничен и осуществляется лишь за счет тазобедренного сустава. Резко ограничен и наклон в больную сторону. Отмечается выраженное напряжение паравертебральных мышц, уменьшающееся в положении лежа.
Характерны нарушение болевой, температурной, вибрационной и другой чувствительности (в том числе в виде парестезий, гипер- или гипоалгезии, аллодинии, гиперпатии) в соответствующем дерматоме, снижение или выпадение сухожильных рефлексов, замыкающихся через соответствующий сегмент спинного мозга, гипотония и слабость мышц, иннервируемых данным корешком (табл. 2). Поскольку в поясничном отделе позвоночника примерно в 90% случаев грыжа диска локализуется на уровнях L4–L5 и L5–S1, в клинической практике чаще всего выявляется радикулопатия L5 (около 60% случаев) или S1 (около 30% случаев). У пожилых людей грыжи межпозвонковых дисков чаще развиваются на более высоком уровне, в связи с чем у них нередки радикулопатии L4 и L3 [5, 6, 8, 11].
Связь между пораженным корешком и локализацией грыжи зависит не только от уровня грыжи диска, но и от направления выпячивания. Грыжи поясничных дисков обычно бывают парамедианными и оказывают давление на корешок, выходящий через межпозвонковое отверстие на один уровень ниже. Например, при грыже диска L4–L5, как правило, страдает корешок L5. Однако если грыжа того же диска будет направлена более латерально (в сторону корешкового канала), то вызовет сдавление корешка L4. Если же она будет направлена более медиально, то может приводить к сдавлению корешка S1 (рис. 1). Одновременное вовлечение двух корешков с одной стороны при грыже одного диска – редкое явление, чаще оно отмечается при грыже диска L4–L5 (в этом случае страдают корешки L5 и S1).
Типично наличие симптомов натяжения, прежде всего симптома Ласега, однако данный симптом не специфичен для радикулопатии. Вместе с тем он пригоден для оценки тяжести и динамики вертеброгенного болевого синдрома. Симптом Ласега выявляют, медленно (!) поднимая прямую ногу больного вверх, ожидая воспроизведения корешковой иррадиации боли. При вовлечении корешков L5 и S1 боль возникает или резко усиливается при подъеме ноги до 30–40°, а при последующем сгибании ноги в коленном и тазобедренном суставах она проходит (в противном случае она может быть обусловлена патологией тазобедренного сустава или имеет психогенный характер).
При выполнении приема Ласега боль в пояснице и ноге может возникать также при напряжении паравертебральных мышц или задних мышц бедра и голени. Чтобы подтвердить корешковую природу симптома Ласега, ногу поднимают до предела, выше которого возникает боль, а затем форсированно сгибают стопу в голеностопном суставе, что при радикулопатии вызывает корешковую иррадиацию боли. Иногда при медиальной грыже диска наблюдается перекрестный симптом Ласега, когда боль в пояснице и ноге провоцируется поднятием здоровой ноги. При вовлечении корешка L4 возможен «передний» симптом натяжения – симптом Вассермана. О его наличии можно говорить при появлении резкой боли в паховой области и по передней поверхности бедра у больного, лежащего на животе, когда врач поднимает прямую ногу пациента вверх, разгибает бедро в тазобедренном суставе либо сгибает ногу в коленном суставе.
При компрессии корешка в корешковом канале (вследствие латеральной грыжи, гипертрофии суставной фасетки или формирования остеофитов) боль часто развивается медленнее, постепенно приобретая корешковую иррадиацию (ягодица – бедро – голень – стопа), нередко сохраняется в покое, нарастает при ходьбе и пребывании в вертикальном положении, но в отличие от грыжи диска облегчается при сидении. Она не усиливается при кашле и чихании. Симптомы натяжения, как правило, не так выражены. Наклоны вперед ограничены меньше, чем при срединной или парамедианной грыже диска, а болевые ощущения в большей степени провоцируются разгибанием и ротацией. Часто наблюдаются парестезии, реже – снижение чувствительности или мышечная слабость.
Слабость мышц при дискогенных радикулопатиях обычно бывает легкой. Но иногда на фоне резкого усиления корешковых болей может остро возникать выраженный парез стопы (парализующий ишиас). Развитие данного синдрома связывают с ишемией корешков L5 или S1, вызванной сдавлением питающих корешок сосудов (радикулоишемия). В большинстве случаев парез благополучно регрессирует в течение нескольких недель.
Острый двусторонний корешковый синдром (синдром конского хвоста) возникает редко, обычно вследствие массивной срединной (центральной) грыжи нижнепоясничного диска. Синдром проявляется быстро нарастающими двусторонними асимметричными болями в ногах, онемением и гипестезией промежности, нижним вялым парапарезом, задержкой мочеиспускания, недержанием кала. Эта клиническая ситуация требует неотложной консультации нейрохирурга.
Диагностика
Диагноз радикулопатии устанавливается прежде всего на основе характерных клинических признаков. Наличие грыжи диска, стеноза корешкового канала на соответствующем уровне или иной причины компрессии корешка может быть установлено при помощи компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ). Однако при интерпретации данных визуализации важно учитывать, что примерно у 2/3 лиц, никогда не испытывавших боли в спине, эти методы исследования выявляют те или иные изменения в пояснично-крестцовом отделе позвоночника, нередко на нескольких уровнях. В частности, у половины из этих лиц определяется равномерное симметричное выпячивание диска, у четверти – фокальное или асимметричное выпячивание, нередко обнаруживаются также стеноз позвоночного канала, артропатия фасеточных суставов. С радикулопатией четко коррелирует лишь экструзия диска, под которой понимают крайнюю степень его выпячивания, когда длина выпячивания превышает ширину его основания [3–5, 8, 11].
Экстренное проведение КТ или МРТ показано при наличии симптомов компрессии корешков конского хвоста или вовлечения спинного мозга, а также при подозрении на инфекционное, опухолевое, воспалительное поражение позвоночника. При отсутствии признаков потенциально опасных состояний КТ или МРТ целесообразно проводить при сохранении выраженного болевого синдрома на четвертой – шестой неделе при решении вопроса о целесообразности оперативного лечения.
Данные электронейрографии редко имеют практическую значимость при вертеброгенной радикулопатии, но иногда важны в дифференциальной диагностике с поражением периферического нерва или сплетения. Скорость проведения возбуждения по двигательным волокнам у пациентов с радикулопатией обычно остается нормальной даже при выявлении слабости в пораженном миотоме, так как только часть волокон в пределах нерва оказывается поврежденной. Если поражено более 50% двигательных аксонов, отмечается снижение амплитуды М-ответа в мышцах, иннервируемых пораженным корешком. Для вертеброгенной радикулопатии особенно характерно отсутствие F-волн при нормальной амплитуде М-ответа с соответствующей мышцы. Скорость проведения по чувствительным волокнам при радикулопатии также остается нормальной, поскольку поражение корешка (в отличие от поражения нерва или сплетения) обычно происходит проксимальнее спинномозгового ганглия. Исключение составляет радикулопатия L5. Примерно в половине случаев спинномозговой ганглий пятого поясничного корешка располагается в спинномозговом канале и может поражаться при грыже диска, что вызывает антероградную дегенерацию аксонов спинномозговых клеток. В этом случае при стимуляции поверхностного малоберцового нерва может отсутствовать S-ответ. При игольчатой электромиографии можно выявить признаки денервации и реиннервации в мышцах, иннервируемых одним корешком. Исследование паравертебральных мышц помогает исключить плексопатию и невропатию [21].
По показаниям проводят рентгенографию легких, ультразвуковое исследование органов брюшной полости и малого таза, забрюшинного пространства, экскреторную урографию, ректороманоскопию. У женщин обязателен осмотр гинеколога. Комплексное обследование может включать также клинический анализ крови и общий анализ мочи, определение содержания сахара, электролитов, азота мочевины, креатинина, кальция, фосфора, мочевой кислоты, электрофорез белков сыворотки. У мужчин измеряют уровень простатического специфического антигена.
Со временем в большинстве случаев размеры грыжи диска и признаки компрессии корешка спонтанно уменьшаются, независимо от применяемого метода консервативного лечения и возраста. Подавляющее большинство пациентов с пояснично-крестцовой радикулопатией выздоравливает в течение трех месяцев. Тем не менее у некоторой части пациентов восстановление происходит в течение более длительного срока (три – шесть месяцев). Если обострение длится более шести месяцев (около 15% пациентов), можно прогнозировать сохранение клинических проявлений как минимум в течение ближайших двух лет. Прогноз хуже при компрессии корешка в корешковом канале. Прогностически благоприятными факторами являются отсутствие выраженных симптомов натяжения, стеноза позвоночного канала при КТ или МРТ, активное участие пациента в реабилитационных программах, отсутствие выраженных психоэмоциональных нарушений и рентной установки [2, 4, 6, 11, 20, 22].
Принципы лечения
У большинства пациентов с дискогенной пояснично-крестцовой радикулопатией на фоне консервативной терапии удается достичь существенного ослабления и регресса болевого синдрома. Основой консервативной терапии радикулопатии, как и других видов боли в спине, являются нестероидные противовоспалительные средства (НПВС), которые должны применяться с первых часов развития заболевания, лучше парентерально. При интенсивных болях возможно использование трамадола в дозе до 300 мг/сут. Облигатным компонентом лечения должен быть короткий (7–14 дней) курс миорелаксантов (например, тизанидина или толперазона) [2, 23].
Кортикостероиды – наиболее эффективное средство подавления воспалительной реакции, при этом предпочтительнее их эпидуральное введение, создающее более высокую локальную концентрацию. Применение кортикостероидов вызывает существенное ослабление болевого синдрома, хотя, по-видимому, не влияет на отдаленный исход радикулопатии. Эффективность кортикостероидов выше при длительности обострения менее трех месяцев.
Вводить кортикостероиды можно на уровне пораженного сегмента (трансламинарным или трансфораминальным способом), что наиболее предпочтительно, либо через крестцово-копчиковое или первое крестцовое отверстие. Трансламинарный доступ, при котором игла вводится через паравертебральные мышцы (при парамедианном доступе) или межостистую связку (при срединном доступе), более безопасен, чем трасфораминальный доступ, при котором игла вводится через межпозвонковое отверстие. Эпидурально рекомендуется вводить кортикостероиды, образующие депо в месте введения, например суспензию гидрокортизона (100 мг), пролонгированный препарат метилпреднизолона – Депо-Медрол (40 мг) или Дипроспан. Кортикостероид вводят в одном шприце с местным анестетиком (например, с 0,5%-ным раствором новокаина). Объем раствора, вводимого интерламинарно, обычно составляет до 10 мл, трансфораминально – до 4 мл, в крестцово-копчиковое и первое крестцовое отверстие – до 20 мл. В зависимости от эффективности повторные инъекции проводятся с интервалом в несколько дней или недель [24]. При наличии сопутствующего миофасциального синдрома свой вклад в купирование боли могут внести блокада болезненных точек и инактивация триггерных точек. Нет достаточных оснований для применения при вертеброгенной радикулопатии диуретиков или вазоактивных препаратов. Тем не менее допустимо назначение пентоксифиллина с учетом его способности оказывать тормозящее действие на продукцию фактора некроза опухоли альфа [25].
Учитывая смешанный характер болевого синдрома, представляется перспективным воздействие не только на ноцицептивный, но и на невропатический компонент боли [26]. Тем не менее до сих пор эффективность средств, традиционно применяемых при невропатической боли, прежде всего антидепрессантов и антиконвульсантов, остается недостаточно доказанной. Лишь в единичных небольших исследованиях показано положительное влияние габапентина, топирамата, ламотриджина [22, 27–29]. Эти средства были эффективны при раннем начале их применения. Положительный эффект может быть получен и при местном применении пластыря с лидокаином.
Постельный режим часто неизбежен в остром периоде, но должен быть по возможности сведен к минимуму. При радикулопатии, как и при других вариантах боли в спине, более быстрое возвращение к повседневной активности может быть фактором, предупреждающим хронизацию боли [12]. При улучшении состояния начинают проводить лечебную гимнастику, физиотерапевтические процедуры и приемы щадящей мануальной терапии, направленные на мобилизацию и релаксацию мышц, что может способствовать увеличению подвижности в позвоночнике. Давно известная и до сих пор популярная тракция поясничного отдела оказалась неэффективной в контролируемых исследованиях [2]. Более того, в ряде случаев она провоцирует ухудшение, так как вызывает растяжение не пораженного заблокированного сегмента (и соответственно декомпрессию корешка), а выше и ниже расположенных сегментов.
Абсолютным показанием к оперативному лечению является сдавление корешков конского хвоста с парезом стопы, анестезией аногенитальной области, нарушением функций тазовых органов. Операция также необходима при нарастании неврологических симптомов, например слабости мышц. Что касается других случаев, то вопросы о целесообразности, оптимальном времени и оптимальном методе оперативного лечения остаются предметом дискуссии.
Недавние масштабные исследования показали, что хотя раннее оперативное лечение несомненно приводит к более быстрому ослаблению боли, спустя полгода, год и два года оно не имеет преимуществ по основным показателям болевого синдрома и степени инвалидизации перед консервативной терапией и не снижает риск хронизации боли [30, 31]. Кроме того, выяснилось, что сроки проведения оперативного вмешательства в целом не влияют на результат. В этой связи в неосложненных случаях вертеброгенной радикулопатии решение вопроса об оперативном лечении может быть отсрочено на шесть – восемь недель, в течение которых должна проводиться адекватная (!) консервативная терапия. Сохранение интенсивности корешкового болевого синдрома, резкое ограничение подвижности, резистентность к консервативным мероприятиям в эти сроки могут быть показаниями к оперативному вмешательству.
В последние годы наряду с традиционной дискэктомией применяют более щадящие методики оперативного вмешательства, такие как микродискэктомия, лазерная декомпрессия (вапоризация) межпозвонкового диска, высокочастотная аблация диска [32–34]. Например, лазерная вапоризация потенциально эффективна при радикулопатии, связанной с грыжей межпозвонкового диска при сохранении целостности фиброзного кольца, выбуханием его не более чем на треть сагиттального размера позвоночного канала (около 6 мм) и при отсутствии у пациента двигательных расстройств или симптомов компрессии корешков конского хвоста. Малоинвазивность вмешательства расширяет круг показаний к нему. Тем не менее остается неизменным принцип, что оперативному вмешательству должна предшествовать оптимальная консервативная терапия в течение не менее шести недель.
Применение комплекса витаминов группы В
Одним из потенциальных резервов повышения эффективности консервативной терапии радикулопатии может быть применение витаминов группы В. Антиноцицептивный и противовоспалительный эффекты витаминов группы В подтверждены экспериментально на моделях химически и термически индуцируемой боли [35]. Установлено, что витамин В1 самостоятельно или в комбинации с витаминами В6 и В12 способен тормозить прохождение болевой импульсации на уровне задних рогов и таламуса [36]. Экспериментально обнаружено также, что комплекс витаминов группы В усиливает действие норадреналина и серотонина – главных антиноцицептивных нейромедиаторов. Кроме того, за счет повышения синтеза протеинов под действием витаминов группы В могут создаваться условия для более успешной регенерации нервных волокон [37]. Выдвинуто также предположение, что антиноцицептивный эффект комбинированного витаминного комплекса может быть обусловлен ингибированием синтеза и/или блокированием действия воспалительных медиаторов [38]. На лабораторных моделях боли показано, что витамины группы В способны потенцировать эффекты анальгетиков, что снижает необходимые для адекватного обезболивания дозы и длительность введения НПВС и делает лечение более безопасным [38].
Вместе с тем результаты клинических испытаний витаминов группы В при вертеброгенных болевых синдромах противоречивы. В одних исследованиях получен несомненный положительный эффект, выражающийся в более быстром купировании боли и усилении обезболивающего эффекта НПВС [39, 40]. В других работах достоверных подтверждений эффективности витаминов группы В отмечено не было [41]. Одним из факторов, объясняющих противоречивость результатов, является гетерогенность групп, на которых испытывался препарат: в них, как правило, включались пациенты с разными вариантами боли в спине. Другой недостаток проведенных исследований – их кратковременность. Таким образом, вопрос о том, влияет ли прием витаминов на долгосрочный исход радикулопатии, пока не решен.
В этой связи мы провели исследование эффективности комплекса витаминов группы В (в форме препарата Мильгамма, производитель «Вёрваг Фарма», Германия) у относительно гомогенной группы пациентов с дискогенной пояснично-крестцовой радикулопатией [42]. Данная группа пациентов была выбрана исходя из наличия невропатического компонента боли, при котором витамины группы В, как свидетельствуют экспериментальные данные, могут быть особенно эффективными. Исследование носило проспективный характер и позволяло оценить как краткосрочный, так и долгосрочный эффект препарата.
В исследование включались пациенты с умеренной или выраженной болью (оценка по десятибалльной визуальной аналоговой шкале была не менее 4 баллов) с длительностью обострения не менее одного месяца. 38 пациентов были разделены на две группы: в одной была назначена комбинация «Мильгамма + НПВС (диклофенак)», а в другой проводилась только терапия диклофенаком. Между группами не было достоверных различий по возрасту, полу, длительности заболевания, длительности обострения, интенсивности болевого синдрома.
В первой группе в течение десяти дней Мильгамма вводилась внутримышечно по одной ампуле ежедневно (в одной ампуле содержатся 100 мг тиамина гидрохлорида, 100 мг пиридоксина гидрохлорида, 1000 мкг цианокобаламина и 20 мг лидокаина). Далее пациенты переходили на пероральный прием витаминов группы B – по одному драже Мильгаммы композитум (одно драже содержит 100 мг бенфотиамина и 100 мг пиридоксина) три раза в день в течение 14 дней. Одновременно пациентам был назначен диклофенак, который в первые десять дней вводился в/м в фиксированной дозе (75 мг/сут), а далее назначался внутрь по потребности. Во второй группе лечение ограничивалось применением диклофенака, который в первые десять дней также вводился в/м в фиксированной дозе (75 мг/сут), а далее назначался внутрь по потребности. Физиотерапевтические методы, рефлексотерапия, массаж или мануальная терапия в первые 24 дня исследования не проводились. Состояние пациентов оценивалось на десятый и 24-й дни с помощью шкалы общего клинического впечатления, шкалы боли в спине, шкалы вертебрального синдрома, шкалы невропатической боли. Кроме того, через три и шесть месяцев проводилось телефонное интервью с помощью специально разработанного опросника.
К концу первой фазы исследования (24-й день) отмечены достоверные различия в пользу комбинации Мильгаммы с диклофенаком. Снижение суммарной оценки по шкале боли в спине по сравнению с исходным уровнем при комбинированной терапии составило 49 против 43% в группе сравнения, в которой вводился только диклофенак. На фоне комбинированной терапии отмечено более быстрое снижение по следующим пунктам шкалы боли в спине: спонтанная боль в ногах, ограничение способности к передвижению и повседневная активность. Только на фоне комбинированной терапии достоверно уменьшились по сравнению с исходным уровнем такие характеристики боли, как интенсивность, острота, повысилась ее переносимость. Кроме того, отмечено более значительное увеличение угла подъема выпрямленной ноги, а также способности удерживать на весу обе ноги.
По данным шкалы общего клинического впечатления на фоне применения комбинированной терапии значительный эффект отмечен у 25% пациентов (против 10% в группе сравнения), удовлетворительный (умеренный) эффект – у 41% пациентов (против 24%), минимальное улучшение – у 17% (против 41%), отсутствие улучшения – у 17% (против 25% в группе сравнения). На эффективность терапии не влияли возраст, исходная интенсивность и длительность боли, наличие симптомов выпадения, выраженность вертебрального синдрома.
Как показало телефонное интервью, спустя три месяца болевой синдром в пояснице и/или ноге отсутствовал или расценивался как минимальный у 63% пациентов, которым проводилась комбинированная терапия, и у 50% пациентов, получавших только диклофенак. У 19% пациентов первой группы и 36% пациентов второй группы сохранялись выраженный болевой синдром и ограничение двигательной активности. Трем пациентам первой группы и двум пациентам второй группы в связи со стойким интенсивным болевым синдромом проведено оперативное вмешательство. Опрос пациентов через шесть месяцев не выявил достоверных различий между группами ни по частоте, ни по средней интенсивности основных клинических проявлений радикулопатии. В ходе исследования отмечена высокая безопасность Мильгаммы.
Полученные результаты свидетельствуют о том, что комплекс витаминов группы В (в составе препарата Мильгамма) может потенцировать обезболивающий эффект НПВС и способствовать более быстрому регрессу болевого синдрома при вертеброгенной радикулопатии, эффективно воздействуя на невропатический компонент боли. При этом проведение после десятидневного курса Мильгаммы (внутримышечно) 14-дневного курса перорального приема драже Мильгамма композитум может способствовать более полному проявлению терапевтического потенциала препарата не только в краткосрочной, но и в среднесрочной перспективе. Таким образом, включение комплекса витаминов группы В в виде препарата Мильгамма может повышать эффективность консервативной терапии радикулопатии.
O.S. Levin
Russian Medical Academy of Postgraduate Education
Contact person: Oleg Semyonovich Levin, oslevin@mail.ru
Epidemiological data, mechanisms of development, diagnostic and curative methods of vertebrogenic lumbosacral radiculopathy are presented in the paper. Opportunities for tresatment of this disease are considered based on the clinical study evaluating long-term efficacy of combined drugs containing group B vitamins. It is noted that group B vitamins may potentiate analgesic effect of non-steroid anti-inflammatory drugs and contribute to faster regression of pain syndrome by effectively acting on neuropathic component
of the pain sensation, thereby increasing efficacy of conservative therapy.

