Влияние полиморфизма гена FC-фрагмента рецептора II IgE (FCER2) на эффективность противовоспалительной терапии у пациентов детского возраста с бронхиальной астмой
- Аннотация
- Статья
- Ссылки
- English
Цель – ассоциативный анализ влияния полиморфизма гена FC-фрагмента рецептора II IgE (FCER2) на эффективность терапии БА у пациентов детского возраста для определения вероятных путей обоснования и оптимизации подбора персонифицированного алгоритма терапии.
Материалы и методы. Исследование проведено на базе городской детской клинической больницы г. Уфы с участием 82 детей в возрасте от 12 лет до 17 лет 11 месяцев с верифицированным диагнозом «бронхиальная астма». В ходе исследования всем детям проведена динамическая оценка контроля симптомов заболевания и объема поддерживающей терапии и ее ступени. У всех пациентов оценивали генотипирование на предмет изучения полиморфизма rs28364072 (Т2206С) гена низкоаффинного FC-фрагмента рецептора II IgE (FCER2) методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) с последующей интерпретацией полученных результатов.
Результаты. Установлено, что 24 (29%) пациента с БА, включенных в исследование, были гетерозиготами по полиморфному маркеру FCER2 (Т2206С), а остальные 58 (71%) пациентов являлись гомозиготами и обладали генотипом СС. У 19 из 24 пациентов с генотипом ТС гена FCER2 (Т2206С) объем поддерживающей и контролирующей терапии симптомов БА соответствовал третьей и четвертой ступеням терапии согласно Федеральным клиническим рекомендациям «Бронхиальная астма» (2021).
Заключение. Генотип ТС и присутствие аллеля С (ген FCER2 (Т2206С)) ассоциированы с повышенным содержанием IgE, отсутствием контроля над заболеванием, что приводит к увеличению объема поддерживающей (базисной) терапии за счет повышения дозы ИГКС и использования фиксированной комбинации с ДДБА в режиме единого ингалятора.
Цель – ассоциативный анализ влияния полиморфизма гена FC-фрагмента рецептора II IgE (FCER2) на эффективность терапии БА у пациентов детского возраста для определения вероятных путей обоснования и оптимизации подбора персонифицированного алгоритма терапии.
Материалы и методы. Исследование проведено на базе городской детской клинической больницы г. Уфы с участием 82 детей в возрасте от 12 лет до 17 лет 11 месяцев с верифицированным диагнозом «бронхиальная астма». В ходе исследования всем детям проведена динамическая оценка контроля симптомов заболевания и объема поддерживающей терапии и ее ступени. У всех пациентов оценивали генотипирование на предмет изучения полиморфизма rs28364072 (Т2206С) гена низкоаффинного FC-фрагмента рецептора II IgE (FCER2) методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) с последующей интерпретацией полученных результатов.
Результаты. Установлено, что 24 (29%) пациента с БА, включенных в исследование, были гетерозиготами по полиморфному маркеру FCER2 (Т2206С), а остальные 58 (71%) пациентов являлись гомозиготами и обладали генотипом СС. У 19 из 24 пациентов с генотипом ТС гена FCER2 (Т2206С) объем поддерживающей и контролирующей терапии симптомов БА соответствовал третьей и четвертой ступеням терапии согласно Федеральным клиническим рекомендациям «Бронхиальная астма» (2021).
Заключение. Генотип ТС и присутствие аллеля С (ген FCER2 (Т2206С)) ассоциированы с повышенным содержанием IgE, отсутствием контроля над заболеванием, что приводит к увеличению объема поддерживающей (базисной) терапии за счет повышения дозы ИГКС и использования фиксированной комбинации с ДДБА в режиме единого ингалятора.

Введение
Бронхиальная астма (БА) относится к числу наиболее распространенных в мире заболеваний. Число пациентов, страдающих БА, продолжает расти и колеблется в диапазоне от 1 до 21% у взрослых, до 20% в возрасте 13–14 лет и 16,5% у детей 6–7 лет, что делает данную патологию серьезной и масштабной социально-экономической проблемой общественного здравоохранения. Согласно результатам систематического анализа, БА является наиболее распространенным хроническим заболеванием респираторной системы, которым, по имеющимся эпидемиологическим данным Всемирной организации здравоохранения (ВОЗ), страдают около 358 млн жителей планеты, и не исключено, что число больных БА к 2025 г. увеличится еще на 100 млн [1–3].
На сегодняшний день достигнут существенный прогресс по ведению пациентов с БА, что стало возможным благодаря доступности специализированной медицинской помощи и лекарственной терапии, проведению своевременной верификации и постановки диагноза, наличию и реализации регламентирующих документов, основанных на системе данных доказательной медицины, результатах научных и фармакоэкономических исследований, практического опыта отечественной и международной медицины, которые регулярно пересматриваются и отражают современное представление о социально-экономическом бремени заболевания, механизмах его развития, а также современных возможностях и тенденциях диагностики, терапии пациентов с БА и предупреждения прогрессирования заболевания во всем мире.
Благодаря международному руководству рабочей группы Глобальной инициативы по борьбе с астмой (Global Initiative for Asthma – GINA), впервые изданному в 1995 г. и ежегодно обновляемому, совершенствуются и являются на сегодняшний день ориентиром и основой для создания локальных документов, в том числе и на территории РФ, Федеральные клинические рекомендации «Бронхиальная астма» Российского респираторного общества, Российской ассоциации аллергологов и клинических иммунологов, Союза педиатров России и российская Национальная программа «Бронхиальная астма у детей». На сегодняшний день разработана единая унифицированная стратегия и концепция терапии пациентов с БА, которая направлена на улучшение качества их жизни и достижение длительного контроля заболевания, включающего в себя минимизацию клинических проявлений, предотвращение обострений и формирования необратимой обструкции, а также снижение риска развития побочных эффектов лекарственной терапии и риска летальных исходов [4–6]. Контроль заболевания может быть достигнут у пациента с БА в том случае, если ему подобран оптимальный режим терапии, с регулярной оценкой его эффективности и интенсивности, основанный на персонализированном подходе с соблюдением выбранной схемы терапии пациентом – только высокий уровень приверженности к лечению позволяет достичь ожидаемых результатов. Однако, согласно эпидемиологическим данным, у части пациентов с БА, несмотря на использование оптимальных доз получаемой лекарственной терапии, отмечается недостаточный контроль над заболеванием и остается высоким риск развития обострения, в этом случае возникает необходимость проведения фенотипирования и эндотипирования заболевания [7].
На сегодняшний день при выборе терапии БА необходимо не только ориентироваться на общепринятые ее критерии: социально-демографические особенности и характеристики пациента (возраст, пол), значимые триггеры заболевания, наличие сопутствующей патологии, частоту обострений, переносимость и совместимость лекарственных препаратов, но и учитывать многокомпонентность и гетерогенность БА, что объясняется вариабельностью клинических ее форм, течения, степени ответа на применяемую терапию и наличием различных фенотипов и его эндотипов. Фенотип БА представляет собой совокупность узнаваемых кластеров клинико-биологических признаков и характеристик организма, обусловленных взаимодействием генетических и средовых факторов, в том числе и на молекулярном уровне. Эндотип заболевания представляет собой подтип/субтип или биологический маркер патологии с уникальным и отличительным патофизиологическим механизмом, который может явиться субстратом или обоснованием назначения терапии, основанной на патогенетической регуляции ответа на проводимое лечение. Один эндотип БА может лежать в основе нескольких фенотипов, поскольку эндотип – это молекулярная основа фенотипа. У одного пациента может наблюдаться сочетание разных фенотипов, кроме того, один фенотип может переходить в другой под воздействием экзо- и эндофакторов [8]. Благодаря внедрению и возможностям новейших технологий биомедицины и современных высокотехнологичных методов молекулярной генетики появилась возможность изучения и идентифицирования генов БА, из которых наиболее значимыми на сегодняшний день являются гены-модификаторы и гены-кандидаты, ответственные за формирование атопии, бронхиальной гиперреактивности, а также определяющие степень ответа и чувствительности к терапии.
В соответствии с согласительными программными документами, на сегодняшний день основой фармакотерапии БА является использование патогенетической терапии, которая направлена на купирование воспаления в дыхательных путях, профилактику приступов и обострения БА. Правильный выбор противовоспалительной (син. – поддерживающей или базисной) терапии обеспечивает длительный и стойкий контроль над клиническими проявлениями заболевания и повышает качество жизни пациентов с БА. Ингаляционный путь введения лекарственных средств (ЛС) является наиболее предпочтительным, поскольку обладает высокой степенью селективности и малой системной биодоступностью, что связано со способностью избирательно оказывать максимальное противовоспалительное действие на поверхности бронхов даже при низких дозах ЛС и таким образом минимизировать риски формирования побочных системных эффектов. К ЛС для контроля течения БА, назначаемым для ежедневного использования и на длительное время, относят следующие лекарственные препараты: ингаляционные глюкокортикостероиды (ИГКС), антилейкотриеновые ЛС (син. – модификаторы лейкотриенов, АЛТР), ингаляционные бета-2-агонисты длительного действия (ДДБА) и их фиксированной комбинации с ИГКС в режиме единого ингалятора (ИГКС/ДДБА). Согласно данным доказательной медицины, наиболее эффективными среди всех существующих препаратов базисной терапии являются ИГКС, применяемые в соответствии с контролем симптомов БА, ее фенотипа/эндотипа и возрастных особенностей пациента в качестве монотерапии или в комбинации с другими лекарственными препаратами. ИГКС эффективно снижают выраженность и активность клинических проявлений заболевания вследствие уменьшения бронхиальной гиперреактивности и воспаления бронхиального дерева, обладают высокой степенью липофильности, что способствует лучшему проникновению ЛС в мембрану клетки. В отличие от системных глюкокортикостероидов, ингаляционная форма лекарственных препаратов вызывает минимальные системные и местные нежелательные эффекты и проявления, однако у некоторых пациентов сохраняется возможность их развития, а у части больных БА при использовании ИГКС отмечается вариабельная чувствительность к данной фармакологической группе ЛС в виде относительной резистентности или ее неэффективности. Несмотря на то что такие пациенты в клинической практике встречаются нечасто, подбор поддерживающей терапии затруднен, что связано с ограничениями и отсутствием альтернативных вариантов лечения. Не исключено, что вариабельность эффективности ИГКС может быть связана с особенностью их абсорбции, распределения, метаболизма и элиминации из организма. Следовательно, необходимо дальнейшее изучение эффективности ИГКС в терапии БА, включающей раннее проведение фармакогенетических исследований с целью определения полиморфизмов генов-кандидатов, ответственных за контроль иммунного распознавания и иммунорегуляции и принимающих участие в кодировке медиаторов воспаления, белков и процессов гиперреактивности и ремоделирования дыхательных путей, а также ферментов, кодирующих фазы биотрансформации лекарственных препаратов. В литературе описаны данные о роли полиморфизма rs28364072 гена низкоаффинного FC-фрагмента рецептора II IgE (FCER2), который является ключевым регулятором IgE-опосредованного иммунного ответа, и его влиянии на эффективность, индивидуальный ответ на терапию ИГКС и вариабельность ответа на проводимое лечение с применением глюкокортикостероидов в ингаляционной форме у пациентов с БА. Ассоциативный анализ полиморфизма гена низкоаффинного FC-фрагмента рецептора II IgE (FCER2) позволит выявить эндотипическую основу формирования аллергических фенотипов заболевания, его потенциальную способность служить предиктором развития патологии у детей, а также разработать критерии фенотипирования и эндотипирования бронхиальной астмы, которые помогут обосновывать выбор персонализированной терапии детям с целью достижения контроля над заболеванием, стойкой и длительной ремиссии [9–11].
Цель исследования – провести ассоциативный анализ влияния полиморфизма гена FC-фрагмента рецептора II IgE (FCER2) на эффективность терапии БА у пациентов детского возраста.
Материалы и методы
Работа выполнена в педиатрическом отделении городской детской клинической больницы г. Уфы в период с сентября 2021 г. по октябрь 2022 г. В исследование вошли дети, имеющие на момент госпитализации установленный диагноз «бронхиальная астма». Верификация диагноза, интерпретация тяжести течения заболевания, определение ступени и объема базисной терапии пациентам с БА проводились в соответствии с критериями согласительных документов (Федеральные клинические рекомендации «Бронхиальная астма» Российского респираторного общества, Российской ассоциации аллергологов и клинических иммунологов, Союза педиатров России и российской Национальной программы «Бронхиальная астма у детей»).
В работе были использованы следующие методы: выкопировка данных из медицинской документации («История развития ребенка» (форма ф112/у), «Медицинская карта стационарного больного» (форма № 003/у)), клинический, аллергологический, аналитический и статистический.
До включения в исследование родители/официальные представители детей дали добровольное информированное согласие на участие в исследовании, а также на взятие биологического материала, его хранение и последующее использование в молекулярно-генетическом исследовании с полным сохранением анонимности получаемых данных и ограничением доступа к ним.
Критерии включения:
- установленный в соответствии с критериями согласительных документов (Федеральные клинические рекомендации «Бронхиальная астма» Российского респираторного общества, Российской ассоциации аллергологов и клинических иммунологов, Союза педиатров России и российская Национальная программа «Бронхиальная астма у детей») диагноз «бронхиальная астма»;
- возраст пациентов от 6 лет до 17 лет 11 месяцев;
- рекомендованная базисная терапия ИГКС или их фиксированная комбинация с ДДБА (ИГКС/ДДБА) в режиме единого ингалятора;
- наличие подписанного родителем/законным представителем информированного добровольного согласия на участие в исследовании.
Критерии исключения:
- возраст пациентов младше шести лет или старше 18 лет;
- рекомендованная базисная терапия другими лекарственными препаратами (не ИГКС или ИГКС/ДДБА);
- отсутствие подписанного родителем/законным представителем информированного добровольного согласия на участие в исследовании.
Все дети на момент включения в исследование находились под динамическим наблюдением врача-аллерголога по месту жительства. В ходе работы у всех пациентов оценивали уровень контроля симптомов заболевания с помощью адаптированного валидизированного вопросника ACQ-5 (Asthma Control Questionnaire, 5-я версия).
У всех пациентов оценены показатели аллерготестирования с помощью метода ImmunoCapPhadia® 250, основанного на определении уровня концентрации антител к аллергену (кЕ/л); критерий наличия сенсибилизации – повышение показателя концентрации > 0,35 кЕ/л. При выявлении диагностически значимых титров антител специфических IgE к аллергенам рекомендовано разделение полученных результатов на классы сенсибилизации в зависимости от уровня его концентрации: класс 0 (диагностически незначимый) – 0,01–0,34 кЕ/л; класс I (низкий уровень сенсибилизации) – 0,35–0,70 кЕ/л; класс II (умеренный уровень сенсибилизации) – 0,70–3,50 кЕ/л; класс III (повышенный уровень сенсибилизации) – 3,50–17,5 кЕ/л; класс IV (высокий уровень сенсибилизации) – 17,5–50,0 кЕ/л; класс V (очень высокий уровень сенсибилизации) – 50,0–100 кЕ/л; класс VI (экстремально высокий уровень сенсибилизации) > 100 кЕ/л.
Определение генетических полиморфизмов у детей с БА проводили в несколько этапов:
- выделение геномной ДНК из образцов размороженной крови пациентов с БА с помощью колоночной фильтрации с применением коммерческого набора реактивов ExtractDNA Blood (ЗАО «Евроген», Россия). Все этапы выделения и очистки ДНК проводили согласно протоколу производителя с соблюдением всех мер предосторожности;
- определение однонуклеотидного генетического полиморфизма rs28364072 (Т2206С) гена низкоаффинного FC-фрагмента рецептора II IgE (FCER2) с применением метода полимеразной цепной реакции в реальном времени (ПЦР-РВ);
- анализ и интерпретация полученных результатов.
Статистический анализ данных осуществляли при помощи статистического пакета Statistica 10,0 (StatSoft, США). Две выборки сравнивали с учетом однородности дисперсий (F-теста Фишера). Статистически значимым результат считался при р-value менее 0,05 (р < 0,05). При сравнении двух независимых переменных непрерывного (подчиняющихся закону нормального распределения) использовали t-тест Стьюдента. При неравенстве дисперсий использовали поправку Уэлча. При сравнении двух независимых переменных непрерывного (не подчиняющихся закону нормального распределения) применяли U-тест Уилкоксона – Манна – Уитни.
Результаты
В исследовании приняли участие 82 ребенка в возрасте от 12 лет до 17 лет 11 месяцев. Медиана возраста, 25% и 75% квартили включенных в исследование детей с БА – 12 (7,5–13) лет. Средний возраст постановки диагноза составил 8 (5–10) лет, мальчиков было 49 (60%), девочек – 33 (40%). Все 82 (100%) пациента, вошедшие в исследование, находились под динамическим контролем врача-аллерголога по месту жительства. С образовательной целью для пациентов в условиях стационара регулярно проводили обучающие мероприятия, направленные на предоставление актуальной и доступной им информации о своем заболевании: о его механизме, основных принципах и возможностях терапии, важности соблюдения врачебных рекомендаций и назначений, проведения регулярного самоконтроля симптомов заболевания. У всех пациентов оценивали периодичность и правильность техники ингаляции ЛС.
Всем детям на момент исследования была проведена коррекция базисной терапии с применением ИГКС или их фиксированной комбинации с ДДБА (будесонид/формотерол) в режиме единого ингалятора (SMART-терапия) в рекомендуемой дозировке в соответствии с согласительными документами, а также оценен контроль БА с использованием валидизированного опросника ACQ-5: частичный контроль отмечен у 71 (87%) пациента, отсутствие контроля над симптомами заболевания зарегистрировано у 11 (13%) пациентов. Средний суммарный балл по шкале ACQ-5 составил 1,2 (1,0; 1,4).
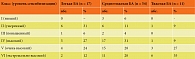
В соответствии с критериями Федеральных клинических рекомендаций «Бронхиальная астма» (2021) [6] нами был проанализирован объем базисной терапии пациентов для поддержания контроля симптомов БА с определением его ступени. Все пациенты были распределены на группы по степени тяжести заболевания: с легким, среднетяжелым и тяжелым течением. У пациентов, получающих поддерживающую терапию второй ступени, степень тяжести БА была интерпретирована как легкая; у пациентов, получающих объем третьей ступени, – средней степени тяжести; у детей с терапией четвертой ступени установлена тяжелая степень БА (табл. 1).
Таким образом, у 54 (66%) пациентов была установлена БА средней степени тяжести, у 17 (21%) пациентов – легкой степени тяжести и у 11 (13%) пациентов – тяжелой. При оценке дебюта симптомов БА в зависимости от степени ее тяжести было выявлено, что данный показатель у детей с легким течением составил 3,2 ± 2,54, средним течением – 2,6 ± 1,22, тяжелым течением – 4,6 ± 2,02; у пациентов с БА средней степени тяжести манифестация клинических проявлений заболевания началась достоверно раньше (р < 0,05).
У всех детей, включенных в исследование, анализировали клинико-анамнестические данные: отягощенность по аллергологическим заболеваниям и наследственность, проводили идентификацию специфически значимого аллергена с использованием метода ImmunoCapPhadia® 250.
Отягощенная по аллергическим заболеваниям наследственность была отмечена у 69 (84%) пациентов, у 13 (16%) пациентов данных за аллергическую патологию в семье выявлено не было. У 25 (36%) пациентов наличие аллергических заболеваний отмечалось одновременно по материнской линии и по линии отца, только по линии матери – у 31 (45%) пациента и только по линии отца – у 13 (19%) пациентов. В группе детей со среднетяжелым течением БА отягощенность семейным аллергологическим анамнезом встречалась у 29 (42%) пациентов, у 23 (33%) пациентов – с легкой степенью тяжести и у 17 (25%) пациентов – с тяжелым течением.
Все 82 (100%) пациента, включенные в исследование, в зависимости от степени тяжести БА имели специфически значимую сенсибилизацию (табл. 2).
Согласно полученным данным, у детей с БА легкой степени тяжести чаще выявлялся умеренный уровень (класс II) сенсибилизации – у 6 (31%) пациентов, у 17 (31%) пациентов со среднетяжелой БА – высокий уровень (класс IV) сенсибилизации и у 6 (55%) пациентов – экстремально высокий уровень (класс VI) сенсибилизации. Анализ молекулярного аллерготестирования показал, что у пациентов с БА тяжелой степени тяжести класс VI (экстремально высокого уровня) выявлен достоверно чаще (р < 0,05).
Ген низкоаффинного FC-фрагмента рецептора II IgE (FCER2) обладает полиморфизмом, является ключевым регулятором IgE-опосредованного иммунного ответа и влияет на эффективность, индивидуальный ответ терапии ИГКС и вариабельность ответа на проводимое лечение с применением глюкокортикостероидов в ингаляционной форме у пациентов с БА.
Мы провели оценку генотипирования всех 82 (100%) детей, включенных в исследование, на предмет изучения полиморфизма rs28364072 (Т2206С) гена низкоаффинного FC-фрагмента рецептора II IgE (FCER2).
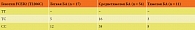
Частота распределения генотипов у пациентов с БА по полиморфному маркеру Т2206С гена FCER2 в группах с легким, среднетяжелым и тяжелым течением заболевания представлена в табл. 3.
Согласно полученным данным, из 82 (100%) пациентов с БА были гетерозиготами и обладали генотипом ТС 24 (29%) пациента, остальные 58 (71%) пациентов, включенных в исследование, были гомозиготами и обладали генотипом СС. Гетерозиготами с генотипом ТС были 5 (29%) пациентов из группы детей с легкой степенью тяжести БА, получавшие в качестве базисной терапии низкие дозы ИГКС, и 16 (27%) пациентов из группы со средней степени тяжести БА, из которых девять пациентов получали средние дозы ИГКС и семь пациентов – фиксированную комбинацию ЛС – низкие дозы ИГКС/ДДБВ, трое пациентов с генотипом ТС были из группы детей с тяжелой степенью тяжести БА и получали средние и высокие дозы ИГКС/ДДБА. Таким образом, из 24 пациентов, обладающих генотипом ТС, объем поддерживающей и контролирующей терапии БА соответствовал третьей и четвертой ступеням терапии согласно Федеральным клиническим рекомендациям «Бронхиальная астма» (2021).
Носительство аллеля С (ген FCER2 (Т2206С)) ассоциировано с повышенным содержанием IgE, высокой потребностью в медицинской помощи/госпитализации и отсутствием контроля над заболевания. С учетом того, что ориентиром интерпретации степени тяжести на сегодняшний день являются объем базисной фармакотерапии и ее ступень, можно сделать вывод, что генотип ТС и присутствие аллеля С (ген FCER2 (Т2206С)) ассоциировано с потребностью в большем объеме базисной терапии, что ассоциировано с повышением дозы ИГКС и использованием его в фиксированной комбинации с ДДБА в режиме единого ингалятора.
Таким образом, по результатам исследования установлено:
- 24 (29%) пациента с БА, включенных в исследование, были гетерозиготами по полиморфному маркеру FCER2 (Т2206С), а остальные 58 (71%) пациентов являлись гомозиготами и обладали генотипом СС;
- у 19 из 24 пациентов с генотипом ТС гена FCER2 (Т2206С) объем поддерживающей и контролирующей терапии симптомов БА соответствовал третьей и четвертой ступеням терапии согласно Федеральным клиническим рекомендациям «Бронхиальная астма» (2021);
- генотип ТС и присутствие аллеля С (ген FCER2 (Т2206С)) ассоциированы с повышенным содержанием IgE, отсутствием контроля над заболеванием, что приводит к увеличению объема поддерживающей (базисной) терапии вследствие повышения дозы ИГКС и использования фиксированной комбинации с ДДБА в режиме единого ингалятора.
Заключение
Полученные нами данные подтверждают необходимость проведения дальнейшего фармакогенетического исследования с целью изучения механизмов эффективности ЛС, которые используются для проведения базисной терапии БА. Ассоциативный анализ полиморфизма гена низкоаффинного FC-фрагмента рецептора II IgE (FCER2) позволит выявить эндотипическую основу формирования аллергических фенотипов заболевания, его потенциальную способность служить предиктором развития патологии у детей; разработать критерии фенотипирования и эндотипирования бронхиальной астмы, которые помогут обосновывать выбор персонализированной терапии детям с целью достижения контроля над заболеванием, стойкой и длительной ремиссии.
R.R. Gafurova, R.M. Fayzullina, PhD, Prof.
Bashkir State Medical University, Ufa
Contact person: Rita R. Gafurova, rita.gafurova2017@yandex.ru
To date, pharmacogenetic studies continue to search for candidate genes that can affect the effectiveness and action of IGCS in patients with AD. The literature describes data on the role of the rs28364072 polymorphism of the low-affinity FC fragment of the IgE receptor II (FCER2), which is a key regulator of the IgE-mediated immune response and its effect on the effectiveness, individual response of IGCS therapy and variability of response to treatment with the use of glucocorticosteroids in inhaled form in patients with AD. Associative analysis of the polymorphism of the gene of the low affinity FC fragment of the II IgE receptor (FCER2) will reveal the endotypic basis for the formation of allergic phenotypes of the disease, its potential ability to serve as a predictor of the development of pathology in children; to develop criteria for phenotyping and endotyping of bronchial asthma, which will help justify the choice of personalized therapy for children in order to achieve disease control, stable and long-term remission.
Purpose – to carry out an associative analysis of the effect of polymorphism of the FC-fragment of the II IgE receptor (FCER2) on the effectiveness of AD therapy in pediatric patients in order to determine the likely ways to justify and optimize the selection of a personalized therapy algorithm.
Materials and methods. The study was conducted on the basis of the Ufa City Children's Clinical Hospital (GDKB) with the participation of 82 children aged 12 years to 17 years 11 months with a verified diagnosis of "Bronchial asthma", during the work, all children included in the study underwent a dynamic assessment of the control of symptoms of the disease and the volume of maintenance therapy and its stage. Genotyping was performed in all patients to study the rs28364072 (T2206C) polymorphism of the low affinity FC fragment of the IgE receptor II (FCER2) by real-time polymerase chain reaction (PCR-RV) with subsequent interpretation of the results obtained.
Results. It was found that 24 patients (29%) with AD included in the study were heterozygotes for the polymorphic marker FCER2 (T2206C), and the remaining 58 patients (71%) were homozygotes and had the CC genotype. In 19 out of 24 patients with the FCER2 gene TC genotype (T2206C), the volume of supportive and controlling therapy of BA symptoms corresponded to the third and fourth stages of therapy according to the Federal Clinical Guidelines "Bronchial Asthma" (2021).
Conclusions. TS genotype and the presence of the C allele (FCER2 gene (T2206C)) it is associated with an increased IgE content, lack of control over the disease, which leads to an increase in the volume of maintenance (basic) therapy due to an increase in the dose of IGCS and the use of a fixed combination with DDBA in a single inhaler mode.

