Возможно ли сочетание прогнозоцентричного и глюкозоцентричного подходов к терапии сахарного диабета 2 типа? IV (XXVII) Национальный конгресс эндокринологов «Инновационные технологии в эндокринологии». Сателлитный симпозиум компании «Штада»
- Аннотация
- Статья
- Ссылки


Пиоглитазон и алоглиптин: экономически выгодная кардиопротективная комбинация для терапии сахарного диабета 2 типа
Профессор медицины, руководитель отделения сахарного диабета Научного центра здравоохранения Техасского университета в Сан-Антонио (США) Ральф ДеФРОНЗО (Ralph DeFRONZO) рассказал о преимуществах комбинированной терапии пиоглитазоном и алоглиптином.
Три десятилетия назад понимание патогенетических механизмов сахарного диабета (СД) было очень примитивным. Считалось, что СД – генетически обусловленное заболевание. Именно гены отвечают за развитие инсулинорезистентности клеток печени и мышечной ткани. На ранних этапах β-клетки для компенсации инсулинорезистентности начинают секретировать достаточный объем инсулина. По мере прогрессирования патологии функция β-клеток нарушается, что приводит к повышенному глюконеогенезу. В результате печень синтезирует меньше гликогена, избыточно продуцируя глюкозу, что приводит к нарушению гликемии натощак. Вследствие дисфункции β-клеток постепенно снижается секреция инсулина, вызывая относительный дефицит инсулина, одновременно с этим усиливается инсулинорезистентность периферических тканей. Это приводит к возникновению постпрандиальной гипергликемии. В 1987 г. профессор Р. ДеФронзо назвал этот патофизиологический механизм триадой1. В 2008 г. триада была расширена им до зловещего октета2. К нарушению функции β-клеток, инсулинорезистентности печени и мышечной ткани были добавлены увеличение липолиза, снижение инкретинового эффекта, повышение реабсорбции глюкозы почками, снижение утилизации глюкозы тканями, усиление глюконеогенеза, увеличение секреции глюкагона α-клетками, снижение секреции инсулина, дисфункция нейротрансмиттерной передачи на уровне центральной нервной системы.
Чтобы воздействовать на большее количество патогенетических звеньев, требуется назначение комбинированной терапии. Кроме того, при выборе препаратов необходимо учитывать патологические отклонения у конкретного пациента, что обеспечит эффективное снижение уровня гликированного гемоглобина (HbA1c). И наконец, важно начинать лечение на ранних этапах сахарного диабета, чтобы замедлить прогрессирование дисфункции β-клеток.
Британское проспективное исследование UKPDS стало первым исследованием, продемонстрировавшим важность адекватного гликемического контроля3. В нем приняло участие более 4000 пациентов. Одни больные получали диету и физические нагрузки. В данной группе с течением времени уровень HbA1c увеличивался из-за нарастающей дисфункции β-клеток. Другие пациенты принимали глибенкламид – препарат из группы производных сульфонилмочевины. Сульфонилмочевина стимулирует секрецию инсулина β-клетками, поэтому в течение первого года терапии уровень HbA1c снижался, однако в дальнейшем наблюдалось его повышение. Отсутствие долгосрочного эффекта объяснялось дальнейшим истощением β-клеток на фоне терапии производными сульфонилмочевины. Еще одна группа пациентов получала метформин. Препарат воздействует на клетки печени, снижает глюконеогенез, но не влияет на инсулинорезистентность мышечной ткани и на функцию β-клеток. Через год от начала терапии отмечалось постепенное увеличение уровня HbA1c.
Несмотря на такие результаты в отношении динамики значений HbA1c, терапия сульфонилмочевиной и метформином способствовала снижению риска развития сердечно-сосудистых заболеваний на 37%.
Результаты исследования UKPDS свидетельствовали о том, что использование одного сахароснижающего перорального препарата не позволяет сохранить низкий уровень HbA1c в долгосрочной перспективе. Поэтому исследователи в схему терапии глибенкламидом добавили метформин и наоборот. Через 15 лет на фоне комбинированной терапии значения HbA1c достигли 8,5%.
Лучшие результаты в отношении динамики HbA1c, в том числе в долгосрочной перспективе, демонстрируют тиазолидиндионы, независимо от того, какой препарат используется – пиоглитазон или росиглитазон. Это было подтверждено в многочисленных исследованиях, в числе которых исследования PERISCOPE, RECORD, ADOPT и CHICAGO4, 5. Основной причиной такого эффекта признано мощное воздействие обоих препаратов на β-клетки.
Была проведена серия исследований чувствительности тканей к инсулину при приеме сахароснижающих препаратов6, 7. Для оценки использовали эугликемический клэмп-тест. Установлено, что росиглитазон и пиоглитазон способствовали повышению чувствительности тканей к инсулину на 40–45% через полгода.
Таким образом, тиазолидиндионы – мощные сенсибилизаторы, которые повышают чувствительность клеток к инсулину в мышцах и адипоцитах и самое главное – улучшают секрецию инсулина за счет улучшения функции β-клеток.
В настоящее время в США и других странах мира зарегистрирован только один представитель класса тиазолидиндионов – пиоглитазон.
Установлено, что пиоглитазон помимо контроля гликемии играет важную антиатерогенную роль. Первое исследование, в котором был продемонстрирован антиатерогенный эффект препарата, – это исследование PROactive8. Оно проводилось в 19 европейских странах. Всего в него были включены 5238 пациентов с СД 2 типа, у которых в анамнезе был инфаркт миокарда или инсульт. Первичная конечная точка определена как достижение основных неблагоприятных сердечно-сосудистых событий (MACE), включавших смерть от сердечно-сосудистых заболеваний (ССЗ), инсульт и инфаркт миокарда. Отношение рисков в отношении достижения MACE на фоне приема пиоглитазона составило 0,84, то есть препарат способствовал снижению рецидива ССЗ на 16%. В частности, в рамках исследования PROactive риск повторного инсульта уменьшился на 48%.
В ряде исследований пиоглитазон назначался пациентам, получавшим метформин либо производные сульфонилмочевины и не имевшим ССЗ в анамнезе, то есть речь шла о первичной профилактике сердечно-сосудистой патологии. Метаанализ результатов исследований, проведенный экспертами Управления по контролю качества пищевых продуктов и лекарственных средств США (Food and Drug Administration – FDA), свидетельствовал о том, что отношение рассматриваемого риска для пиоглитазона составило 0,75, то есть на фоне приема пиоглитазона риск развития сердечно-сосудистых осложнений снизился на 25%.
В исследование IRIS были включены пациенты, у которых за последние полгода случилась транзиторная ишемическая атака либо инсульт, при этом у них не был диагностирован СД (индекс инсулинорезистентности превышал три балла, средний уровень HbA1c составлял 5,8)9. У данных больных терапия пиоглитазоном способствовала снижению рецидива инсульта на 24%.
В исследовании в условиях реальной клинической практики, в ходе которого анализировались медицинские базы данных Финляндии, Швеции и Великобритании, было выявлено 31 333 пациента с СД 2 типа, получавших пиоглитазон10. Для сравнения было отобрано такое же количество больных СД 2 типа, которые получали другие сахароснижающие препараты. Обе группы были сопоставимы по возрасту, продолжительности диабета, длительности последующего наблюдения и по другим показателям. В группе пиоглитазона количество смертельных случаев было меньше, чем в группе других сахароснижающих препаратов, – 1633 против 4513. Аналогичные результаты получены в отношении сердечно-сосудистой смертности. Отношение риска смерти от всех причин составило 0,60, смерти от ССЗ – 0,58, смерти от других причин – 0,63.
Кардиопротективный эффект пиоглитазона реализуется за счет нескольких механизмов. Так, препарат активирует γ-рецепторы, активируемые пероксисомными пролифераторами (Peroxisome Proliferator-Activated Receptor – PPAR), как следствие, ингибируются атерогенные процессы. Кроме того, пиоглитазон повышает синтез оксида азота (NO), снижает уровень С-реактивного белка, ингибитора активатора плазминогена 1, липотоксичность, способствует снижению артериального давления, корректирует диабетическую дислипидемию. Все указанные компоненты входят в понятие «инсулинорезистентный синдром».
Был также проведен ряд исследований по оценке роли тиазолидиндионов в снижении риска развития СД 2 типа у лиц с нарушением толерантности к глюкозе. Речь, в частности, идет об исследованиях TRIPOD, PIPOD, DREAM и ACT NOW5, 11–15.
По словам докладчика, в ходе исследования ACT NOW скрининг прошли 1850 человек, у 602 из них было обнаружено нарушение толерантности к глюкозе. Пациенты с нарушенной толерантностью к глюкозе были рандомизированы в группу плацебо и группу пиоглитазона. Длительность наблюдения за больными составила три года. Частота случаев развития СД 2 типа в группе плацебо достигла 7,6% в год, в группе пиоглитазона – 2,1%. Отношение рисков составило 0,28. Таким образом, было установлено, что пиоглитазон снижал риск развития сахарного диабета у пациентов с нарушенной толерантностью к глюкозе на 72%. Был сделан вывод: чтобы предотвратить один случай развития сахарного диабета, в течение года требуется пролечить 18 лиц с нарушенной толерантностью к глюкозе.
По мнению профессора Р. ДеФронзо, клинически значимым побочным эффектом терапии пиоглитазоном является повышение риска перелома костей, преимущественно у женщин в период менопаузы. У мужчин такого эффекта не наблюдается.
Пиоглитазон также может способствовать задержке жидкости в организме. Однако, по словам докладчика, это не связано с влиянием препарата на функцию почек.
Не менее актуальный вопрос для больных СД 2 типа – воздействие сахароснижающей терапии на массу тела. При СД 2 типа нередко отмечается избыточная масса тела, повышенный уровень свободных жирных кислот в плазме, содержание мышечного, печеночного, висцерального, а также внутри- и периваскулярного жира. Все это приводит к инсулинорезистентности тканей и атерогенным процессам, а также влияет на функцию β-клеток.
При назначении пиоглитазона происходит перераспределение жировой ткани, снижается уровень триглицеридов и свободных жирных кислот, значительно сокращается объем висцеральной жировой ткани, уменьшается содержание жира в мышцах, повышается чувствительность клеток к инсулину.
Перераспределение жира в подкожное депо, как правило, не сопровождается существенным набором веса. Однако у пиоглитазона есть еще один специфический эффект. Данный препарат активирует в гипоталамусе центры, отвечающие за аппетит, что может способствовать перееданию. «Улучшение аппетита, повышение вследствие этого массы тела говорит о том, что препарат работает эффективно. Он воздействует на головной мозг, активируя PPAR-γ как в гипоталамусе, так и в других тканях – мышечной и жировой. Набор веса в данном случае является косметической проблемой, с точки зрения обмена веществ все улучшается. Для снижения данного побочного эффекта рекомендуется начинать терапию с минимальных доз препарата, не превышая суточную дозу 30 мг, на которой наблюдается лишь умеренное повышение массы тела. Эффективна также тактика совместного назначения с препаратами, снижающими вес, – ингибиторами натрий-глюкозного котранспортера 2 и агонистами рецепторов глюкагоноподобного пептида 1», – пояснил докладчик.
Еще одной проблемой, связанной с приемом пиоглитазона, считается увеличение риска развития рака мочевого пузыря. В связи с этим эксперты FDA потребовали организации крупномасштабного исследования. В него были включены 193 099 пациентов с СД 2 типа старше 40 лет. За восемь лет наблюдения рак мочевого пузыря развился у 1089. При этом только 137 из них получали пиоглитазон. Отношение рисков составило 0,98.
По мнению спикера, приведенные результаты должны развеять любые опасения в отношении того, что пиоглитазон повышает риск развития рака мочевого пузыря.
Пиоглитазон можно сочетать с другими препаратами, например метформином, ингибиторами дипептидилпептидазы 4 (ДПП-4), в частности с алоглиптином, агонистами рецепторов глюкагоноподобного пептида 1 (ГПП-1) и ингибиторами натрий-глюкозного котранспортера 2 (НГЛТ-2).
Большие возможности комбинированной терапии пиоглитазоном и ингибиторами ДПП-4, в частности алоглиптином, связаны с особенностями механизмов действия этих препаратов. Действие ингибиторов ДПП-4 отличается от действия пиоглитазона. Препараты данной группы, воздействуя на ДПП-4, препятствуют быстрому распаду ГПП-1, одного из инкретиновых гормонов, с нарушением секреции которого связывают развитие СД 2 типа. Установлено, что ГПП-1 и ГИП отвечают за выработку 70% инсулина, который секретируется β-клетками в ответ на прием пищи. На фоне применения ингибиторов ДПП-4 повышается активность ГПП-1. Секреция инсулина увеличивается, секреция глюкагона подавляется, а это снижает глюконеогенез.
Исследования комбинированной терапии алоглиптина и пиоглитазона доказали ее эффективность по сравнению с мототерапией данными препаратами16. Если алоглиптин в дозе 25 мг способствовал снижению уровня HbA1c на 0,96%, пиоглитазон в дозе 30 мг – на 1,15%, то алоглиптин в дозе 12,5 мг в сочетании с пиоглитазоном в дозе 30 мг – на 1,56%. При использовании 25 и 30 мг соответственно значения HbA1c удалось снизить на 1,71%.
Как было отмечено ранее, пиоглитазон повышает чувствительность клеток к инсулину17. Так, в виде монотерапии пиоглитазон способствовал снижению индекса инсулинорезиcтентности (HOMA-IR) на 24%, в комбинации с алоглиптином – на 34–40%. Данный эффект впечатляет. Однако важнее, что пиоглитазон в сочетании с алоглиптином в дозе 12,5 или 25 мг значительно улучшал функцию β-клеток.
Комбинированная терапия пиоглитазоном и алоглиптином влияет на шесть из восьми патофизиологических звеньев СД 2 типа. Кроме того, такая терапия эффективно снижает уровень HbA1c и обеспечивает кардиопротекцию.
Плейотропные эффекты фиксированной комбинации пиоглитазона и алоглиптина. Управляя инсулинорезистентностью, управляем прогнозом
Вначале своего выступления Гагик Радикович ГАЛСТЯН, д.м.н., профессор, заведующий отделением диабетической стопы Национального медицинского исследовательского центра эндокринологии, рассказал, какие механизмы задействованы в процессе нарушения чувствительности клеток к инсулину и к чему они приводят.
После взаимодействия инсулина с инсулиновым рецептором активируется субстрат рецептора, который через последовательность определенных компонентов воздействует на глюкозный транспортер 4, в результате чего глюкоза проникает внутрь клетки. Параллельно через систему фосфатидилинозитол-3-киназы происходит внутриклеточный синтез белков, участвующих в синтезе липидов и гликогена. Еще одно соединение, которое синтезируется в результате действия инсулина и чрезвычайно важно для клеток эндотелия, сосудистой системы в целом, – это NO-синтаза, которая ответственна за выработку NO.
При нарушении рецепции, когда субстрат инсулинового рецептора не взаимодействует с инсулином, но получает сигнал взаимодействия от инсулина, происходит переключение с нормального физиологического пути внутриклеточного воздействия субстрата инсулинового рецептора на митоген-активированный путь. Иными словами, активируется протеин, отвечающий за инициацию патологических процессов, в результате которых генерируется воспаление, клеточный рост, пролиферация. Если говорить о сосудистой системе, то это фактически основа для развития атеросклеротических процессов. Кроме того, нарушается синтез NO.
Не удивительно, что инсулинорезистентность затрагивает практически все органы и системы, в том числе сосудистую. На уровне жировой ткани происходит нарушение липолиза, повышение циркулирующих совокупных жирных кислот, синтез провоспалительных цитокинов, антифибринолитических факторов. На уровне печеночной ткани увеличивается синтез глюкозы.
Спикер подчеркнул, что инсулинорезистентность предшествует развитию СД 2 типа, ограничивая способность β-клеток компенсировать возросшие потребности в секреции инсулина. Чем выше инсулинорезистентность, тем активнее функционируют β-клетки для выработки инсулина. Когда вырабатываемый инсулин уже не способен преодолевать возросшую инсулинорезистентность, уровень глюкозы в крови повышается. В начале развивается постпрандиальная гипергликемия, затем – гипергликемия натощак. Как следствие, возникает СД 2 типа. Необходимо отметить, что уже в дебюте заболевания у многих больных имеют место микро- и макрососудистые осложнения. Это подтверждает тот факт, что инсулинорезистентность может присутствовать и в отсутствие нарушений углеводного обмена и ее влияние на организм глобально.
Так, в ходе эпидемиологического наблюдательного восьмилетнего исследования SAN ANTONIO, в которое были включены взрослые лица без СД или ССЗ, установлено, что при высоком уровне инсулинорезистентности (индексе HOMA > 3 баллов) увеличивался риск возникновения ССЗ. При повышенных показателях индекса HOMA-IR отношение шансов увеличивалось в 1,5–2,5 раза18. Таким образом, инсулинорезистентность является универсальным маркером неблагоприятного прогноза с точки зрения сердечно-сосудистой патологии.
«Интересно было бы получить эпидемиологические данные не только в отношении сердечно-сосудистых заболеваний, но и в отношении онкологических заболеваний, потому что изменение метаболического процесса в результате инсулинорезистентности повышает вероятность развития и онкопатологии», – подчеркнул профессор Г.Р. Галстян.
Сахарный диабет 2 типа – гетерогенное заболевание, поэтому его течение индивидуально у каждого конкретного пациента. В этой связи особый интерес может представлять анализ, несколько лет назад выполненный в Швеции. Авторы исследования при постановке диагноза СД ориентировались не только на уровень гликемии, но и на наличие антител к глутаматдекарбоксилазе. Кроме того, учитывались возраст, индекс массы тела (ИМТ), значения индекса, отражающего выраженность инсулинорезистентности (HOMA-IR), и индекса, оценивающего функцию β-клеток (HOMA-B). В результате было выявлено пять кластеров СД. На долю третьего кластера, который характеризовался тяжелой инсулинорезистентностью, высокими показателями HOMA-IR, HOMA-В, ИМТ, в исследуемой когорте приходилось 15%.
В отличие от традиционной классификации в данном исследовании гетерогенность была доказана уже в дебюте заболевания. Авторы сделали вывод, что такие больные нуждаются в дифференцированном терапевтическом подходе.
Было также показано, что пациенты с тяжелым инсулинорезистентным диабетом (третий кластер) имеют наихудший прогноз в отношении почечных и коронарных событий. Это еще одно подтверждение того, что наличие инсулинорезистентности является дополнительным фактором, который в совокупности с нарушением углеводного обмена может в значительной степени ухудшить течение СД 2 типа и предопределить негативные исходы сердечно-сосудистой и почечной патологии.
В сентябре 2021 г. были опубликованы результаты исследования RHAPSODY, в котором оценивался риск прогрессирования СД 2 типа19. В этом исследовании тоже была поставлена задача дифференцировать пациентов по кластерам в зависимости от показателей секреции инсулина и наличия инсулинорезистентности. Доля пациентов с выраженной инсулинорезистентностью составила 22%, то есть у каждого пятого пациента с СД 2 типа была злокачественная инсулинорезистентность, требующая контроля.
Переходя к теме терапии СД 2 типа, профессор Г.Р. Галстян отметил, что метформин не является сенситайзером, то есть препаратом, который улучшает чувствительность всех клеток к инсулину. Метформин воздействует исключительно на печеночную ткань, то есть повышает ее чувствительность к инсулину. Это отличает его от глитазонов, которые активируют PPAR-γ, представленные во всех «заинтересованных» тканях, так или иначе участвующих в метаболизме глюкозы, липидов, NO. «Если вкладывать в понятие сенситизации глобальное воздействие на организм, то тиазолидиндионы в большей степени соответствуют этому определению», – пояснил спикер.
PPAR-γ модулируют дифференцировку жировых клеток, то есть способствуют переходу преадипоцитов в инсулинчувствительные малые адипоциты и регулируют скорость перехода малых адипоцитов в большие. Это еще одна важная характеристика данных рецепторов, то есть они в значительной степени регулируют процессы эктопии жировой ткани. Активация PPAR-γ влияет на ремоделирование жировой ткани, блокируя избыточное образование инсулинрезистентных больших адипоцитов, локализованных преимущественно в висцеральной жировой ткани, и повышает представительство малых адипоцитов, инсулинчувствительных.
Таким образом, в целом улучшается метаболическое состояние пациента.
Основное действие пиоглитазона реализуется через PPAR-γ и PPAR-α, поэтому препарат не только воздействует на гликемический контроль, но и обладает достаточно широким спектром плейотропных эффектов.
Терапия пиоглитазоном может способствовать увеличению массы за счет улучшения аппетита. «Однако с точки зрения метаболического здоровья ситуация кардинальным образом меняется, потому что фактически речь идет о том, что агонисты PPAR-γ позволяют мобилизовать топический жир, то есть убирают жир из тех органов, в которых его быть не должно, то есть из печени и сосудистой стенки», – уточнил спикер. Этот феномен присущ исключительно пиоглитазону. Изменение конфигурации жировой ткани, ее ремоделирование вызывают невероятный эффект в виде изменения секреторного профиля адипоцитов, когда значительно ослабевают проатерогенные, провоспалительные процессы и усиливаются кардиопротективные, в том числе управление липидным обменом.
Установлено, что прием пиоглитазона в отличие от применения плацебо способствовал трехкратному повышению секреции адипонектина – кардиопротективного цитокина. Ни один другой лекарственный препарат не продемонстрировал такого эффекта.
Как уже было сказано ранее, пиоглитазон влияет на липидный спектр. Если статины преимущественно снижают уровень липопротеинов низкой плотности и практически не влияют на уровень липопротеинов высокой плотности, то терапия пиоглитазоном приводит к значимому повышению показателей липопротеинов высокой плотности, то есть антиатерогенных липопротеинов, а также к снижению уровня триглицеридов. Это исключительное свойство пиоглитазона связано с воздействием не только на PPAR-γ, но и на PPAR-α.
Пиоглитазон влияет на провоспалительные и прокоагулянтные молекулы – С-реактивный белок, ингибиторы активатора плазминогена, что может объяснять стабилизацию атеросклеротической бляшки в частности и снижение риска атеротромботических событий в целом на фоне терапии.
Так, у больных СД 2 типа, которым пиоглитазон в дозе 15 мг (в дальнейшем при необходимости доза титровалась до 30 мг) назначался в первые пять дней после перенесенного острого коронарного синдрома, через месяц от начала терапии, а затем еще через полгода, с помощью специальных методик ультразвукового исследования оценивали показатели эхоплотности (эхогенности) атеросклеротической бляшки. Более высокими они оказались у получавших пиоглитазон, чем у принимавших плацебо. Динамическая разница наблюдалась уже через месяц терапии. Стабилизация каротидной бляшки в дальнейшем приводила к снижению риска новых случаев инсульта и инфаркта миокарда.
В исследовании CHICAGO пиоглитазон сравнивали с производным сульфонилмочевины глимепиридом20, 21. Его авторы оценивали у пациентов с СД 2 типа суррогатный параметр, принятый в кардиологии, – толщину комплекса «интима – медиа» (ТИМ) сонных артерий. Через 72 недели терапии разница показателя между группами достигла статистической значимости. Она была клинически значимой с точки зрения дальнейшего управления процессом атерогенеза.
В исследовании PERISCOPE использовалась внутрисосудистая ультразвуковая диагностика с расчетом процента атеросклеротической бляшки от внутреннего просвета сосудистой стенки22, 23. Чтобы определить влияние на эту компоненту у больных, которые нуждались в проведении внутрисосудистого ультразвукового исследования, одновременно определяли действие пиоглитазона. Динамический объем атеросклеротической бляшки на фоне применения пиоглитазона в значительной степени отличался от ее динамического объема на фоне лечения глимепиридом. Был сделан вывод, что независимо от улучшения гликемического контроля, которое отмечалось в обеих группах, влияние на атеросклеротическую бляшку наблюдалось только в группе пиоглитазона.
В исследовании PROactive изучалось влияние пиоглитазона на сердечно-сосудистые исходы8. Первичная конечная точка включала такие события, как открытая реваскуляризация артерий нижних конечностей, ампутация нижних конечностей. В отношении достижения компонентов первичной конечной точки были получены нейтральные результаты.
Однако в дальнейшем при детальном анализе MACE было установлено, что получавшие пиоглитазон имели явное преимущество. Отношение шансов для пиоглитазона составило 0,82, верхняя граница доверительного интервала –менее 1. Таким образом, в группе пиоглитазона больших сердечно-сосудистых событий было на 18% меньше.
У больных, перенесших инфаркт миокарда или имевших в анамнезе другие сердечно-сосудистые события, например ишемическую транзиторную атаку или инсульт, риск повторного инфаркта миокарда снизился на 28%, повторного инсульта – на 47%. «Хотя речь идет о post hoc-анализе, и с точки зрения доказательной медицины он имеет вторичную силу, с точки зрения генерации идей, гипотез и дальнейших исследований это очень важные данные», – пояснил спикер.
Данные, полученные в исследовании PROactive, в дальнейшем легли в основу исследования IRIS.
В исследовании IRIS эффект применения пиоглитазона оценивался у пациентов с выраженной инсулинорезистентностью, которые перенесли острое нарушение мозгового кровообращения, инсульт или транзиторную ишемическую атаку9. В исследование включали не только больных диабетом, но и лиц с высоким уровнем инсулинорезистентности. На фоне лечения пиоглитазоном риск развития инсульта и инфаркта снизился на 24%, риск ишемического инсульта – на 28%. «В клинической практике ни один препарат даже не приблизился к этой цифре по влиянию на такую конечную точку, как инсульт», – констатировал Г.Р. Галстян.
Таким образом, пиоглитазон имеет наиболее благоприятные профили действия и безопасности. Его эффекты выходят за рамки гликемического контроля, хотя такой контроль очень важен. Назначая эту линию терапии, особенно на ранних стадиях заболевания, можно рассчитывать не только на долгосрочный гликемический контроль, но и на снижение риска таких сосудистых катастроф, как инсульт, инфаркт, улучшение прогноза в отношении почечной функции. Отдельная тема – это неалкогольный жировой гепатоз печени, нередко сопутствующий СД 2 типа, на развитие которого также может повлиять пиоглитазон.
***
В настоящее время пиоглитазон не зарегистрирован в России. Поэтому у участников дискуссии возникли вопросы, связанные с особенностями применения препарата в клинической практике. Например, насколько препарат безопасен в отношении гипогликемии, можно ли его использовать для первичной профилактики ССЗ у пациентов без СД 2 типа, а также для профилактики развития СД 2 типа.
По словам профессора Г.Р. Галстяна, гипогликемизирующее действие пиоглитазона реализуется за счет улучшения рецепции. Поэтому он абсолютно безопасен в плане гипогликемий. Однако если пациент получает производные сульфонилмочевины и ему назначали пиоглитазон, тем самым улучшив чувствительность клеток к инсулину, при одновременном приеме секретогенного препарата риск развития гипогликемических состояний может повыситься. В этом случае необходимо скорректировать дозу производного сульфонилмочевины. Если же пиоглитазон используется в комбинации с препаратами, которые характеризуются низким риском гипогликемий, – глиптинами, ингибиторами ДПП-4 или ингибиторами НГЛТ-2, риск гипогликемий увеличиваться не будет.
Описывая антиатерогенное воздействие пиоглитазона, Г.Р. Галстян напомнил результаты исследований IRIS и ACT NOW. По мнению спикера, в ближайшей перспективе показания для приема пиоглитазона могут быть пересмотрены так же, как это произошло с метформином, который сегодня можно назначать лицам с предиабетом.
Отвечая на вопрос о том, как лучше титровать дозу пиоглитазона – в сторону повышения или понижения, Г.Р. Галстян отметил, что преимущества препарата в отношении сердечно-сосудистых исходов зафиксированы для дозы 30 мг и более. По мнению спикера, начинать терапию лучше с 15 мг и дальше титровать дозу до 30 мг. Дальнейшее увеличение дозы нецелесообразно, так как повышается риск развития нежелательных явлений.
Использование комбинации пиоглитазона и алоглиптина позволяет преодолеть стартовую нейтральность пиоглитазона, действие которого развивается через шесть – восемь недель с момента назначения. Поэтому спешить с увеличением дозы не следует, нужно дождаться, пока препарат реализует свои эффекты через активацию PPAR-γ. При применении пиоглитазона с алоглиптином ситуация меняется. Глиптины улучшают гликемический контроль в течение первой недели, а затем их действие потенцируется пиоглитазоном.
На вопрос, заменит ли пиоглитазон метформин, Г.Р. Галстян ответил, что у этих препаратов разные точки приложения и они обладают взаимодополняющим механизмом действия.
Длительное удержание гликемического контроля и замедление прогрессирования сахарного диабета 2 типа – возможно ли поставить диабет на паузу?
Как отметил заведующий кафедрой эндокринологии и диабетологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова, руководитель отдела эндокринных и метаболических нарушений Московского клинического научно-практического центра им. А.С. Логинова, д.м.н., профессор Ашот Мусаелович МКРТУМЯН, в настоящее время известно много патогенетических механизмов СД 2 типа. Так, β-ориентированная модель патогенеза СД 2 типа включает 11 звеньев. В первую очередь выделяют нарушение функции и снижение массы β-клеток поджелудочной железы, инсулинорезистентность клеток печени, которая проявляется повышением продукции глюкозы, жировых клеток, в результате чего повышается липолиз, мышечных клеток, что приводит к снижению периферической утилизации глюкозы. В связи с этим оптимальным подходом к лечению пациентов с СД 2 типа является назначение комбинированной терапии, влияющей на различные звенья патогенеза СД 2 типа.
На сегодняшний день для оптимального контроля гликемии используют комбинации препаратов разных групп, в частности тиазолидиндионов с ингибиторами дипептидилпептидазы 4 (ДПП-4).
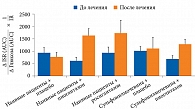
Тиазолидиндионы улучшают функцию β-клеток как у пациентов с впервые выявленным СД 2 типа, так и у пациентов с большим стажем заболевания и уже получающих сахароснижающие препараты (рисунок)24, 25.
В плацебоконтролируемом исследовании ACT NOW была поставлена цель выявить, может ли представитель группы тиазолидиндионов пиоглитазон снизить риск развития СД 2 типа у пациентов с нарушенной толерантностью к глюкозе. Установлено, что пиоглитазон по сравнению с плацебо уменьшал риск развития СД 2 типа на 72% у лиц с предиабетом26.
В рамках исследования IRIS показано, что пиоглитазон предотвращал развитие СД 2 типа у пациентов с предиабетом и острым нарушением мозгового кровообращения. Так, у пациентов с инсулинорезистентностью без СД 2 типа и недавно перенесенным ишемическим инсультом пиоглитазон на 52% снижал риск развития СД 2 типа27.
На сегодняшний день накоплены данные об эффективности ингибиторов ДПП-4 в лечении пациентов с СД 2 типа. В частности, доказано, что алоглиптин улучшает функцию β-клеток. В рандомизированном плацебоконтролируемом исследовании изучали клиническую эффективность и безопасность алоглиптина у 329 больных СД 2 типа, ранее не получавших сахароснижающей терапии. Алоглиптин способствовал повышению индекса НОМA-B, что свидетельствовало об улучшении функции β-клеток. Как следствие, улучшился контроль гликемии28.
Данные о динамике HbA1c на фоне терапии алоглиптином были получены в ходе исследования ENTIRE. В нем приняли участие пациенты с впервые диагностированным СД 2 типа и пациенты с СД 2 типа, не достигшие целевых показателей гликемии на фоне предшествующей терапии. К третьему визиту среднее снижение HbA1c во всех группах алоглиптина составило 1,2%, при этом разница показателей зависела от исходного уровня HbA1c. Наиболее выраженное уменьшение показателей наблюдалось у пациентов с исходно более высокими значениями HbA1c29.
В другом исследовании комбинация алоглиптина с метформином обеспечила более длительное удержание гликемического контроля по сравнению с препаратом сульфонилмочевины. Эффект комбинированной терапии у пациентов с недостаточным контролем заболевания на фоне монотерапии метформином сохранялся в течение двух лет30.
Кроме того, в исследованиях последних лет доказано, что ингибиторы ДПП-4 способны положительно влиять на сердечно-сосудистую систему. Согласно результатам доклинических исследований, терапия ингибиторами ДПП-4 может замедлять прогрессирование атеросклероза. Прогрессирующее увеличение ТИМ сонных артерий считается суррогатным маркером сердечно-сосудистых заболеваний у пациентов с СД 2 типа. Применение ингибиторов ДПП-4 способствовало улучшению показателей ТИМ31, 32.
Эти данные подтверждают результаты исследования SPEAD-A. Так, на фоне терапии алоглиптином отмечено замедление уменьшения ТИМ у пациентов с СД 2 типа без сердечно-сосудистых заболеваний в анамнезе33.
Профессор А.М. Мкртумян отметил, что с 2008 г. и по настоящее время эксперты FDA требуют проведения исследований кардиологической безопасности новых сахароснижающих препаратов. Такие исследования в отношении ингибиторов ДПП-4 проводились в течение нескольких лет.
В исследовании EXAMINE приняли участие 5380 пациентов с СД 2 типа и острым инфарктом миокарда или нестабильной стенокардией. В рамках исследования оценивали влияние на сердечно-сосудистые исходы алоглиптина и стандартной терапии. Алоглиптин продемонстрировал безопасность у пациентов с высоким сердечно-сосудистым риском, недавно перенесших острый коронарный синдром34.
Более того, субанализ результатов исследования EXAMINE, проведенный в отношении пациентов со скоростью клубочковой фильтрации ≥ 60 мл/мин/1,73 м2, показал статистически значимое снижение риска достижения комбинированной конечной точки MACE (смерть вследствие сердечно-сосудистых причин, нефатальный инсульт и нефатальный инфаркт миокарда) на 19% в группе алоглиптина по сравнению с группой плацебо. При этом риск сердечно-сосудистой смерти снизился на 39%, нефатального инфаркта миокарда – на 14%35.
В другом субанализе результатов исследования EXAMINE оценивали эффективность и безопасность добавления алоглиптина и плацебо к метформину и производному сульфонилмочевины. В группе пациентов, исходно получавших двойную сахароснижающую терапию (метформин + производное сульфонилмочевины), добавление алоглиптина способствовало снижению риска сердечно-сосудистой смерти на 51% и смерти от всех причин на 39%36.
Приведенные выше данные свидетельствуют об эффективности комбинаций сахароснижающих препаратов у пациентов с СД 2 типа, в частности тиазолидиндионов и ингибиторов ДПП-4.
Фиксированная комбинация пиоглитазона и алоглиптина (препарат Инкресинк®) воздействует сразу на несколько звеньев патогенеза СД 2 типа.
Алоглиптин усиливает инкретиновый эффект и секрецию инсулина, снижает секрецию глюкагона. Кроме того, убедительно доказано, что терапия алоглиптином не повышает частоту сердечно-сосудистых событий. В свою очередь пиоглитазон увеличивает поглощение глюкозы мышцами и снижает продукцию глюкозы печенью, а также уменьшает липолиз в адипоцитах. Среди преимуществ пиоглитазона следует выделить не только выраженный гликемический эффект, но и снижение риска сердечно-сосудистых событий, прогрессирования атеросклероза, улучшение функции эндотелия и липидного профиля. Таким образом, алоглиптин и пиоглитазон дополняют действие друг друга.
В 26-недельном исследовании в параллельных группах у пациентов с СД 2 типа с недостаточным контролем гликемии показано, что фиксированная комбинация алоглиптина и пиоглитазона (препарат Инкресинк®) обеспечивает более эффективный гликемический контроль, чем монотерапия пиоглитазоном и алоглиптином37.
По другим данным, фиксированная комбинация алоглиптина и пиоглитазона приводила к быстрому снижению и длительному удержанию уровня HbA1c. Добавление алоглиптина к комбинации «метформин + пиоглитазон» обеспечивало более выраженное сахароснижающее действие по сравнению с увеличением дозы пиоглитазона38.
В рамках другого исследования 1554 пациента, получавших монотерапию метформином, которая не позволяла достаточно эффективно контролировать гликемию, в течение 26 дней принимали алоглиптин отдельно или в сочетании с пиоглитазоном. В ходе исследования получены достоверные данные о комплементарном, взаимодополняющем действии алоглиптина и пиоглитазона (Инкресинк®) на функцию β-клеток39.
В ряде исследований также был показан благоприятный профиль безопасности комбинации алоглиптина и пиоглитазона (Инкресинк®) в терапии СД 2 типа.
Резюмируя результаты исследований эффективности фиксированной комбинации «алоглиптин + пиоглитазон» (Инкресинк®), профессор А.М. Мкртумян подчеркнул, что данный препарат значительно эффективнее снижает и длительно удерживает уровень HbA1c, обладает рядом плейотропных эффектов, а также способствует протекции функции β-клеток и замедлению прогрессирования СД 2 типа.
Применение препарата Инкресинк® оказывает кардиопротективный эффект, улучшает липидный спектр крови, замедляет прогрессирование атеросклероза, снижает воспаление и некроз гепатоцитов при неалкогольной жировой болезни печени. Кроме того, препарат хорошо переносится пациентами, обладает низким риском развития гипогликемий.

