Железо как жизненно необходимый нутриент
- Аннотация
- Статья
- Ссылки
Биологическая роль железа
Железо в виде различных соединений весьма распространено в природе, в том числе и во многих пищевых продуктах. Ионы железа участвуют в следующих химических реакциях: транспорт электронов, цитохромов, железосеропротеидов; транспорт и депонирование кислорода с миоглобином и гемоглобином; формирование активных центров окислительно-восстановительных ферментов – оксидазы, гидроксилазы, СОД (рис. 1).
Физиологические затраты железа относительно невелики, при острых или хронических кровопотерях потребности в железе возрастают. Железо необходимо для нормального эритропоэза и поступает в костный мозг следующими путями: при разрушении эритроцитов, из депо, с пищей и водой. Для нормального эритропоэза необходимо, чтобы в суточном рационе взрослого человека содержалось 12–15 мг железа. Железо откладывается в различных органах и тканях, главным образом в печени и селезенке.
В организме человека железо входит в состав почти 70 важнейших ферментов. Общее содержание железа в организме составляет около 4,5–5 г, из них 75–80% приходится на железо гемоглобина, который обеспечивает транспорт кислорода к тканям; 5–10% входит в состав миоглобина; 1% – в состав дыхательных ферментов, катализирующих процессы дыхания в клетках и тканях. 20–25% содержащегося в организме железа является резервным. Физиологические потери железа с мочой, потом, калом, волосами, ногтями независимо от возраста и пола составляют около 1 мг/сут. У женщин при нормальной менструации, продолжающейся 3–4 дня, потери железа составляют около 15 мг (30–50 мл крови). При гиперполименорее (до 50–250 мл крови) потери железа существенно возрастают. Во время беременности, родов и лактации железа теряется до 1700–1800 мг. За счет распада гемоглобина в сутки освобождается около 21–24 г железа, что во много раз превышает поступление железа из пищеварительного тракта (1–2 мг/сут) [1]. Таким образом, при повышенной потребности в элементе его дефицит начинает восполняться за счет резервного, а затем транспортного фондов.
При целиакии (глютеновой энтеропатии) железо- и В12-дефицитная анемия выявляется в 1,8–14,6% случаев, обычно в сочетании с мальабсорбцией других нутриентов [2].
Регуляция гомеостаза железа
Следует отметить, что количество железа в организме относительно стабильно и обеспечивается поступлением железа с пищей и за счет рециклирования железа, начиная с лизиса старых эритроцитов. В данном процессе задействованы макрофаги селезенки, красного костного мозга и, в меньшей мере, купферовские клетки. Соляная кислота желудочного сока, аскорбиновая кислота пищи, фермент ферроредуктаза способствуют всасыванию железа в кишечнике, переводя трехвалентное железо в двухвалентное. Ряд рецепторов энтероцита облегчают переход железа в клетку, а оттуда в плазму. В слизистой оболочке тонкой кишки находится белок-переносчик железа трансферрин. В клетке комплекс трансферрина и железа распадается, и железо вступает в связь с другим белком-переносчиком ферритином. Клетки-предшественники зрелых эритроцитов накапливают железо в ферритине. В дальнейшем оно используется, когда клетка начинает синтезировать большое количество гемоглобина.
Железо резервируется в виде ферритина (легко мобилизуемая форма резерва) или гемосидерина (трудно мобилизуемая форма резерва). Плазматический транспорт включает трансферритиновое железо и составляет приблизительно 1% железа от общего объема железа в организме.
Железо, поступающее из энтероцитов (5%) и освобождающееся за счет рециклирования старых эритроцитов с участием мононуклеарных макрофагов (95%), переводится преимущественно в костный мозг. При избыточном поступлении железа образуется его особая биохимическая форма, способная генерировать свободные радикалы, что приводит к осложнениям. Чрезмерное количество железа в пище или медикаментозной терапии в течение нескольких дней может привести к снижению абсорбции железа. Этот феномен, называемый «слизистый блок», может наблюдаться даже при обеднении организма железом.
Избыток железа может наблюдаться у гематологических больных после повторных переливаний крови или эритромассы.
В таких случаях показано применение хелаторов железа, например, препаратов типа дефероксамин, деферазирокс [3]. Подобная перегрузка препаратами железа наблюдается, например, при миелодиспластическом синдроме на фоне повторных переливаний крови. В данных случаях также показана хелатная терапия [4]. Возможность ускоренного развития остеопороза при перегрузке железом подтверждалась и в эксперименте на мышах [5].
В регуляции гомеостаза железа принимают участие следующие белковые соединения.
Гепсидин – это антимикробный пептид, синтезируемый в печени в форме препропептида из 84 аминокислот, экскретируется в кровоток в форме зрелого структурированного пептида из 25 аминокислот в присутствии 8 молекул цистеина, образующих четыре дисульфурных моста. При увеличении количества гепсидина абсорбция железа уменьшается и увеличивается его задержка в макрофагальной системе. И наоборот, пониженный уровень выработки гепсидина способствует улучшению абсорбции железа и сокращению его задержки в макрофагах. Таким образом, гепсидин регулирует усвоение железа и его метаболизм, защищая организм от переизбытка железа. В эксперименте установлено, что гепсидин, снижая токсичность железа, способствует уменьшению зоны инфацирования сердечной мышцы при инфаркте миокарда [6]. Железодефицитная анемия часто выявляется при почечной недостаточности. У некоторых больных она рефрактерна к терапии препаратами железа, эритропоэтина и рассматривается как железоневосприимчивая железодефицитная анемия (iron-refractory iron deficiency anemia). Предполагается, что описываемая патология генетически обусловлена и связана с нарушениями обмена гепсидина, играющего важную роль в гомеостазе железа [7].
Протеин HFE, состоящий из 343 аминокислот, играет косвенную роль в метаболизме железа. Отсутствие протеина HFE на поверхности клетки приводит к гиперабсорбции и перегрузке железом, механизмы этого процесса пока не изучены. Взаимосвязь между гепсидином и протеином HFE в настоящее время нуждается в уточнении.
Важная роль в регуляции эритропоэза принадлежит ядерным факторам GATA-1 (внутриядерный регулятор транскрипции в эритроне) и NFE-2. Отсутствие GATA-1 препятствует дифференцировке эритроцитов, недостаток NFE-2 нарушает всасывание железа в кишечнике и синтез глобина.
Регуляция гомеостаза железа находится также под контролем желез внутренней секреции. Для нормального эритропоэза необходимы гормоны, регулирующие обмен белков (соматотропный гормон гипофиза, гормон щитовидной железы тироксин и др.) и кальция (паратгормон, тиреокальцитонин). Мужские половые гормоны (андрогены) стимулируют эритропоэз, тогда как женские (эстрогены) тормозят его, что, по-видимому, обусловливает меньшее число эритроцитов у женщин по сравнению с мужчинами.
Установлено, что ключевым фактором, который обеспечивает пролиферацию и дифференцировку клеток эритроидного ряда, а также препятствует их апоптозу, является циркулирующий в крови гликопротеидный гормон эритропоэтин. Эритропоэтины присутствуют в крови животных и людей, испытывающих гипоксию, что наблюдается при анемиях, подъеме на высоту, мышечной работе и т.п. Установлено, что почки являются местом синтеза эритропоэтинов; они образуются также в печени, селезенке, костном мозге. Эритропоэтической активностью обладают полипептиды эритроцитов, молекулярная масса которых не превышает 10 000. Эритропоэтины оказывают действие непосредственно на клетки-предшественники эритроидного ряда:
- ускоряют переход стволовых клеток костного мозга в эритробласты;
- увеличивают число митозов клеток эритроидного ряда; ускоряют созревание нормобластов, ретикулоцитов.
Для нормального эритропоэза необходимы витамины, в первую очередь витамин B12 и фолиевая кислота, которые принимают участие в синтезе глобина. Немаловажную роль в регуляции эритропоэза играют и другие витамины группы В [8].
На эритропоэз оказывают влияние интерлейкины, синтезируемые моноцитами, макрофагами, лимфоцитами и другими клетками. Выработка эритропоэтина регулируется на уровне транскрипции его гена. При нормальном уровне оксигенации тканей концентрация эритропоэтина, так же как и объем циркулирующих эритроцитов, остается постоянной. Таким образом, гипоксия является единственным физиологическим стимулом, увеличивающим количество синтезирующих эритропоэтин клеток.
Железосодержащие органические соединения
Железо в организме разделяется на клеточное и внеклеточное.
Клеточное железо
1. Гемопротеины, основным структурным элементом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза и пероксидаза). При этом гемоглобин переносит экзогенный кислород и эндогенный углекислый газ. Эритроцит в данном случае является своеобразной буферной системой, регулирующей общую газотранспортную функцию.
2. Железосодержащие ферменты негеминовой группы (сукцинат-дегидрогеназа, ацетил-коэнзим-А-дегидрогеназа, NADН-цитохром, С-редуктаза и др.). В них железо не включено в геминовую группу и необходимо только для реакций переноса. Железосодержащие ферменты и негеминовое железо находятся главным образом в митохондриях. Митохондриальное железо необходимо для процессов дифференцировки тканей, а внемитохондриальное играет важную роль в процессах роста и дыхания клетки. Наиболее изученными и важными для организма ферментами являются цитохромы, каталаза и пероксидаза. Основной биологической ролью большинства цитохромов является участие в переносе электронов в процессах терминального окисления в тканях.
Цитохромы подразделяются на следующие группы:
- А – цитохромы с гем-группой, соединяющей формилпорфин;
- В – цитохромы с протогем-группой;
- С – цитохромы с замещенной мезогем-группой;
- D – цитохромы с гем-группой, соединяющей дегидропорфин.
В организме человека содержатся следующие цитохромы: a1, aЗ, b, b5, c, c1, Р450. Они представляют собой липидные комплексы гемопротеинов и прочно связаны с мембраной митохондрии. Цитохромы В5 и Р450 находятся в эндоплазматическом ретикулуме.
Цитохромоксидаза является конечным этапом митохондриального транспорта электронов, ответственным за образование АТФ при окислительном фосфолировании в митохондриях.
Каталаза является одним из важнейших ферментов, предохраняющих эритроциты от окислительного гемолиза. Как и цитохромоксидаза, фермент состоит из единственной полипептидной цепочки, соединенной с гем-группой.
Пероксидаза содержится преимущественно в лейкоцитах и в слизистой оболочке тонкого кишечника у человека. Она выполняет защитную роль, предохраняя клетки от их разрушения перекисными соединениями.
Миелопероксидаза – железосодержащий геминовый фермент, находящийся в азурофильных гранулах нейтрофильных лейкоцитов и освобождающийся в фагоцитирующие вакуоли во время лизиса гранул. Активированное этим ферментом разрушение белка клеточной стенки бактерий является смертельным для микроорганизма.
3. Ферритин и гемосидерин внутренних органов. Ферритин и гемосидерин находятся главным образом в ретикулоэндотелиальной системе печени, селезенки и костного мозга. Приблизительно одна треть резервного железа организма человека, преимущественно в виде ферритина, содержится в печени. Запасы железа при необходимости могут быть мобилизованы для нужд организма. Не вызывает сомнений тот факт, что концентрация сывороточного ферритина отражает состояние резервного фонда железа в организме человека.
Гемосидерин является вторым резервным соединением железа в клетке и содержит значительно больше железа, чем ферритин. В отличие от ферритина, он нерастворим в воде.
4. Железо, непрочно связанное с белками и другими органическими веществами.
Внеклеточное железо
Трансферрин – это специализированный железосвязывающий белок, который содержится в небольшом количестве в плазме крови. Трансферрин не только переносит железо в различные ткани и органы, но и распознает синтезирующие гемоглобин ретикулоциты и другие нуждающиеся в железе клетки. Трансферрин передает им железо только в том случае, если клетки имеют специфические железистые рецепторы. При утрате рецепторов клетка теряет способность утилизировать железо. Таким образом, трансферрин функционирует как транспортное средство для железа, обмен которого в организме человека зависит как от общего поступления железа в плазму крови, так и от его количества, захваченного различными тканями соответственно количеству специфических рецепторов для железа в этих тканях. Наиболее важной причиной, определяющей уровень плазменного железа, является взаимодействие процессов синтеза и распада эритроцитов. Количество железа, связанное с трансферрином, составляет около 0,1% (4 мг) всего железа в организме. Общая железосвязывающая способность плазмы, обусловленная концентрацией в ней трансферрина, колеблется от 44,7 до 71,6 мкмоль/л, а свободная железосвязывающая способность, или резервная емкость трансферрина, составляет 28,8–50,4 мкмоль/л у здорового человека.
В плазме здорового человека трансферрин может находиться в 4 молекулярных формах:
- апотрансферрин;
- моножелезистый трансферрин А – железо занимает только А-пространство;
- моножелезистый трансферрин В – железо занимает только В-пространство;
- дижелезистый трансферрин – заняты А- и В-пространства.
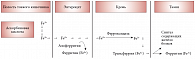
Лактоферрин. Этот белок обнаружен в грудном молоке, слезной жидкости, желчи, синовиальной жидкости, панкреатическом соке и секрете тонкого кишечника. В физиологических условиях этот железосвязывающий белок насыщен железом до 20%. В ничтожных количествах он содержится в плазме крови. Несмотря на схожесть лактоферрина и трансферрина, эти железосвязывающие белки отличаются друг от друга по антигенным свойствам, составу аминокислот, белков и углеводов. Лактоферрин участвует в иммунных процессах и абсорбции железа в тонком кишечнике. Показано преимущество использования бычьего лактоферрина, обогащенного железом, у беременных с анемией по сравнению с обычно применяемым сульфатом железа. Гематологические показатели анемии улучшались параллельно с возрастанием уровня прогепсидина сыворотки крови [9]. Нарушения в метаболизме железа могут вести к перегрузке организма железом (гемохроматоз) или, наоборот, к анемии. Установлена связь между обменом железа, резистентностью к инсулину и ожирению [10]. На рисунке 2 представлена схема поступления железа в организм [11].
А.П. Авцын описывает следующую схему метаболизма железа: «В количественном отношении наибольшее значение имеет метаболический цикл: плазма → красный костный мозг → эритроциты → плазма. Кроме того, функционируют циклы: плазма → ферритин, гемосидерин → плазма и плазма → миоглобин, железосодержащие ферменты → плазма. Все эти три цикла связаны между собой через железо плазмы (трансферрин)» [1].
Лечение препаратами железа
Суточная потребность в железе составляет у детей до 3 месяцев – 1,7 мг, от 4 до 6 месяцев – 4,3 мг, от 7 до 12 месяцев – 7,8 мг, до 3 лет – 6,9 мг, от 4 до 6 лет – 6,1 мг, от 7 до 10 лет – 8,7 мг, у девочек от 11 лет – 14,8 мг, у мальчиков от 11 до 18 лет – 11,3 мг, после 18 лет – 8,7 мг; у женщин до 50 лет – 14,8 мг (и больше при наличии кровопотерь), после 50 лет – 8,7 мг. За сутки с мочой выводится около 0,1–0,3 мг и 4–16 мг – с калом; с менструацией теряется 10–50 мг железа. Потребность в железе у женщин на 30–90% выше, чем у мужчин; при беременности потребность возрастает примерно на 60% [12].
При лечении препаратами железа для перорального применения обычно исходят из следующих общих закономерностей. В норме всасывается около 7–10% вводимого внутрь железа, при истощении его запасов – до 17%, а при железодефицитных анемиях – до 25%. Максимальное количество железа, включаемого в эритробласты и используемого для синтеза гемоглобина, составляет около 25–30 мг в сутки. Увеличение суточной дозы свыше 200 мг (в пересчете на элементарное железо) значительно повышает частоту и выраженность побочных реакций. При лечении анемии обычно рекомендуют принимать 50–60 мг элементного железа внутрь. Эта доза делится на два-три приема; продолжительность терапии – до 3 месяцев. Часто используются следующие препараты: фумарата железа, таблетка 325 мг (содержание элементного железа 108 мг); сульфата железа, таблетка 325 мг (содержание элементного железа 65 мг); глюконат железа, таблетка 325 мг (содержание элементного железа 35 мг).
Обычно уровень гемоглобина крови начинает возрастать на 0,7–1,0 г/дл в неделю приблизительно через 2–3 недели после начала терапии. Лечение препаратами железа считается адекватным, если уровень ферритина сыворотки достигает 50 мкг/л. Вследствие неконтролируемого всасывания солей железа, которое зависит от рН содержимого желудка, не всегда можно предугадать, какое количество железа попадает в кровь – недостаточное, достаточное или избыточное. Если при железодефицитной анемии лечение железом в течение двух месяцев не дает эффекта, необходимо уточнить диагноз и исключить рак органов пищеварительного тракта.
Улучшают всасывание железа простые углеводы – лактоза, фруктоза, сорбит. Гистидин, лизин, цистеин повышают биоусвоение, образуя с ионом железа хелатные комплексы. Усвоение железа снижается при трансфузионной полицитемии, дефиците меди, никеля. Соли фитиновой кислоты, фитаты, содержащиеся в пресном тесте из муки цельного помола, хлебных злаках и темной овощной зелени, также связывают ионы железа в желудке и препятствуют его всасыванию. Затрудняют всасывание железа клетчатка и фосфаты, фосфобелки, содержащиеся в яйцах. Может снижать способность к всасыванию железа молоко, поскольку лактоферрин молока связывает свободное железо. Уменьшается поглощение железа при связывании с пищевым консервантом этилендиаминтетрауксусной кислотой (ЭДТА), которая добавляется во многие продукты: газированные напитки, приправы, майонезы, соусы.
Абсорбция железа нарушается при приеме щелочных препаратов, Н2-блокаторов, блокаторов протонной помпы. Кроме того, увеличение разовой дозы препарата железа может также несколько снижать усвоение железа.
Витаминно-минеральные комплексы при дефиците железа
Представляет интерес препарат Фероглобин-В12 сироп [13], выпускаемый компанией «Витабиотикс» (Великобритания). В 5 мл (1 ч. ложка сиропа) препарата содержится: витамина B1 4 мг (тиамина 5 мг), витамина B2 1 мг (рибофлавина 1,32 мг), витамина B6 (пиридоксина гидрохлорида) 2 мг, витамина B12 5 мкг, ниацина (никотинамида, витамина B3) 8 мг, фолиевой кислоты 150 мкг, витамина C (аскорбиновой кислоты) 10 мг, пантотеновой кислоты 2 мг, кальция глицерофосфата 10 мг, железа 7 мг (железа аммония цитрата 35 мг), цинка (сульфата) 5 мг, марганца 0,25 г (марганца сульфата 21,99 мг), меди 0,25 мг (меди сульфата 0,91 мг), йода 40 мкг (калия йодида 52,32 мкг), лизина гидрохлорида 40 мг, меда 100 мг, экстракта солода 500 мг. Препарат содержит оптимальное для комплексных витаминных препаратов количество элементного железа и сбалансированный состав витаминов, микроэлементов, что позволяет использовать Фероглобин-В12 в течение длительного времени без риска развития побочных эффектов.
Витамин B1 (тиамин). Фосфорилированная форма тиамина – тиаминпирофосфат – образуется в организме человека и является предшественником ферментов, которые играют существенную роль в обмене углеводов и, в частности, в процессах декарбоксилирования пировиноградной кислоты. Рекомендованная суточная доза (РСД) – 1,1 мг. При беременности и кормлении грудью суточная доза увеличивается до 1,5 мг.
Витамин B2 (рибофлавин). Биологически активной формой рибофлавина является флавинадениндинуклеотид, синтезирующийся в организме человека в почках, печени и других тканях. Другое производное рибофлавина – рибофлавин-5-фосфорная кислота – встречается в естественном виде в дрожжах. Рибофлавин обеспечивает нормальное течение окислительно-восстановительных процессов в организме.
Витамин B6 (пиридоксин) играет важную роль в белковом, углеводном и липидном обмене, а также участвует в синтезе гема. Активные формы витамина В6 представлены группой соединений, производных пиридина (пиридоксин (пиридоксол), пиридоксаль и пиридоксамин), объединяемых под общим названием «пиридоксин». Рекомендованная суточная доза – 1,5 мг. При беременности и кормлении грудью РСД увеличивается до 2,2 мг.
Витамин C (аскорбиновая кислота) является водорастворимым витамином, который выполняет многочисленные функции. Хронический дефицит витамина С приводит к нарушению синтеза коллагена и может вызывать такое заболевание, как цинга. РСД – 60 мг. При беременности РСД увеличивается 70 мг, при кормлении грудью – до 95 мг.
Ниацин (витамин РР) – водорастворимый витамин, принимающий участие в окислительно-восстановительных реакциях и процессах внутритканевого дыхания. Он содержится в домашней птице, рыбе и орехах. Дефицит приводит к пеллагре. РСД – 15 мкг. При беременности РСД увеличивается до 17 мкг, при кормлении грудью – до 20 мкг.
Пантотеновая кислота получила свое название от греческого panthos, что означает «везде», из-за чрезвычайно широкого ее распространения в природе. Попадая в организм, она превращается в пантетин, который входит в состав коэнзима А, играющего важную роль в процессах окисления и ацетилирования [14].
Убедительно показано, что витаминно-минеральные комплексы, особенно содержащие микроэлементы, целесообразнее применять в сочетании с железом в количестве, сопоставимом с рекомендуемой суточной дозой, преимущественно – для коррекции содержания в организме нутриентов. В противоположность этому, при лечении больных с анемией в результате кровопотери необходимы соли железа в увеличенных дозировках. Подобная терапия будет успешной лишь при сохраненной функциональной активности костного мозга.
Заключение
Железо – весьма распространенный в природе, в том числе в пищевых продуктах, элемент. Железо является необходимым компонентом, участвующим в процессах созревания и дифференцировки эритроцитов от стволовой клетки до нормоцита. У здоровых лиц количество резорбируемого в кишечнике железа не зависит от потребностей организма. Вследствие этого продолжительное высокое всасывание железа приводит к сидерозу. Излишки железа депонируются в клетках и тканях в форме ферритина – молекулы, связывающей около 45 000 атомов железа. Следует различать физиологический расход железа в организме и патологическую потерю железа при кровотечении.
Главная задача в терапии больных с анемией – исключить причину болезни, которая может быть связана с хронической кровопотерей, опухолью (рак желудка или кишечника), заболеванием крови и др. При дефиците железа запасы железа восстанавливаются алиментарным путем или после проведения гемотрансфузий или трансфузий эритроцитарной массы за счет железа разрушающихся введенных эритроцитов. При умеренной кровопотере гемотрансфузии не обязательны. Восстановление циркулирующей крови после кровопотери зависит от парциального давления кислорода в циркулирующей крови, функционального состояния костного мозга, запасов железа в организме и ряда других причин.
Очевидно, что так называемая физиологическая железодефицитная анемия, например, у женщин, возникает не в результате потерь железа при кровотечении, а вследствие расстройства регуляции эритропоэза гуморального генеза. Дефицит железа в данном случае – один из синдромов, который клинически может себя не проявить.
Вне зависимости от метода выявления и степени выраженности гипосидероз представляет собой не самостоятельную «болезнь», а симптом какого-то заболевания: от умеренного расстройства пищеварения до патологии кровообращения, кровообразования, злокачественной опухоли, интоксикации и пр.
Многомесячная терапия препаратами железа при торпидно протекающей постгеморрагической анемии нерациональна. В подобных случаях необходимо выяснить причину угнетения функций костного мозга и попытаться на нее воздействовать.
Доза железа в препарате, назначаемом как с профилактической, так и с лечебной целью, должна соответствовать суточной потребности в железе. Дальнейшее увеличение дозы неэффективно, а избыточное накопление железа в организме может приводить к появлению нежелательных реакций. В большинстве случаев при дефиците железа достаточно применения витаминно-минеральных комплексов, содержащих железо.
