Значение оценки функционального состояния почек для реклассификации больных неосложненной артериальной гипертонией по сердечно-сосудистому риску
- Аннотация
- Статья
- Ссылки

Категория сердечно-сосудистого риска определяет не только сроки начала медикаментозной антигипертензивной терапии, но и целевой уровень АД. В связи с этим раннее и точное выделение пациентов, имеющих высокий/очень высокий риск сердечно-сосудистых осложнений, приобретает первостепенное значение. Важнейшая роль в стратификации риска принадлежит выявлению субклинического ПОМ. При этом распределение больных по риску в большой степени определяется объемом обследования (3-8).
Предложены алгоритмы рутинного (обязательного) и расширенного (рекомендуемого) обследования. Однако затратность и труднодоступность некоторых методик зачастую не позволяют выполнить полное обследование. Это, в свою очередь, определяет необходимость ранжирования методов оценки ПОМ по их значимости для стратификации по риску развития сердечно-сосудистых осложнений.
В последних версиях рекомендаций по АГ отчетливо обозначился вектор к снижению значений стратификационных ФР и критериев ПОМ и повышению важности суррогатных критериев оценки эффективности антигипертензивной терапии. Цель нововведений – раннее выявление пациентов с высоким риском для раннего осуществления эффективной профилактики сердечно-сосудистых осложнений. Значительную эволюцию претерпели диагностические критерии субклинического поражения почек. К признакам поражения почек наряду с ранее учитывавшимися незначительным повышением уровня креатинина сыворотки (градации остались прежними: 115-133 мкмоль/л (1,3-1,5 мг/дл) для мужчин и 107-124 мкмоль/л (1,2-1,4 мг/дл) для женщин) и микроальбуминурией (МАУ), добавлено снижение расчетной скорости клубочковой фильтрации (СКФ) или клиренса креатинина (оцениваемым, соответственно, по формулам MDRD (Modification of Diet in Renal Disease) и Кокрофта–Гаулта).
Микроальбуминурия, протеинурия и снижение СКФ являются независимыми предикторами сердечно-сосудистой заболеваемости и смертности (9, 10). Необходимо отметить, что расчетные методы оценки функции почек и определение МАУ тест-полосками внесены в перечень рутинных обследований пациентов с АГ.
В современных рекомендациях важнейшая роль отводится не только выявлению, но и мониторированию субклинических органных поражений как критерию оценки эффективности антигипертензивной терапии. Изменения в органах-мишенях на фоне терапии коррелируют с изменением частоты событий, следовательно, улучшение структурно-функционального состояния органов-мишеней может свидетельствовать о протективном эффекте лечения (11-13).
Необходимо оценивать состояние органов-мишеней через определенные интервалы. Поскольку МАУ быстро изменяется на фоне терапии, ее рекомендуется определять каждые несколько месяцев.
Целью исследования явилось изучение роли оценки функционального состояния почек для выделения групп больных высокого/очень высокого риска развития сердечно-сосудистых осложнений и определения дополнительных терапевтических целей антигипертензивной терапии.
Материал и методы исследования
Исследование выполнено как одномоментное в клинике внутренних болезней РУДН. Обследованы 576 пациентов без установленных заболеваний сердечно-сосудистой системы и почек (на основании анамнеза и данных обязательного обследования) и сахарного диабета (СД) из 1124 больных, направленных для консультативно-диагностической помощи (таблица 1). На момент обращения регулярную антигипертензивную терапию получали 324 (44,1%) пациента. Из них монотерапию диуретиками получали 45 (13,9%), ингибиторами АПФ 97 (29,9%), b-адреноблокаторами 17 (5,2%), антагонистами кальция 57 (17,6%), 40 (12,3%) антагонистами АТ1-рецепторов ангиотензина II, комбинированную терапию (в том числе фиксированными комбинированными препаратами) принимали 68 (21,0%) человек.
Выполнялось обязательное и расширенное обследование в соответствии с рекомендациями 2003 г. (14). Дополнительно определяли МАУ, скорость распространения пульсовой волны (СРПВ), лодыжечно-плечевой индекс (ЛПИ). Для оценки функционального состояния почек исследовали креатинин сыворотки энзиматическим методом, рассчитывали клиренс креатинина (ККр) по формуле Кокрофта–Гаулта (15), СКФ по сокращенной формуле MDRD (16). В образце утренней мочи определяли отношение концентрации альбумина и креатинина (А/Кр), критерием МАУ считали его значение ³ 22 мг/г для мужчин и ³ 31 мг/г для женщин, подтвержденное в двух из трех анализов с интервалом 7-10 дней при отсутствии повышения температуры тела и признаков инфекции мочевыводящих путей.
Статистическая обработка результатов исследования проводилась с использованием пакета прикладных статистических программ SAS (Statistical Analysis System, SAS Institute Inc., США) с применением стандартных алгоритмов вариационной статистики. Данные представлены в виде М ± s, где M – среднее значение, σ – среднеквадратичное отклонение среднего значения. Различия средних величин и корреляционные связи считались достоверными при уровне значимости р < 0,05.
Результаты
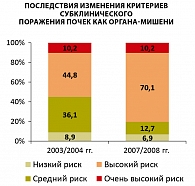
Стратификация больных неосложненной АГ по риску сердечно-сосудистых осложнений в соответствии с рекомендациями 2003/2004 гг. На основании рутинного обследования в соответствии с рекомендациями 2003/2004 гг. (14), ЭхоКГ исследования для выявления гипертрофии миокарда левого желудочка (ГЛЖ), дуплексного сканирования сонных артерий для выявления увеличения толщины интима-медиа (ТИМ) и наличия атеросклеротических бляшек, определения экскреции альбумина с мочой 51 (8,9%) больной АГ без ассоциированных клинических состояний и СД был отнесен к категории низкого риска сердечно-сосудистых осложнений, 208 (36,1%) пациентов – к категории среднего риска, 258 (44,8%) пациентов – к категории высокого риска и 59 (10,2%) пациентов – к категории очень высокого риска. Таким образом, 317 (55%) больных АГ имели высокий/очень высокий риск сердечно-сосудистых осложнений.
Характеристика больных в зависимости от категории риска сердечно-сосудистых осложнений представлена в таблице 2.
Следует отметить, что подгруппу с очень высоким риском составили пациенты с 3-й степенью АГ, имеющие ³ 1 ФР или признаки ПОМ, поэтому эти больные не могли быть реклассифицированы на основании изменения (ужесточения) стратификационных ФР или введения новых критериев субклинического ПОМ в категорию меньшего риска, следовательно, количество больных очень высокого риска оставалось неизменным.
Немногочисленную подгруппу низкого риска составили больные с 1-й степенью АГ без ФР. Больные из этой подгруппы могли быть реклассифицированы в категорию среднего риска при добавлении 1 ФР. Однако такая реклассификация не является значимой, поскольку не изменяет ни времени начала медикаментозной антигипертензивной терапии, ни целевого уровня АД.
Подгруппу пациентов, имеющих средний риск сердечно-сосудистых осложнений, составили пациенты с 1-й и 2-й степенью АГ и 1-2 ФР без субклинического ПОМ. Данная подгруппа является самой изменчивой по составу. С одной стороны, она увеличивается за счет реклассификации (повышения риска) больных с низким риском. С другой – большое значение имеет реклассификация этих пациентов (повышение категории сердечно-сосудистого риска до высокого), так как это требует безотлагательного начала медикаментозной терапии. К повышению категории риска у пациентов, имеющих средний риск сердечно-сосудистых осложнений приведет выявление субклинического ПОМ, метаболического синдрома или увеличение числа имеющихся ФР до трех.
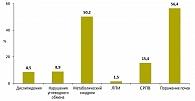
Реклассификация больных АГ по риску сердечно-сосудистых осложнений после изменения критериев субклинического поражения почек. Изменения и введение новых стратификационных ФР и критериев субклинического ПОМ в рекомендациях по АГ 2007/2008 гг. (1, 2) обладают различным потенциалом для реклассификации по риску развития сердечно-сосудистых осложнений пациентов с неосложненной АГ без СД. Изменение критериев дислипидемии и введение параметров углеводного обмена как стратификационных факторов риска повышает риск у 8,5 и 8,9% пациентов с низким/средним риском, включение СРПВ > 12 м/с как признака ПОМ – у 15,4%. Исключение вчСРБ из стратификационных ФР и введение ЛПИ < 0,9 как критерия поражения органов-мишеней минимально изменяет распределение пациентов по риску.
Наиболее высокое значение имело включение в перечень ПОМ сниженной расчетной СКФ или ККр (оцениваемым, соответственно, по формулам MDRD и Кокрофта–Гаулта) и приравнивание кластера ФР – метаболического синдрома – к субклиническому ПОМ.
Субклиническое поражение почек выявлено у 216 (37,5%) больных. Снижение ККр и/или СКФMDRD, соответствующее категории ПОМ, выявлено у 11 больных низкого риска и 135 пациентов среднего риска. Остальные пациенты со снижением ККр и/или СКФMDRD < 60 мл/мин/1,73 м2 ранее были отнесены к категории высокого/очень высокого риска.
Таким образом, учет (наряду с небольшим повышением креатинина сыворотки и МАУ) диагностического снижения СКФMDRD < 60 мл/мин/1,73 м2 приводил к повышению категории риска у 146 (56,4%) пациентов низкого/среднего риска (рисунок 1).
Установлена различная значимость изменений и введения новых стратификационных ФР и критериев субклинического ПОМ для стратификации по риску развития сердечно-сосудистых осложнений больных неосложненной АГ без СД (рисунок 2).
Больным АГ с низким/средним риском развития сердечно-сосудистых осложнений на основании результатов рутинного физического и лабораторного исследования показано расширение объема обследования с целью уточнения категории риска, сроков начала антигипертензивной терапии и определения уровня целевого АД. Расширение обследования на первом этапе должно включать оценку функционального состояния почек и выявление метаболического синдрома – кластера факторов риска.
Обсуждение
На основании рутинного обследования, ультразвукового (УЗ) исследования сердца и сосудов, определения экскреции альбумина с мочой 45% больных неосложненной (без ассоциированных клинических состояний) АГ без СД были отнесены к категории низкого/среднего риска сердечно-сосудистых осложнений, 55% больных имели высокий/очень высокий риск. Реклассификация больных из группы низкого в группу среднего риска не является значимой, поскольку не изменяет ни времени начала медикаментозной антигипертензивной терапии, ни целевого уровня АД. Гораздо большее значение с практической точки зрения имеет возможная реклассификация больных низкого или среднего риска в категорию высокого риска, что возможно на основании выявления признаков субклинического ПОМ, наличия метаболического синдрома, приравненного к ПОМ, или трех ФР.
Установлена различная значимость изменений и введения новых стратификационных ФР и критериев субклинического ПОМ для стратификации по риску развития сердечно-сосудистых осложнений больных неосложненной АГ без СД. Наиболее значимо уменьшало пропорцию пациентов с низким/средним риском введение снижения СКФ < 60 мл/мин/1,73 м2 как признака субклинического поражения почек (на 56,4%) и приравнивание кластера ФР – метаболического синдрома – к субклиническому ПОМ (на 50,2%).
Оценка функции почек с использованием расчетных методов является более корректной по сравнению с определением концентрации креатинина сыворотки. Для расчета СКФ по формуле MDRD необходим возраст, пол, раса и уровень креатинина сыворотки. Значения < 60 мл/мин/1,73 м2 указывают на наличие третьей стадии хронической болезни почек, < 30 и < 15 мл/мин/1,73 м2 соответственно четвертой и пятой в соответствии с принятой классификацией (17-19).
Расчет клиренса креатинина по формуле Кокрофта–Гаулта учитывает возраст, пол, массу тела и креатинин сыворотки. Оба метода позволяют выявить нарушенную функцию почек при нормальных значениях креатинина. Опыт применения расчетных методов оценки функции почек показывает, что незначительное повышение креатинина сыворотки по указанным выше критериям может не сопровождаться снижением рассчитанных СКФ < 60 мл/мин/1,73 м2 у лиц молодого возраста, и, напротив, значение креатинина сыворотки ниже указанного диапазона может сопровождаться низкими значениями у пациентов пожилого возраста. Расчетные значения клиренса креатинина по формуле Кокрофта–Гаулта, помимо возраста, чувствительны к массе тела пациента и могут быть высокими при более высоких значениях креатинина сыворотки (20, 21). Важнейшим достоинством расчетных методик оценки функционального состояния почек является также их общедоступность, незатратность, возможность автоматического представления результатов в лабораторных отчетах.
До введения новых критериев субклинического поражения почек в рекомендации по АГ также предпринимались попытки определить оптимальный алгоритм обследования больных АГ, выделив наиболее значимый показатель для изменения стратификации по риску.
Целью эпидемиологического исследования ICEBERG (Intensive/Initial Cardiovascular Examination regarding Blood pressure levels: Evaluation of Risk Groups study) было оценить вклад лабораторных тестов в стратификацию риска у пациентов с высоким нормальным и высоким АД (n = 10313, АД ³ 130/85 мм рт. ст., леченная или нелеченная АГ). Помимо рутинного обследования, определение МАУ и вчСРБ, ЭХОКГ и ультразвуковое (УЗ) исследование сонных артерий выполнялось в различных ветвях исследования. После рутинного обследования пропорция пациентов в группе высокого/очень высокого риска составляла от 51,2% до 60,7% в различных ветвях исследования. Эта пропорция увеличивалась до 62,9% при добавлении биохимического исследования и до 76,2% при определении вчСРБ. Значение МАУ, УЗ исследования сердца и сосудов для реклассификации больных по риску было сопоставимым: увеличение еще на 6% при использовании МАУ, на 4,9% при ЭХОКГ, на 6,8% при УЗ сонных артерий (22).
В исследовании APROS (Assessment of Prognostic Risk Observational Survey) 1074 с нелеченной АГ из 8502 пациентов на основании рутинного обследования (анамнез, физическое исследование, клиническое измерение АД, биохимический анализ крови, анализ мочи, ЭКГ) были отнесены к категории низкого/среднего риска. Значительное изменение категории риска достигалось при применении УЗ исследования для выявления ПОМ: более 50% пациентов, ранее отнесенных к категории низкого/высокого риска, были затем реклассифицированы в категорию высокого риска (3).
У 580 пациентов нелеченной АГ (355 мужчин, средний возраст 47,8 ± 11,4 лет), отнесенных в категории низкого/среднего риска после рутинного обследования, изучалось соотношение эффективность/стоимость УЗ исследования сонных артерий и ЭхоКГ для стратификации по риску в зависимости от возраста (< 50 и ³ 50 лет) и пола.
По данным рутинного обследования 16,3% обследованных отнесены в категорию низкого риска, 83,7% – среднего. Субклиническое поражение сонных артерий было выявлено у 27,0%, что соответствовало высокому сердечно-сосудистому риску. До исследования сонных артерий риск был недооценен у 12,6% мужчин < 50 лет, 14,1% женщин < 50 лет, 53,0% мужчин ³ 50 лет и 40,1% женщин ³ 50 лет. Стоимость выявления одного случая каротидного атеросклероза составила 473 евро у пациентов < 50 лет и 133 евро у пациентов ³ 50 лет. Таким образом, роль определения ТИМ сонных артерий в оценке риска и соотношение эффективность/стоимость во многом определялось возрастом и полом пациентов (4).
ЭхоКГ критерии ГЛЖ (ИММЛЖ ≥ 125 г/м2 у мужчин, ³ 110 г/м2 у женщин) были выявлены у 86 больных (14,8%), что соответствовало категории высокого риска. До ЭхоКГ риск был недооценен у 8,9% мужчин < 50 лет, 12,3% женщин < 50 лет, 26,7% мужчин ³ 50 лет и 15,3% женщин ³ 50 лет. Стоимость выявления 1 случая ГЛЖ составила 595 евро у пациентов до 50 лет и 290 евро у пациентов ³ 50 лет. Авторы сделали вывод о наибольшей частоте ГЛЖ и, соответственно, вероятности повышения категории сердечно-сосудистого риска на основании ЭхоКГ у мужчин старшего возраста. ЭхоКГ имеет ограниченное значение и невыгодное соотношение эффективность/стоимость у молодых пациентов с АГ (5). Данные результаты не подтвердили необходимости ЭхоКГ как рутинной процедуры у пациентов с неосложненной АГ.
На основании анализа различных алгоритмов обследования 405 пациентов с нелеченной АГ был предложен следующий наименее затратный диагностический алгоритм для выявления ПОМ: МАУ (среднее значение из 3 непоследовательных утренних анализов), затем ЭхоКГ, затем УЗ исследование сонных артерий (8). Распространенность МАУ, ГЛЖ и поражения сонных артерий (увеличение ТИМ или атеросклеротическая бляшка) составила 13, 49 и 32% соответственно. Сочетание 3 методик приводило к значительному увеличению пропорции пациентов с высоким/очень высоким риском. Методики различались по чувствительности: альбуминурия 20%; ЭхоКГ 65%; УЗ исследование сонных артерий 41%. Таким образом, УЗ исследование сердца и сосудов являются высоко чувствительным методом для выявления ПОМ, однако с точки зрения эффективность/стоимость предлагалось начинать обследование с определения МАУ.
Полученные нами результаты о первостепенном значении выявления субклинического поражения почек для стратификации больных неосложненной АГ по риску согласуются с данными другого исследования (6). Обследовано 459 пациентов с неосложненной нелеченной АГ (64% мужчин, средний возраст 47,3 года, без СД). Сочетанное определение МАУ и ККр по формуле Кокрофта–Гаулта изменило стратификацию больных по риску в сравнении с рутинным обследованием: 68% пациентов вместо 58% были отнесены к категории высокого/очень высокого риска. УЗ исследование сердца и сосудов, направленное на выявление субклинического ПОМ, не обладало преимуществом перед оценкой функционального состояния почек в отношении стратификации по риску.
Выводы
Изменения и введение новых стратификационных ФР и критериев субклинического ПОМ в рекомендации по АГ 2007/2008 гг. имеет разное значение для выделения групп пациентов с высоким/очень высоким риском развития сердечно-сосудистых осложнений у пациентов с неосложненной АГ без СД. Наиболее значимо уменьшает пропорцию пациентов с низким/средним риском введение снижения СКФ < 60 мл/мин/1,73 м2 как признака субклинического поражения почек (на 56,4%).
Больным АГ с низким/средним риском развития сердечно-сосудистых осложнений на основании результатов рутинного физического и лабораторного исследования показано расширение объема обследования с целью уточнения категории риска, сроков начала антигипертензивной терапии и определения уровня целевого АД. Расширение обследования на первом этапе должно включать оценку функционального состояния почек – расчет скорости клубочковой фильтрации по MDRD и определение альбуминурии.

