Ахалазия кардиальной части пищевода: мультидисциплинарный подход к диагностике и лечению (обзор литературы и клинические наблюдения)
- Аннотация
- Статья
- Ссылки
- English




Введение
Ахалазия кардиальной части пищевода (АКП) – заболевание пищевода с первичным нарушением его моторной функции, проявляющееся недостаточным расслаблением нижнего пищеводного сфинктера (НПС) и отсутствием пропульсивных перистальтических сокращений в пищеводе [1, 2]. Впервые это заболевание описал английский врач Т. Willis в 1672 г. у пациента с постоянной прогрессировавшей рвотой. Восстановить проходимость пищевода у него удалось с помощью губки, насаженной на китовый ус. Распространенность ахалазии, по данным мировой статистики, составляет 0,6–2 случая на 100 тыс. населения (вне зависимости от пола), в США – один случай на 100 тыс. населения; заболеваемость – от 1,9–15,7 на 100 тыс. населения [2–4]. Доля АКП в структуре всех заболеваний этого органа составляет 3–20% [4].
Перистальтика пищевода обеспечивается за счет последовательного открытия верхнего пищеводного сфинктера (ВПС), вследствие сокращения верхней части пищевода, нижней части пищевода и раскрытия НПС. Она обусловлена высокой рефрактерностью нижней части пищевода к импульсам и сложностью их передачи в области НПС. Патогенез первичной АКП основан на поражении преимущественно постганглионарных нейронов интрамурального ауэрбаховского сплетения, в результате чего нарушаются функционирование пищеводной трубки и ответ НПС на глоток [5], что препятствует прохождению пищи из пищевода в желудок. В качестве этиологических факторов развития заболевания обсуждаются генетические предпосылки, аутоиммунные нарушения и вирусные инфекции, однако не исключается взаимодействие нескольких факторов [6]. Псевдоахалазия может быть следствием поражения ауэрбахова сплетения и блуждающего нерва непосредственно злокачественной опухолью (например, аденокарциномой пищеводно-желудочного перехода) или метастазами опухолей, локализованных в легких и грудной клетке [7]
Клинические проявления
Ведущими клиническими проявлениями АКП являются прогрессирующая дисфагия, срыгивание пищи, а также снижение массы тела [8].
Дисфагия встречается у 82–100% больных и является основным симптомом АКП, проявляющимся ощущением затруднения прохождения или «застреванием» пищи в грудной клетке по ходу пищевода. Симптом не зависит от характера пищи (твердая или жидкая), в отличие от дисфагии при органической патологии (стриктура или опухоль пищевода). Как правило, жалобы больного усиливаются при быстром приеме еды или эмоциональном возбуждении. С целью преодоления или уменьшения выраженности этого симптома больные применяют различные приемы (заглатывание большого объема воздуха, запивание пищи избыточным количеством воды, физическая нагрузка и т.д.). В некоторых случаях больные сосредотачивают внимание не на дисфагии при приеме твердой и жидкой пищи, а на регургитации или изжоге [9], что приводит к постановке ошибочного диагноза.
Регургитация (срыгивание) – второй по распространенности симптом АКП (76–91%), проявляющийся поступлением в ротовую полость содержимого из пищевода. Этот симптом в основном возникает при наклоне больного вперед, но наиболее часто – во сне («синдром мокрой подушки»).
Снижение массы тела – неспецифичный симптом АКП (около 35%), так как данное заболевание развивается постепенно, длится, как правило, годами и за это время пациенты вырабатывают приспособительные методики, облегчающие прием пищи. Похудение больного при длительно текущей ахалазии должно настораживать из-за развития осложнений данного заболевания, а кроме того, рака пищевода [10]. По результатам 16 исследований, уровень заболеваемости раком пищевода у пациентов с ахалазией оценивается в 1,36 (95%-ный доверительный интервал (95% ДИ) 0,56–2,51) на 1000 человеко-лет, что более чем в 10 раз превышает общий уровень заболеваемости среди населения. Это объясняется длительным воспалением в пищеводе на фоне продолжительных застойных явлений в его просвете у больных с III–IV стадией заболевания [11].
При переполнении пищевода содержимым возникает боль по ходу пищевода, начиная со средней трети и ниже. Симптом купируется после срыгивания пищи или отрыгивания избыточно проглоченного воздуха либо постепенно стихает по мере прохождения пищи в желудок. Больные АКП могут жаловаться на изжогу, обусловленную образованием молочной кислоты при ферментативном расщеплении застойного содержимого в пищеводе. Стоит отметить, что жалобы на изжогу и боль по ходу пищевода при приеме пищи могут ложно трактовать как проявления гастроэзофагеальной рефлюксной болезни, что приводит к несвоевременной диагностике заболевания с развитием его осложнений: застойному эрозивно-язвенному, кандидозному эзофагиту, аспирационному синдрому. Респираторные симптомы встречаются у 40% больных АКП: у 37% из этих больных выявлен кашель, у 31% – аспирация, у 21% – осиплость голоса, у 12% – боль в горле, а 15% предъявляли жалобы на свистящее дыхание и затруднение вдоха [12].
Оценка тяжести клинических проявлений АКП до и после операции основывается на шкале Eckardt (таблица) и является критерием субъективной оценки эффективности проведенного лечения. Количество баллов 0–1 соответствует клинической стадии 0; 2–3 – I стадии; 4–6 баллов – II стадии, а более 6 баллов – III клинической стадии АКП [13].
Клинические стадии 0 и I свидетельствуют в пользу ремиссии заболевания и хорошо проведенной операции; II и III стадии указывают на необходимость обследования больного с последующим решением вопроса о тактике хирургического лечения либо о недостаточности проведенного оперативного вмешательства [14].
Диагностика
Дифференциальную диагностику АКП необходимо проводить с врожденными аномалиями пищевода, пептической стриктурой пищевода, неврогенной анорексией, доброкачественными и злокачественными опухолями пищевода, но наиболее часто – с кардиоэзофагеальным раком [1] и поражением пищевода при системной склеродермии. Сбор анамнеза заболевания обязательно должен включать информацию о приеме лекарственных препаратов, наркотических средств, в частности опиоидов, приводящих к нарушению моторики пищевода. На фоне употребления опиоидных наркотических средств у больных, по данным манометрии пищевода высокого разрешения, диагностируются эзофагоспазм, обструкция оттока через пищеводно-желудочный переход, ахалазия пищевода III типа или гиперконтрактильный пищевод [15].
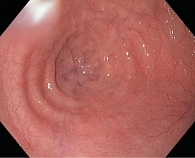
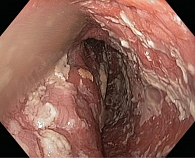
Для исключения органической патологии диагностику АКП необходимо начинать с выполнения эзофагогастродуоденоскопии (ЭГДС) с осмотром кардиального отдела желудка в инверсии. В клинической практике встречаются случаи, когда перед выполнением манометрии пищевода предоставляется описание ЭГДС с осмотром пищевода до места сужения, которое специалист не смог преодолеть. Подобная эндоскопическая картина, особенно в сочетании с коротким анамнезом возникновения дисфагии и снижением массы тела больного, должна насторожить врача в отношении исключения кардиоэзофагеального рака, так как при любой стадии АКП эндоскоп удается провести в желудок. Эндоскопическое исследование позволяет выявить сужение пищевода в области НПС (рис. 1) и его расширение над этой областью, ослабление перистальтики в нем, осложнения АКП, такие как застойный эзофагит, кандидоз (рис. 2), эрозивно-язвенные изменения слизистой пищевода.
Рентгенологическое исследование пищевода и желудка с пероральным контрастированием сульфата бария позволяет оценить расслабление кардии в ответ на глоток контрастного вещества, степень расширения пищевода и его форму (что лежит в основе классификации стадии АКП по Б.В. Петровскому, 1962 г.), тонус пищевода и наличие перистальтики в нем, а также время задержки эвакуации содержимого пищевода в желудок (ширина просвета пищевода и высота бариевого столба на первой и пятой минутах). В клинической практике приходится встречаться с описанием рентгенологического исследования больного АКП, в котором показано расширение пищевода, ослабление его тонуса и замедление эвакуации контрастного вещества из пищевода в желудок, но при этом отмечается зияние кардии, что противоречит диагнозу ахалазии. Данная рентгенологическая картина характерна для поражения пищевода при системной склеродермии.
Манометрия пищевода высокого разрешения является обязательным методом обследования больных при подозрении на ахалазию пищевода. Данный метод внес значительный вклад в понимание патологических процессов, происходящих при этом заболевании [16, 17]. На его основе в 2009 г. разработана Чикагская классификация нарушений моторики пищевода, в дальнейшем пересмотренная в 2015 и 2021 гг. [18]. Основными манометрическими характеристиками АКП являются отсутствие расслабления НПС (IRP (суммарное давление расслабления) выше 15 мм рт. ст.) и отсутствие перистальтики в теле пищевода. При этом давление покоя НПС может быть повышенным или в пределах нормальных значений (в норме – 10–35 мм рт. ст.) [19].
В зависимости от характера сокращений в теле пищевода, согласно Чикагской классификации, выделены три типа АКП. Первый тип (классическая ахалазия) – все сокращения имеют низкий сократительный интеграл (от 0 до 450, но чаще до 150 мм рт. ст. × см × с); мощность сокращения в теле пищевода низкая. Второй тип (ахалазия с тотальным повышением интраболюсного давления) – более 20% сокращений имеют нормальный сократительный интеграл, занимающий всю площадь сокращения от ВПС до НПС, – так называемая панэзофагеальная прессуризация. Сократительный интеграл – выше 450 мм рт. ст. × см × с. Третий тип (спастическая ахалазия) – в 20% сокращений и более есть участки повышения тонуса в теле пищевода. Они выглядят как преждевременные сокращения, но без перистальтической волны. Сократительный интеграл – выше 450 мм рт. ст. × см × с [6].
Комплексное обследование пациента с подозрением на ахалазию пищевода (ЭГДС, рентгенологическое исследование верхних отделов ЖКТ с пероральным контрастированием и манометрия пищевода высокого разрешения) – это залог успешного лечения, так как позволяет исключить другие заболевания, своевременно выявить осложнения, определить прогноз заболевания (наилучшие результаты лечения достигаются при ахалазии пищевода II типа по Чикагской классификации) [20, 21].
Компьютерная томография грудной и брюшной полостей и эндоскопическое ультразвуковое исследование показаны при подозрении на злокачественное новообразование.
Лечение
Лечение АКП является симптоматическим, способствует улучшению эвакуации содержимого пищевода в желудок благодаря восстановлению проходимости кардии и купированию симптомов заболевания.
Рекомендованная ранее консервативная терапия препаратами нитратов и антагонистами кальциевых каналов, согласно данным метаанализа исследований [22], мало эффективна, кроме того, препараты этих групп обладают побочными эффектами, что ограничивает длительность их применения.
На сегодняшний день существующие методики лечения АКП подразделяются на эндоскопические и хирургические вмешательства. Среди эндоскопических методов лечения выделяют инъекции ботулотоксина в область кардии, баллонную дилатацию кардии и пероральную эндоскопическую миотомию (ПОЭМ), в то время как к хирургическим методам относятся операция Геллера и экстирпация пищевода. Определяющими критериями при выборе метода лечения ахалазии являются показатели безопасности и эффективности на протяжении длительного времени.
Инъекция ботулотоксина в область кардии является наименее инвазивным оперативным методом лечения АПК. Предложенная методика имеет высокие показатели безопасности, однако эффективность данной техники ограничивает ее применение в качестве первой линии лечения АКП. Результаты, представленные Американским обществом гастроинтестинальной эндоскопии [23], подтверждают данное утверждение. По данным авторов, эффективность терапии ботулотоксином через шесть месяцев после проведенного лечения составляет 51,8%, через 12 месяцев – 37,5%.
В течение длительного времени ведущим методом лечения АКП являлась баллонная кардиопневмодилатация. Клинический эффект данной техники основан на механическом повреждении мышечного слоя области кардии в момент расправления дилатационного баллона воздухом. Этапное ее применение позволяет снизить показатели нежелательных явлений, однако неконтролируемое повреждение мышечных волокон и низкие отсроченные показатели эффективности не позволяют отнести данный метод к оптимальным. В актуальных рекомендациях Американского общества гастроинтестинальной эндоскопии [23] представлены результаты 53 научных исследований, демонстрирующих показатели эффективности баллонной дилатации через три и шесть месяцев после проведенного лечения, что сопровождалось снижением выраженности дисфагии (≤ 3 баллов по шкале Eckardt). В рекомендациях по лечению АКП Европейского общества гастроинтестинальной эндоскопии [24] отмечено, что доля развития перфорации пищевода при первичном применении дилатационного баллона диаметром 35 мм может достигать 31%. Кроме того, несмотря на соблюдение всех протоколов безопасного применения баллонной дилатации кардии, отмечается прогрессирующее снижение эффективности проведенного лечения на протяжении времени. P. Katsinelos и соавт. [25] сообщают, что эффективность после выполненной баллонной дилатации составила 78, 61 и 58,3% через 5, 10 и 15 лет соответственно, что, безусловно, может являться ограничивающим фактором применения данной техники.
Пациенты с IV стадией АКП по Б.В. Петровскому также имеют ряд клинических особенностей, обусловленных выраженными морфологическими изменениями пищевода. В клинических ситуациях, сопровождающихся отсутствием эффекта от выполненного эндоскопического и хирургического лечения, ряд авторов рассматривают экстирпацию пищевода как вариант радикального вмешательства. Д.В. Ручкин и соавт. [26] считают, что эзофагэктомия в качестве метода лечения пациентов с S-образным пищеводом и мегаэзофагусом является крайней мерой, ссылаясь на то, что данное заболевание является доброкачественным, с длительным течением и развитием персистирующих симптомов.
В течение длительного периода времени операцию Геллера в комбинации с различными вариантами антирефлюксных пластик использовали в качестве основного метода лечения ахалазии кардии. G.M. Campos и соавт. [27] представили результат применения операции Геллера у 3086 пациентов, средний период наблюдения составил 35,5 месяцев, при этом клинический эффект был отмечен в 89,3% наблюдений. Частота развития осложнений в послеоперационном периоде составила 6,5%. Внеслизистая эзофагокардиомиотомия, выполняемая в ходе оперативного вмешательства, является ключевым этапом хирургического лечения, определяющим его клинический эффект. В настоящее время в дополнение к эзофагокардиомиотомии общепринятым методом является формирование антирефлюксных манжет, среди которых наиболее широко применяются пластики по Тупе и Дору.
Пероральная эндоскопическая эзофагокардиомиотомия зарекомендовала себя в качестве основного метода лечения АКП. Этапы выполнения ПОЭМ включают формирование доступа в подслизистый слой пищевода, проведение пищеводной и желудочной миотомии, протяженность которой зависит от типа ахалазии пищевода. Заключительным этапом вмешательства является восстановление целостности стенки пищевода с помощью эндоскопических клипс. Несмотря на то что ПОЭМ является эндоскопическим аналогом операции Геллера, сравнение данных методик в настоящее время остается актуальным. В рамках рандомизированного многоцентрового исследования Y.B. Werner и соавт. [28] представили результаты сравнения ПОЭМ и операции Геллера с фундопликацией по Дору у 221 пациента с АКП. Эффективность через 24 месяца после проведенной ПОЭМ была отмечена в 83% наблюдений, в то время как после операции Геллера – в 81,7%. M. Ramchandani и соавт. [12] утверждают, что ПОЭМ менее инвазивна, чем операция Геллера, а кроме того, преимущество этого метода заключается в том, что он позволяет эндоскопическому хирургу регулировать длину и ориентацию миотомии в зависимости от типа АКП.
При сравнении этих двух методик нельзя не отметить, что пациенты с III типом ахалазии пищевода по Чикагской классификации являются особой группой пациентов. Протяженность пищеводной миотомии определяет эффективность оперативного лечения. В исследовании, представленном V. Kumbhari и соавт. [29], продемонстрированы результаты применения ПОЭМ и операции Геллера у пациентов с III типом АКП. После проведенной эндоскопической миотомии эффективность лечения была достигнута в 98% наблюдений, а в группе пациентов, которым была выполнена операция Геллера, данный показатель составил 80,8%.
Результаты длительного наблюдения за пациентами с различными типами ахалазии пищевода, которым была проведена ПОЭМ или кардиомиотомия, продемонстрировали A.J. Podboy и соавт. [30]: в группе больных с III типом ахалазии уровень успеха после ПОЭМ оказался выше, чем после кардиомиотомии: 53,3 в сравнении с 44,4% (р < 0,05). Эффект сохранялся в течение четырех лет. C. Andolfi и соавт. [31] продемонстрировали одинаково высокую эффективность ПОЭМ и кардиомиотомии у пациентов с II типом ахалазии, лучший эффект от кардиомиотомии был достигнут в группе с I типом (отношение шансов (ОШ) 2,97; 95% ДИ 1,09–8,03; p = 0,032), а ПОЭМ – с III типом (ОШ 3,50; 95% ДИ 1,39–8,77; p = 0,007). Худший эффект имеет кардиомиотомия и пневмодилатация при III типе АКП [32].
В Московском клиническом научном центре (МКНЦ) им. А.С. Логинова с 2014 г. по настоящее время проведено более 550 ПОЭМ по поводу АКП. В рамках научной программы через год после проведенного вмешательства больных приглашают для оценки эффективности лечения с установлением выраженности клинических проявлений заболевания по шкале Eckardt, выполнением ЭГДС, рентгеноконтрастного исследования пищевода и желудка, манометрии пищевода высокого разрешения. На рис. 3 представлена манометрическая картина больного ахалазией пищевода III типа по Чикагской классификации до операции и удовлетворительный результат показателей моторики после проведения ПОЭМ. Анализ манометрических показателей у пациентов с ахалазией пищевода до и после выполнения эндоскопической кардиомиотомии свидетельствует о снижении давления покоя НПС с 37,5 ± 18,3 до 17,2 ± 4,8 мм рт. ст. и его суммарного давления расслабления (IRP) с 21,6 ± 3,5 до 8,7 ± 2,3 мм рт. ст., а также о снижении мощности сокращения и дистального сократительного интеграла (DCI) с 1715 ± 1305 до 317 ± 230 мм рт. ст. × см × с. Клинические проявления АКП по шкале Eckardt после данной операции значительно снижаются.
Однако в ряде случаев после хирургического лечения больные АКП продолжают испытывать боль за грудиной и/или дисфагию. Причиной этого может быть недостаточная эффективность хирургического этапа лечения. Даже при адекватно выполненном хирургическом лечении возобновление жалоб на дисфагию может быть обусловлено резким изменением рациона питания пациентом, перенесшим кардиомиотомию (из-за приема твердой пищи, трудно проходящей по пищеводу, вследствие отсутствия в нем перистальтики). Боль за грудиной и регургитация могут быть следствием патологического гастроэзофагеального рефлюкса из-за рассечения НПС и нарушения антирефлюксных механизмов. Кроме того, сохранение жалоб и снижение качества жизни могут объясняться особенностями психоэмоциональной сферы и функционирования вегетативной нервной системы.
В МКНЦ им. А.С. Логинова проводится исследование личностных особенностей пациентов с АКП. Методика оценки стратегий совладающего поведения показала, что обследованные пациенты с ахалазией пищевода используют широкий спектр способов совладания со стрессом. Наиболее часто используемыми копинг-стратегиями являлись бегство-избегание и поиск социальной поддержки. Доминирование стратегии бегства-избегания предполагает попытки преодоления личностью негативных переживаний в связи с симптомами заболевания с помощью реагирования по типу уклонения: неоправданных ожиданий, отрицания, фантазирования. Стратегия поиска социальной поддержки может быть связана с опытом жизни с болезнью и осознанием необходимости обращения как за медицинской помощью, так и за эмоциональной и действенной поддержкой близких. Из-за чувства неуверенности в собственных силах вследствие болезни у пациентов могут формироваться ориентация на использование внешних ресурсов (помощь медицинского персонала), зависимость от окружающих, потребность в безусловной опеке и поддержке, отказ от принятия ответственности за преодоление жизненных трудностей [33].
Пациенты старшей группы (от 46 до 76 лет) уделяют больше внимания симптомам своего заболевания, склонны к фиксации внимания на состоянии своего организма и здоровья, поглощены обилием тревожащих ощущений, нежели пациенты в возрасте от 20 до 45 лет. Женщины в большей степени подвержены риску снижения социального функционирования. Пациенты с I типом ахалазии воспринимают свое заболевание как малопонятное, вследствие чего качество жизни этих пациентов значительно выше, чем у пациентов с II и III типами заболевания [33].
По данным методики многостороннего исследования личности, менее чем у половины пациентов были выявлены признаки нарушений, требовавшие консультации психиатра, в том числе повышение личностной тревожности, особенно в группе пациентов с гиперкинетическим вариантом АКП [6].
Клинический случай 1
Пациент Р., 1983 г.р., с диагностированной по данным ЭГДС и рентгенологического исследования ахалазией пищевода II стадии в сентябре 2022 г. направлен для проведения манометрии пищевода высокого разрешения в лабораторию функциональной диагностики заболеваний пищевода и желудка МКНЦ им. А.С. Логинова из другого лечебного учреждения перед проведением ПОЭМ.
По данным манометрии пищевода выявлены признаки ахалазии пищевода III типа: давление покоя НПС в пределах нормы – 26–35 мм рт. ст.; расслабление НПС недостаточное в 100% сокращений – IRP в среднем 25,3 мм рт. ст.; в теле пищевода все сокращения аперистальтические, из них 40% сокращений с панэзофагеальным нагнетанием, а 60% – имеют спастический компонент и повышенную мощность (DCI более 8000 мм рт. ст. × см × с) (рис. 4).
В феврале 2023 г. больному была выполнена ПОЭМ по поводу ахалазии пищевода II стадии III типа. Через один-два месяца после хирургического лечения возобновились жалобы на застревание пищи по ходу пищевода, боли за грудиной при ее прохождении, в связи с чем в лечебном учреждении, где проведена ПОЭМ, в августе 2023 г. выполнено рентгеноконтрастное исследование верхних отделов желудочно-кишечного тракта (ЖКТ), которое показало расширение пищевода на уровне бифуркации трахеи до 40 мм с воронкообразным сужением в области НПС; контуры пищевода нечеткие, волнистые; отмечались маятникообразные движения бариевой смеси по пищеводу; положительная проба Хурста (проваливание содержимого из пищевода в желудок). Пациенту выполнено четыре сеанса баллонной кардиодилатации, однако жалобы сохранялись. В сентябре 2023 г. проведена эндоскопия тонким эндоскопом (4,8 мм в диаметре), отмечено незначительное расширение пищевода, наличие равномерной перистальтики в нем; розетка кардии смыкается полностью, проходима без ощущения препятствия.
С подозрением на рецидив ахалазии больной направлен в лабораторию функциональной диагностики заболеваний пищевода и желудка МКНЦ им. А.С. Логинова для выполнения манометрии пищевода высокого разрешения. Это исследование показало удовлетворительное раскрытие НПС в 100% глотков (IRP в среднем 11,2 мм рт. ст.); в теле пищевода все сокращения аперистальтические, половина из них со спастическим компонентом в средней трети пищевода (см. рис. 4).
Рентгенологические данные (нечеткие волнистые контуры пищевода, маятникообразные движения контраста по ходу пищевода) косвенно свидетельствовали о наличии спастического компонента в теле пищевода, что соответствовало данным манометрии. Полученные результаты свидетельствуют о недостаточной протяженности выполненного рассечения мышечного слоя при ПОЭМ и указывают на необходимость выполнения повторной эндоскопической миотомии.
Клинический случай 2
Пациентку К., 1964 г.р., длительное время беспокоили жалобы на спастические боли в мезогастральной области, в эпигастрии и правом подреберье. Боль имела различную интенсивность, не зависела от приема и характера пищи, не была связана со стулом. Стул один раз в два дня на фоне приема слабительных, кал без патологических примесей. С 2019 г. к вышеперечисленным симптомам присоединились жалобы на спазм и затруднение прохождения пищи по ходу пищевода, в связи с чем выполнено рентгенологическое исследование верхних отделов ЖКТ и диагностирован диффузный эзофагоспазм. Был назначен Эглонил 50 мг два раза в день, на фоне терапии дисфагия была купирована.
В 2021 г. в связи с приступом болей в правом подреберье проведена экстренная холецистэктомия. Однако сохранялись жалобы на боли разной интенсивности в эпигастрии, правом подреберье и мезогастрии. Беспокоил метеоризм. С целью исключения органической патологии проводилось обследование: колоноскопия с осмотром терминального отдела подвздошной кишки (долихоколон, хронический геморрой), мультиспиральная компьютерная томография органов брюшной полости с контрастным усилением и магнитно-резонансная холангиопанкреатография, выявившие диффузные изменения печени и поджелудочной железы.
В ноябре 2021 г. после перенесенного COVID-19 дисфагия возобновилась и стала постоянной. Был вновь назначен Эглонил 50 мг два раза в день, однако терапия не имела эффекта. С целью обследования и подбора терапии больная направлена в МКНЦ им. А.С. Логинова, проведена восьмиканальная манометрия пищевода на аппарате «Гастроскан-Д», высказано подозрение на ахалазию пищевода III типа и рекомендовано дообследование – манометрия пищевода высокого разрешения с целью подтверждения диагноза. Пациентка консультирована неврологом МКНЦ им. А.С. Логинова, сформулирован диагноз: «Дисфункция вегетативной нервной системы. Дискинезия пищевода. Астено-невротический синдром», назначена комплексная шестимесячная психофармакологическая терапия, однако от предложенного лечения больная отказалась.
Сохраняющиеся жалобы (дисфагия, боли различной интенсивности в эпигастрии, правом подреберье и мезогастрии, метеоризм) обусловили дальнейший диагностический поиск. Изменения, выявленные при эндоскопии, соответствовали ахалазии пищевода; рентгенологическая картина свидетельствовала о наличии у больной кардиоспазма I стадии и диффузного эзофагоспазма. Клиническая оценка степени выраженности ахалазии по шкале Eckardt составила 5 баллов (симптоматическое течение). Была выполнена манометрия пищевода высокого разрешения, по результатам которой подтвержден диагноз ахалазии пищевода III типа (давление покоя НПС повышено (80–89 мм рт. ст.), расслабление НПС недостаточное в 100% глотков – среднее IRP – 29 мм рт. ст.; в теле пищевода 80% сокращений преждевременные с избыточной мощностью сокращений – среднее DCI 10 107 мм рт. ст. × см × с) (рис. 5).
В ноябре 2022 г. в МКНЦ им. А.С. Логинова проведена ПОЭМ по поводу ахалазии пищевода I стадии III типа. После выписки в декабре 2022 г. консультирована неврологом центра, сформулирован диагноз: «Синдром телесного дистресса с вовлечением ЖКТ, эпизодической инсомнией на фоне выраженного тревожного расстройства», назначено лечение (дулоксетин и гидроксизин). От рекомендованной терапии больная воздержалась, а по назначению лечащего врача по месту жительства курсами принимала Эглонил, амитриптилин.
В сентябре 2023 г. больная обратилась к гастроэнтерологу МКНЦ им. А.С. Логинова с жалобами на дискомфорт в мезогастральной области, эпизоды ноюще-спастических ощущений в подложечной области. Оценка дисфагии по шкале Eckardt – 1 балл (ремиссия заболевания). По данным ЭГДС, слизистая пищевода не изменена, перистальтика пищевода несколько усилена, кардия смыкается полностью, свободно проходима эндоскопом. Манометрия пищевода высокого разрешения показала, что в теле пищевода все сокращения одномоментные с нормальной мощностью сокращений (среднее DCI – 1090 мм рт. ст. × см × с), в 80% случаев – панэзофагеальное нагнетание. Давление покоя НПС по сравнению с предыдущим исследованием снизилось, однако сохранялось выше нормальных показателей (IRP – более 15 мм рт. ст.); в 50% глотков расслабление НПС на глоток в норме, но на 50% глотков расслабление наступало после сокращения в теле пищевода (создавалось впечатление о задержке раскрытия НПС) (см. рис. 5).
Для оценки моторно-эвакуаторной функции верхних отделов ЖКТ проведено рентгенологическое исследование с пероральным контрастированием, свидетельствовавшее о кардиоспазме I стадии по Б.В. Петровскому после ПОЭМ, диффузном эзофагоспазме I степени, дискинезии двенадцатиперстной кишки по гипермоторному типу с ускоренным транзитом. Терминальный отдел пищевода по типу «мышиного хвоста», контраст в желудок поступает порционно. Тонус пищевода в средней и нижней трети повышен, регистрируются фрагментарные спастические сокращения, перистальтика ослабленная. Высота бариевого столба на первой минуте после приема контрастного вещества – 110,7 мм, ширина просвета пищевода – 17 мм; на пятой минуте высота бариевого столба – 11,4 мм, ширина просвета – 14,5 мм (рис. 6).
Результаты комплексного обследования пациентки обсуждены коллегиально (гастроэнтерологом, эндоскопическим хирургом, рентгенологом), и принято решение, что, несмотря на сохраняющийся спастический компонент в пищеводе (по данным манометрии и рентгенологического исследования), от проведения повторной ПОЭМ в настоящее время следует воздержаться, так как имеющиеся у больной жалобы не характерны для ахалазии (Eckardt – 1 балл). Совокупность жалоб соответствует расстройству ЖКТ, обусловленному дисфункцией вегетативной нервной системы, в связи с чем необходимо проведение комплексного консервативного лечения, включающего психофармакотерапию.
Заключение
Ахалазия кардиальной части пищевода характеризуется постепенным развитием симптомов, которые могут неверно интерпретироваться больными, в результате чего они длительно не обращаются за медицинской помощью или пренебрегают назначенным лечением. Лечение АКП по сути является симптоматическим, это значит, что хирургическое вмешательство позволяет улучшить прохождение содержимого из пищевода в желудок, однако при этом перистальтика в нем не нормализуется. В этой связи оценка эффективности лечения должна основываться не только на динамике клинических проявлений по шкале Eckardt и включать весь комплекс диагностики АКП, а также сопутствующих заболеваний, способствующих снижению качества жизни больного.
Причиной возобновления симптомов после операции может быть неудачное хирургическое вмешательство, а также наличие комплекса сопутствующих заболеваний, обусловленных дисфункцией вегетативной нервной системы.
O.I. Berezina, PhD, I.S. Kanishchev, E.R. Valitova, PhD, I.A. Pavlov, PhD, D.S. Bordin, PhD, Prof., K.V. Shishin, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
Tver State Medical University
Russian University of Medicine, Moscow
Contact person: Olga I. Berezina, o.berezina@mknc.ru
Cardiomyotomy (in particular, oral endoscopic cardiomyotomy) is the most effective method of treating achalasia of the esophagus cardiac part, however, in some cases patient complaints persist or symptoms relapsed. This conditioned the need to perform the complex examination of a patient for the correct diagnostics of this disease, prognose assessment and treatment tactics determination as well as the identification of the causes of the persistence or resumption of clinical manifestations after surgical treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.