Анализ послеоперационных осложнений в кардио- и нейро-ангио-хирургической клинике: что остается вне поля зрения
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить любые отклонения от нормальных критериев в деятельности церебральной и сердечно-сосудистой систем в послеоперационном периоде, частоту их возникновения и влияние на течение послеоперационного периода.
Материал и методы. В исследование включено 2267 пациентов. Оцениваемыми конечными точками исследования были послеоперационные цереброваскулярные (ЦВО) и сердечно-сосудистые осложнения (ССО). Любые ЦВО и ССО составили группу ACVE (any cardio-vascular events). Статистический анализ проводился с использованием программы StatTech v. 3.1.6.
Результаты. Наряду с МАСЕ (major acute coronary events, major adverse cardiac events, major adverse cardiovascular events) был проведен анализ отклонений от нормальных значений в деятельности церебральной и сердечно-сосудистой систем в послеоперационном периоде: динамика электроэнцефалограммы (ЭЭГ), ST-T на электрокардиограмме, развитие острой или декомпенсация хронической церебральной недостаточности, развитие цереброваскулярных осложнений, послеоперационного делирия, когнитивных расстройств или сердечной недостаточности (СН), нарушения ритма и проводимости сердца, развитие эпизодов гипотонии или гипертонии, кровотечения, тромбоэмболические осложнения (ТЭО). В среднем было зарегистрировано два и более ССО. Сопоставление длительности госпитализации пациентов с ACVE, в частности с МАСЕ, ST-T на электрокардиограмме, СН, аритмией, эпизодами гипотонии или гипертонии, кровотечением, ТЭО, отклонениями на ЭЭГ, по данным ультразвуковой диагностики магистральных сосудов головного мозга, цереброваскулярными осложнениями, делирием и когнитивными расстройствами с показателями пациентов без таких осложнений выявило статистически значимые различия. ACVE составили в среднем по ЦВО и ССО 1/4 всех послеоперационных осложнений и 2/3 осложнений 2–5-й степени по классификации Клавьена – Диндо.
Заключение. Расширили понятие ЦВО и ССО, объединили в ACVE совокупность любых отклонений в деятельности цереброваскулярной и сердечно-сосудистой системы в послеоперационном периоде, подчеркнули не только клиническую значимость этих отклонений, но и экономическую целесообразность учета ACVE.
Цель – оценить любые отклонения от нормальных критериев в деятельности церебральной и сердечно-сосудистой систем в послеоперационном периоде, частоту их возникновения и влияние на течение послеоперационного периода.
Материал и методы. В исследование включено 2267 пациентов. Оцениваемыми конечными точками исследования были послеоперационные цереброваскулярные (ЦВО) и сердечно-сосудистые осложнения (ССО). Любые ЦВО и ССО составили группу ACVE (any cardio-vascular events). Статистический анализ проводился с использованием программы StatTech v. 3.1.6.
Результаты. Наряду с МАСЕ (major acute coronary events, major adverse cardiac events, major adverse cardiovascular events) был проведен анализ отклонений от нормальных значений в деятельности церебральной и сердечно-сосудистой систем в послеоперационном периоде: динамика электроэнцефалограммы (ЭЭГ), ST-T на электрокардиограмме, развитие острой или декомпенсация хронической церебральной недостаточности, развитие цереброваскулярных осложнений, послеоперационного делирия, когнитивных расстройств или сердечной недостаточности (СН), нарушения ритма и проводимости сердца, развитие эпизодов гипотонии или гипертонии, кровотечения, тромбоэмболические осложнения (ТЭО). В среднем было зарегистрировано два и более ССО. Сопоставление длительности госпитализации пациентов с ACVE, в частности с МАСЕ, ST-T на электрокардиограмме, СН, аритмией, эпизодами гипотонии или гипертонии, кровотечением, ТЭО, отклонениями на ЭЭГ, по данным ультразвуковой диагностики магистральных сосудов головного мозга, цереброваскулярными осложнениями, делирием и когнитивными расстройствами с показателями пациентов без таких осложнений выявило статистически значимые различия. ACVE составили в среднем по ЦВО и ССО 1/4 всех послеоперационных осложнений и 2/3 осложнений 2–5-й степени по классификации Клавьена – Диндо.
Заключение. Расширили понятие ЦВО и ССО, объединили в ACVE совокупность любых отклонений в деятельности цереброваскулярной и сердечно-сосудистой системы в послеоперационном периоде, подчеркнули не только клиническую значимость этих отклонений, но и экономическую целесообразность учета ACVE.
![Рис. 1. Послеоперационные осложнения с мая по сентябрь 2019 г. [20]](/upload/resize_cache/iblock/fe6/195_350_1/Usachev1.jpg)
![Рис. 2. Динамика послеоперационных осложнений за 6 месяцев наблюдения [20]](/upload/resize_cache/iblock/6a7/195_350_1/Usachev3.jpg)
![Рис. 3. Результаты проведенного лечения послеоперационных осложнений и показатели снижения частоты летальности [20]](/upload/resize_cache/iblock/00e/195_350_1/Usachev4.jpg)
Введение
Послеоперационные осложнения (ПО) приводят к снижению качества жизни пациента, увеличивают период его нетрудоспособности, а в ряде случаев сокращают продолжительность жизни. Все случаи, связанные с ПО, увеличивают экономические затраты на оказание повторной специализированной медицинской помощи. Анализ осложнений хирургических вмешательств представляет важную составляющую работы как в нейро-, так и в кардиохирургической клинике, особенно когда проводятся гибридные операции, ведь их результаты могут способствовать улучшению качества лечения и повышению благоприятного отдаленного прогноза и безопасности пациента [1–4]. Необходимость строгого учета и анализа ПО очевидна. Вместе с тем международной и российской общепризнанной системы регистрации и единой классификации таких ПО не существует, равно как и четких определений самих осложнений [2]. Отсутствие единой, принятой профессиональным сообществом классификации послеоперационных неблагоприятных событий обусловлено разным подходом к определению ПО в нейрохирургии и кардиохирургии, трудностями в согласовании терминологии. В результате не представляется возможным однозначно сопоставлять негативные исходы, осложнения и последствия хирургического лечения [5]. Сравнительный анализ осложнений в разные периоды времени в одной или нескольких специализированных хирургических лечебных организациях затруднен в силу отсутствия единой стандартизированной системы регистрации осложнений [3, 6].
Стандартизация технологий регистрации осложнений – результат скрупулезной систематизации неблагоприятных событий, факторов их риска, явных причин и последствий в клинике. Одним из пионеров в изучении проблемы ПО в отечественной медицине был Н.И. Пирогов. Часть его научных работ посвящена подробному описанию осложнений, с которыми он лично сталкивался в хирургической практике [7]. В зарубежной литературе хирургические осложнения впервые были классифицированы американским хирургом E. Codman [8]. В отдельных публикациях осложнения условно подразделяют на хирургические (возникающие непосредственно в результате оперативных вмешательств) и нехирургические, однако формальная граница между этими понятиями отсутствует. Послеоперационная пневмония, тромбоэмболия легочной артерии и тромбоз глубоких вен могут быть отнесены разными авторами как к хирургическим, так и к нехирургическим осложнениям. В 1992 г. P. Clavien и соавт. предложили классификацию осложнений в общей хирургии, основанную на четырех градациях степени их тяжести [9]. Все неблагоприятные события авторы разделили на осложнения, недостижение цели лечения и последствия. Осложнение было определено как любое непредвиденное отклонение от нормального течения послеоперационного периода. Это определение также учитывало бессимптомные осложнения, такие как аритмия или ателектаз. Последствие – состояние, неизбежно возникающее после операции как естественная реакция на нее (например, неспособность ходить после ампутации ноги). Состояние, при котором осложнения или неблагоприятного последствия не произошло, но первоначальная цель операции не достигнута, трактовалось как недостижение цели лечения (например, остаточная опухоль после операции). Эта работа демонстрирует попытку формально определить осложнение, выделив его среди прочих патологических состояний.
Несколько позже D. Dindo и соавт. модифицировали данную классификацию, предложив пятиуровневую систему с несколькими подуровнями, в первую очередь ориентированную на вид лечения, необходимый при возникновении осложнения [5].
Л.Б. Лихтерман предложил определять осложнение при черепно-мозговой травме как патологический процесс, присоединившийся к травме головного мозга и его покровов, но не облигатный, а возникающий под воздействием дополнительных экзогенных и эндогенных факторов [10]. Данное определение осложнения можно считать справедливым и применимым как при нейрохирургических, так и кардиохирургических заболеваниях. Однако поскольку патофизиология многих осложнений полностью не изучена, даже при формальном определении осложнений проблема недооценки их последствий для пациента и клиники остается значимой [11].
Существуют альтернативные подходы к определению осложнений. В 2001 г. M. Bonsanto и соавт. стандартизировали общие неблагоприятные послеоперационные события в нейрохирургии и разделили их на три группы: осложненный послеоперационный период, осложнения, связанные с нейрохирургией, и нехирургические осложнения [3]. В 2009 г. K. Houkin и соавт. представили подход, в рамках которого неблагоприятные события классифицировались исходя из предсказуемости и возможности предотвращения [12]. В 2010 г. B. Ledube и соавт. провели опрос 200 спинальных нейрохирургов, чтобы иметь представление об их понимании осложнений. На основании результатов анкетирования осложнения были разделены на крупные и малые [13].
В исследовании F. Ibanez и соавт. впервые в нейрохирургии была предпринята попытка создать системную специализированную классификацию осложнений как любых отклонений от нормального течения послеоперационного периода на протяжении 30 дней. Кроме того, нехирургические осложнения рассматривались как неблагоприятные события, напрямую не связанные с операцией или хирургической техникой (например, пневмония, желудочно-кишечное кровотечение, инфекции мочеполовой системы) [14]. Тем не менее эта классификация не получила широкого распространения, а ее потенциальная универсальность подверглась обоснованной критике в профессиональной среде.
Разные подходы к определению и классификации осложнений объясняет отсутствие общепринятых инструментов для их регистрации и анализа. В связи с этим совершенствование подходов к проспективному мониторингу осложнений, связанных с нейро- и кардиохирургическим лечением, является актуальным в комплексе мер обеспечения безопасности высокотехнологичной медицинской помощи.
В настоящее время для оценки хирургических послеоперационных осложнений применяется классификация Клавьена – Диндо (Clavien – Dindo), согласно которой к послеоперационным хирургическим осложнениям относят любое отрицательное событие, возникшее во время госпитализации [15]. Вместе с тем размер экономических затрат в случае повторного хирургического лечения зависит в том числе от тяжести послеоперационных осложнений, что отражается преимущественно в увеличении длительности срока госпитализации [16]. Следует отметить, что даже осложнения 1-й степени, согласно усовершенствованной классификации Клавьена – Диндо, удваивают послеоперационные расходы [17]. Для определения серьезных неблагоприятных сердечно-сосудистых и цереброваскулярных событий (major adverse cardiac events, major acute coronary events, major adverse cardiovascular events – МАСЕ) в послеоперационном периоде в клинических исследованиях принято рассматривать совокупность трех конечных точек: госпитальной сердечно-сосудистой смерти, инфаркта миокарда и ишемического инсульта.
Анализ 58 рандомизированных исследований, опубликованных в MEDLINE и EMBASE в 2010–2020 гг., показал, что только в 13,8% исследований использовали три перечисленные комбинированные конечные точки, в 15,5% случаев – инфаркт миокарда и инсульт. В 51,7% исследований среди дефиниций МАСЕ рассматривали нестабильную стенокардию, сердечную недостаточность (СН), реваскуляризацию миокарда, нарушения ритма сердца и проводимости, тромбоэмболические события [18].
Наблюдаемые в последние десятилетия тенденции к снижению MACE до 1,4–0,5% [19] и увеличение количества исследований, которые не ограничиваются анализом трех общепризнанных дефиниций, свидетельствуют о необходимости анализа более широкого спектра конечных точек, характеризующих послеоперационные сердечно-сосудистые и цереброваскулярные осложнения, влияющие на послеоперационное течение полиморбидных заболеваний. Отсутствие единого подхода к стандартизации послеоперационных цереброваскулярных осложнений (ЦВО) и сердечно-сосудистых осложнений (ССО) затрудняет оценку и сравнение их между специализированными хирургическими центрами и в разных исследованиях. В связи с этим совершенствование подходов к проспективному мониторингу осложнений, связанных как с нейрохирургическим, так и кардиохирургическим лечением, является актуальным в комплексе мер обеспечения безопасности высокотехнологичной медицинской помощи.
Цель – изучить тяжесть и частоту развития послеоперационных осложнений и разработка критериев их оценки.
Материал и методы
Проведено двухцентровое когортное ретроспективное исследование базы данных пациентов, которым были выполнены внесердечные оперативные вмешательства в 2018–2020 гг. Данные о демографических, клинических характеристиках пациентов и проведенном оперативном вмешательстве получены из бумажной формы стационарной истории болезни пациентов, оперированных с 2019 по 2020 г. Из стационарных историй болезни отобрано 2267 пациента. Средний возраст составил 59 лет, интерквартильный размах (Q25–Q75) – 45–68 лет. Женщин насчитывалось 845, мужчин – 1422. Среди хронических неинфекционных заболеваний хронические болезни системы кровообращения составляли 89,1%, хронические болезни органов дыхания – 14,3%, новообразования – 16,3%, сахарный диабет 2-го типа – 21,8%. Пациенты с хроническими сердечно-сосудистыми заболеваниями (ССЗ) в 95% случаев принимали постоянную базисную терапию: бета-блокаторы – 32%, ингибиторы ангиотензинпревращающего фермента/антагонисты рецепторов ангиотензина II – 54%, блокаторы кальциевых каналов – 17%, антитромбоцитарные препараты – 25%, антикоагулянты – 9% случаев. В 2765 (92,3%) случаях оперативные вмешательства проводились в плановом порядке, в 225 (7,7%) – в экстренном. Область оперативного вмешательства представлена следующим спектром: 21,6% – ангиологические операции реваскуляризации, 17,0% – реконструктивные сосудистые, 14,8% – нейрохирургические, 12,7% – гибридные цереброкардиальные операции реваскуляризации, 10% – нейро-/кардиохирургические, 3,5% – кардиохирургические сосудистые, 3% – нейрохирургические, 17,4% – протезирование и реконструкция клапанов сердца.
При оперативных вмешательствах использовались следующие виды анестезии: комбинированная общая – 36,5% случаев, сочетанная – 63,5%. Средняя длительность стационарного лечения составила 14 дней (Q25–Q75 – 3–11). Хирургические осложнения оценивались по классификации Клавьена – Диндо, согласно которой к осложнениям 1-й степени относятся любые отклонения от нормы в послеоперационном периоде, не требующие хирургического, эндоскопического и радиологического вмешательств. Этим пациентам проводилась симптоматическая консервативная терапия, включая антибактериальную терапию раневой инфекции. Осложнениями 2-й степени считались случаи, которые требовали расширения объема медикаментозной терапии, переливания крови и парентерального питания. При повторных оперативных вмешательствах данные случаи расценивались как осложнения степени 3а и 3b соответственно. Осложнения 4-й степени, при которых необходимо пребывание пациента в отделении интенсивной терапии, были подразделены на 4a – с недостаточностью функции одного органа и 4b – с полиорганной недостаточностью. Летальный исход расценивали как осложнения 5-й степени. Оцениваемыми конечными точками исследования были послеоперационные ЦВО и ССО на госпитальном этапе. Выполнен анализ более широкого спектра показателей деятельности нейро-/цереброваскулярной и сердечно-сосудистой систем, чем общепринятые дефиниции МАСЕ. По аналогии с классификацией хирургических осложнений Клавьена – Диндо анализировали все отклонения деятельности цереброваскулярной и сердечно-сосудистой систем от нормальных значений в послеоперационном периоде как любые ЦВО и ССО (any cardio-vascular events – ACVE): динамику на электроэнцефалограмме (ЭЭГ), кровоснабжение по данным ультразвуковой диагностики магистральных сосудов головного мозга, развитие острой или декомпенсацию хронической цереброваскулярной болезни – ЦВО, послеоперационный делирий, когнитивные нарушения, ST-T на электрокардиограмме (ЭКГ) (рассматривалось как миокардиальное повреждение в случае повышения уровня сердечного тропонина (cTn) и как ЭКГ-изменения ST-T в отсутствие повышения уровня cTn), развитие острой или декомпенсацию хронической цереброваскулярной и/или сердечной недостаточности, нарушения ритма и проводимости сердца, включая пароксизмы фибрилляции предсердий, суправентрикулярной тахикардии, частой желудочковой экстрасистолии 3-го и более класса по Лауну, впервые зарегистрированные нарушения проводимости или прогрессирование ранее имевшейся степени нарушений проводимости сердца, развитие эпизодов гипотонии (снижение систолического артериального давления (САД) менее 90 мм рт. ст.) или гипертонии (повышение САД более 160 мм рт. ст.), кровотечения (кровопотеря > 500 мл), тромбоэмболические осложнения (ТЭО), в том числе тромбоз глубоких вен и/или тромбоэмболия легочной артерии. Указанные изменения со стороны цереброваскулярной и сердечно-сосудистой систем в совокупности с MACE составили группу ACVE. В послеоперационном периоде в динамике оценивали показатели кардиоспецифических тропонинов (сTnI, сTnT), маркеров воспаления, включая трансаминазы, креатинин и мочевину, проводились коагулограммы, регистрация и анализ ЭКГ, инструментальные исследования сердечно-сосудистой системы (эхокардиография, холтеровское мониторирование ЭКГ, суточное мониторирование АД, цветное дуплексное сканирование артерий или вен, рентгенологическое исследование органов грудной клетки). В соответствии с целью исследования, протокол включал оценку влияния осложнений на послеоперационное течение заболевания. Проведено сравнение продолжительности послеоперационного стационарного лечения у пациентов без послеоперационных осложнений и при развитии хирургических ЦВО и ССО. Проанализированы значимость АСVE в структуре ПО и влияние на длительность госпитализации. Статистический анализ проводили с использованием программы StatTech v. 3.1.Категориальные данные описывались с указанием абсолютных значений и процентных долей. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка (при числе исследуемых менее 50) или критерия Колмогорова – Смирнова (при числе исследуемых более 50). При отличии распределения от нормального количественные данные описывались с помощью медианы (Me) и интерквартильного размаха (Q25–Q75). Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия χ² Пирсона (при значениях ожидаемого явления более 10), точного критерия Фишера (при значениях ожидаемого явления менее 10). Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применяли метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
Результаты
В НМИЦ нейрохирургии им. акад. Н.Н. Бурденко разработаны модель и технология непрерывной регистрации и анализа данных ПО на основании современных информационных технологий [20]. В исследуемой когорте пациентов в 42,3% случаев послеоперационный период протекал без особенностей, согласно усовершенствованной классификации Клавьена – Диндо, в 34,2% случаев требовалась консервативная симптоматическая терапия, в 21,8% применялся более широкий спектр медикаментозных препаратов и гемотрансфузии. В пяти случаях проведено повторное хирургическое вмешательство, в 2,4% – заместительная терапия в связи с органной недостаточностью. В 0,1% случаев зарегистрирован летальный исход (рис. 1) [20]. Предлагаемый подход предусматривает условное разделение осложнений на два вида: хирургические – отклонения от нормального течения послеоперационного периода, связанные с операцией и хирургической техникой; нехирургические – неблагоприятные события, напрямую не связанные с выполнением операции и применением хирургической техники. Для эксплуатации системы предлагается мониторинг возможных случаев неблагоприятных событий: инфекционных осложнений (в том числе менингитов, инфекций дыхательных путей, кровотока, мочевыводящих путей) – инфекции, возникающие в послеоперационном периоде; послеоперационных гематом, потребовавших ревизии, – скопление крови в ложе удаленной опухоли, веществе головного мозга, желудочках головного мозга, являющееся причиной нарастания неврологического дефицита, развития дислокационного синдрома или окклюзионной гидроцефалии; раневой ликвореи – состояние, характеризующееся истечением спинномозговой жидкости (ликвора) из полости черепа или спинномозгового канала вследствие нарушения целостности твердой мозговой оболочки и костных структур основания черепа; несостоятельности послеоперационной раны – расхождение ее краев; тромбоэмболии легочной артерии – окклюзия одной или более легочных артерий тромбами любого происхождения, чаще образующимися в крупных венах нижних конечностей или малого таза; острого коронарного синдрома – любая группа клинических признаков или симптомов, позволяющих подозревать нестабильную стенокардию или острый инфаркт миокарда; острого нарушения мозгового кровообращения (инсульт) – осложнение, характеризующееся внезапным появлением очаговой и/или общемозговой симптоматики вследствие развития церебральной ишемии; появление пролежня – омертвление (некроз) мягких тканей в результате постоянного давления, сопровождающегося местным нарушением кровообращения и нервной трофики. Помимо перечисленных неблагоприятных событий модель данных предусматривает дополнительное поле для регистрации любых нежелательных явлений (не входящих в список), которые эксперты сочтут значимыми. Предполагается, что нередко встречающиеся осложнения, зарегистрированные в неструктурированном виде, будут добавлены к формализованному списку осложнений для их последующего мониторинга. Для организации процесса мониторинга осложнений представляется целесообразным создание в медицинском центре группы внутреннего аудита (по одному ответственному сотруднику от каждого клинического отделения), задача которой в непрерывном режиме регистрировать возникновение осложнений и результаты лечения. Регистрационная карта для сбора данных внутри стационара должна включать как минимум три раздела: регистрационные данные пациента, информация о случае заболевания и появившегося осложнения, исходе лечения осложнения и исходе госпитализации. В разделе «исход лечения осложнения» должны быть указаны наименование осложнения в соответствии с согласованным списком, дата и кратность его возникновения, отметка о проведении операции и дополнительного лечения осложнения, обратимость последствий неблагоприятного события, информация об увеличении срока госпитализации, необходимости перевода в отделение реанимации и интенсивной терапии, взаимосвязь осложнения с летальным исходом. В разделе «исход госпитализации» собирается информация об исходе госпитализации (например, улучшение/без динамики/ухудшение/ летальный исход), а также о дате выписки пациента из стационара, количестве проведенных койко-дней.
Непрерывная регистрация данных позволит ежемесячно и ежеквартально формировать отчет по показателям осложнений и летальных исходов. Периодическая формализация наименований осложнений, регистрируемых в поле «другое», позволит постепенно расширить перечень патологических состояний, идентифицируемых как осложнение, и внести соответствующие коррективы в модель регистрируемых данных. Информация, полученная в ходе мониторинга, будет представляться в виде отчетов. Количество осложнений рассчитывается на 1000 операций (рис. 1).
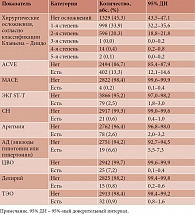
Значимые послеоперационные осложнения развились у 0,2% из 2267 прооперированных пациентов. Зарегистрировано семь случаев развития острого нарушения мозгового кровоснабжения по ишемическому типу на вторые сутки. В 6,3% случаев зафиксированы колебания САД от 90 до более чем 160 мм рт. ст., в 2,6% – нарушения ритма и проводимости сердца, в 2,4% – кровотечения, в 2,3% – ЭКГ-изменения с депрессией сегмента SТ-Т, в 1,1 % – тромбоэмболии. В 0,3% случаев отмечались изменения на ЭЭГ в виде дезорганизованного альфа-ритма, появления быстрых волн, иногда заостренных и медленных колебаний, десинхронизации и уплощения ЭЭГ, возникновение при тромбозах или стенозах церебральных артерий появление медленных волн θ- и δ-диапазона, генерализованных билатерально-синхронных медленных волн или десинхронизации с диффузной бета-активностью, соответствующие поражению стволовых неспецифических ретикулярных систем мозга. У 17,5% пациентов зарегистрировано два и более ССО. Частота развития послеоперационных осложнений представлена в табл. 1. Как видно из представленных данных, предлагаемая технология мониторинга ПО позволяет проводить анализ неблагоприятных событий за произвольный отчетный период и оценивать динамику развития осложнений и их последствия (рис. 2 и 3).
Следует отметить, что АСVЕ чаще развивались у пациентов старше 62 лет, что соответствовало наибольшему значению индекса Юдена, выше которого прогнозировались ACVE с чувствительностью модели 61% и специфичностью 59,1%. У лиц с сердечно-сосудистыми заболеваниями шансы развития послеоперационных ССО были в 2,5 раза выше по сравнению с пациентами без таких заболеваний. Различия шансов были статистически значимы (95%-ный доверительный интервал (ДИ) 1,695–2,643). В случае экстренных оперативных вмешательств шансы ACVE были в 1,8 раза выше по сравнению с плановыми вмешательствами (95% ДИ 1,274–2,516). Получены достоверные различия продолжительности стационарного лечения пациентов с 1-й, 2-й и 4-й степенями осложнений, согласно классификации Клавьена – Диндо, по сравнению с группой пациентов без осложнений (p < 0,001), причем продолжительность госпитализации возрастала с увеличением степени осложнения.
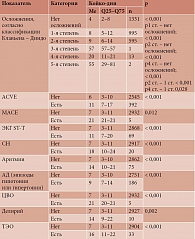
Сопоставление длительности госпитализации пациентов с ACVE, включая MACE, отклонениями ЭЭГ, ЭКГ ST-T, СН, аритмией, эпизодами гипотонии или гипертонии, кровотечением, ТЭО, ЦВО, делирием с параметрами пациентов без таких осложнений выявило статистически значимые различия. Развитие любых осложнений после операций сопровождалось увеличением продолжительности стационарного лечения. Обращает на себя внимание тот факт, что ACVE с высокой степенью достоверности существенно влияли на увеличение срока госпитализации. Проведенный анализ любых отклонений от нормальных значений показателей деятельности цереброваскулярной и сердечно-сосудистой систем в послеоперационном периоде показал, что в исследуемой группе 399 (13,4%) пациентов имели ACVE, которые составили около 1/4 всех послеоперационных хирургических осложнений и 2/3 осложнений 2–5-й степени по классификации Клавьена – Диндо, требовали медикаментозной коррекции и других методов лечения, влияли на увеличение продолжительности стационарного лечения. В таблице 2 представлены результаты сравнительного анализа длительности госпитализации в зависимости от развития послеоперационных осложнений.
В зависимости от сложности операции частота хирургических ПО варьируется от 10,7 до 71,4% [14]. Согласно классификации Клавьена – Диндо, в нашем исследовании частота хирургических ПО составила 54,7%, причем на долю осложнений 4-й и 5-й степени пришлось лишь 0,5% (рис. 1). МАСЕ ассоциируются с тяжелыми осложнениями по классификации Клавьена – Диндо. Попытки проанализировать не только МАСЕ после некардиальных операций предпринимались многими исследователями. Согласно результатам проспективного когортного исследования VISION (Vascular Events in Noncardiac Surgery Patients Cohort Evaluation (VISION) Substudy), восемь факторов независимо ассоциировалиcь с 30-дневной послеоперационной смертностью вследствие тяжелого кровотечения (15,6%), миокардиального повреждения (13,0%), сепсиса (4,5%), инфекционных осложнений без сепсиса (5,4%), острого повреждения почек (0,3%), инсульта (0,3%), венозных тромбоэмболий (0,7%), декомпенсации сердечной недостаточности (0,9%), впервые зарегистрированных клинически значимых эпизодов фибрилляции предсердий (ФП) (0,9%). При этом первые три осложнения были причиной 44,9% летальных исходов [1]. В исследовании c участием пациентов старше 65 лет с кардиальными заболеваниями установлено, что пациенты с любыми отклонениями на ЭКГ имели повышенный риск развития ССО после плановых абдоминальных операций [1]. В исследовании BASEL-PMI (Basel Incidence, Patient Characteristics, Outcome and Possible Strategies to Improve Outcome of Perioperative Myocardial Injury After Non-cardiac Surgery) отмечено, что у пациентов, перенесших внесердечную операцию, развитие миокардиального повреждения ассоциируется с увеличением 30-дневной смертности, по сравнению с пациентами без данного осложнения (8,9 и 1,5% соответственно) [13]. Ряд исследователей отмечают увеличение частоты развития ФП после некардиальных операций в 0,8–28% случаев. При этом наблюдается влияние этого нарушения ритма на трехкратное увеличение риска развития инсульта в течение 30 дней и 30-дневной смерти от всех причин [14]. Инсульт ассоциированный с ФП у пациентов, подвергшихся экстракардиальным операциям развивается чаще, чем у пациентов, перенесших операцию на сердце, в частности, аорто-коронарного шунтирования (отношение рисков (ОР) 2,00; 95% ДИ 1,70–2,35 и ОР 1,20; 95% ДИ 1,07–1,34 соответственно) [15]. Послеоперационная ФП связана с увеличением длительности пребывания в стационаре и экономических затрат [16]. Нередко без должного внимания и адекватной медикаментозной коррекции остаются колебания АД в периоперационном периоде, в частности среднее АД < 65 мм рт. ст. интраоперационно или АД < 90 мм рт. ст. в палатах интенсивной терапии. Тем не менее в рандомизированных исследованиях отмечаются сильные корреляции между гипотензией и повреждением миокарда, острым повреждением почек и смертью [17]. Оценка риска развития кровотечения или тромботических осложнений особенно актуальна у пациентов с кардиальными заболеваниями в периоперационном периоде при некардиальных вмешательствах и требует участия мультидисциплинарной бригады для выработки тактики ведения пациентов с соблюдением баланса в коррекции системы гемостаза [18, 19]. С одной стороны, прием антитромбоцитарных, антикоагулянтных препаратов наряду с нестероидными противовоспалительными препаратами в периоперационном периоде нередко увеличивает риск кровотечения, с другой - преждевременное прекращение двойной антитромбоцитарной и антикоагулянтной терапии после имплантации коронарного стента способно привести к тромбообразованию и желудочно-кишечному кровотечению. Как показывают результаты исследования, несмотря на проводимую профилактику тромбообразований, более чем у 9 млн пациентов, подвергшихся некардиальным хирургическим вмешательствам, доля фатальных ТЭО с 2005 по 2013 г. снизилась с 9,2 до 6,9%, но выросла доля нефатальных ТЭО с 0,09 до 0,1%. Развитие ТЭО ассоциируется с увеличением срока госпитализации с 3 до 11 дней и увеличением смертности до 8,2% по сравнению с 1,5% у пациентов без ТЭО [19]. Гипо- и гипертензия рассматривается в числе основных причин послеоперационного делирия. Послеоперационный делирий диагностируют в 12–35% случаев, что коррелирует с увеличением продолжительности стационарного лечения, 3%-ной смертностью в течение 60 дней после операции при плановых некардиальных операциях. Очевидно то, что выделение ACVE и расширенного спектра цереброваскулярных и сердечно-сосудистых осложнений способствовало бы проведению новых проспективных исследований для выявления факторов риска данных осложнений, организации мер предупреждения, своевременного лечения, повышению эффективности некардиального оперативного вмешательства, снижению экономических затрат на лечение и повторные операции.
Заключение
Как показывает анализ литературы, проблема регистрации и оценки хирургических осложнений актуальна для хирургов всех профилей. Скрупулезность учета осложнений, к сожалению, редкая, но крайне важная характеристика работы современной хирургической клиники. Трудность анализа осложнений в нейро-, ангио- и кардиохирургии заключается в отсутствии единого подхода, одобренного профессиональным сообществом. Основными проблемами, связанными с регистрацией ПО в нейро-, ангио- и кардиохирургии, являются отсутствие однозначной терминологии и классификаций, а также неявное разграничение понятий «осложнение», «последствие» и «исход». Очевидно, что абсолютно все отклонения от обычно протекающего послеоперационного периода должны исходно рассматриваться как потенциальные осложнения, даже если они протекают бессимптомно и спонтанно разрешаются. Любое неблагоприятное событие независимо от того, хирургическое оно или нехирургическое, должно учитываться в системе регистрации. Термины «послеоперационные церебральные или кардиальные осложнения» не имеют стандартного определения и в разных исследованиях используются вариабельно. Отсутствие стандартных подходов к учету ПО ставит под сомнение возможность обоснованно использовать для сравнения результаты исследований и показатели различных медицинских организаций. Многочисленные, но при этом разрозненные исследования свидетельствуют о клинических и экономических последствиях послеоперационных осложнений независимо от локализации, а проводимые мероприятия направлены на снижение частоты МАСЕ. В данном исследовании мы впервые под понятием послеоперационные ССО (ACVE) объединили любые отклонения в деятельности цереброваскулярной и сердечно-сосудистой систем в послеоперационном периоде. Расширили понятие послеоперационных нейро-/цереброваскулярных и сердечно-сосудистых осложнений, внесли в категорию ACVE совокупность любых отклонений в полиорганной деятельности в послеоперационном периоде, подчеркнули не только клиническую значимость этих отклонений, но и экономическую целесообразность учета ACVE. Установлено, что частота развития ACVE значительно превышает МАСЕ, причем тенденция снижения МАСЕ не распространяется на многие другие ACVE, частота которых остается на прежнем уровне или имеет тенденцию к росту. Развитие любых ACVE приводит к удлинению стационарного лечения и неминуемо влечет за собой рост экономических затрат на лечение. Именно поэтому необходимо учитывать ПО исходя из более широкого спектра ACVE, не ограничиваясь МАСЕ.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
D.Yu. Usachev, B.S. Dombaanai, A.N. Lischuk, О.Sh. Oynotkinova, A.G. Nazarenko, V.N. Shimansky, N.A. Konovalov, O.I. Sharipov, G.V. Danilov, M.A. Stepanyan
N.N. Burdenko National Medical Research Center of Neurosurgery
Scientific Research Institute of Health Organization and Medical Management of the Department of Health of the City of Moscow
National Medical Research Center for High Medical Technologies – A.A.Vishnevsky Central Military Clinical Hospital of the Ministry of Defense of the Russian Federation
Russian State Social University
N.N. Priorov National Medical Research Center of Traumatology and Orthopedics
Clinical hospital № 1 of Department of Presidential Affairs
Contact person: Bayir S. Dombaanai, DombaanayBS@zdrav.mos.ru
The problem of analyzing postoperative complications in cardio- and neurosurgical clinics remains debatable, this requires the development of technology for recording postoperative adverse events, as well as the creation of a classification scheme for postoperative complications. Unified approaches to the analysis of complications will allow you to generate reports in a single key using the same criteria, thereby providing the opportunity to assess and predict the frequency and potential causes of certain complications in the early and long-term periods, both in the same clinic at different time intervals and between different medical organizations. The objectives of all cardio- and neuro-surgical clinics are to reduce the number of complications and improve treatment outcomes. Purpose to evaluate any deviations from normal criteria in the activity of the cerebral and cardiovascular systems in the postoperative period, the frequency of occurrence and the effect on the course of the postoperative period.
Material and methods. The study included 2267 patients. The estimated endpoints of the study were postoperative cerebrovascular and cardiovascular complications. Any cerebrovascular and cardiovascular complications made up the ACVE (any cardio-vascular events) group. The statistical analysis was carried out using the StatTech v. 3.1.6 program.
Results. Along with the IACE (major acute coronary events, major adverse cardiac events, major adverse cardiovascular events), an analysis of deviations from normal values in the activity of the cerebral and cardiovascular systems in the postoperative period was carried out: the dynamics of the electroencephalogram (EEG), ST-T on the electrocardiogram, the development of acute or decompensation of chronic cerebral insufficiency, the development of cerebrovascular complications, postoperative delirium, cognitive disorders or heart failure (HF), cardiac arrhythmias and conduction disorders, the development of episodes of hypotension or hypertension, bleeding, thromboembolic complications (TEO). On average, two or more MTRS were registered. A comparison of the duration of hospitalization of patients with ACVE, in particular with MAS, ST-T on an electrocardiogram, HF, arrhythmia, episodes of hypotension or hypertension, bleeding, feasibility study, EEG abnormalities, according to ultrasound diagnostics of the main vessels of the brain, cerebrovascular complications, delirium and cognitive disorders in comparison with groups of patients without such complications revealed statistically significant differences. ACVE averaged 1/4 of all postoperative complications and 2/3 of complications of the 2nd-5th degree according to the Clavien – Dindo classification for cerebrovascular and cardiovascular complications.
Conclusion. We expanded the concept of cerebrovascular and cardiovascular complications, combined in ACVE the totality of any deviations in the activity of the cerebrovascular and cardiovascular systems in the postoperative period, emphasized not only the clinical significance of these deviations, but also the economic feasibility of accounting for ACVE. Keywords: postoperative complications, neurosurgery, cardiac surgery, cerebrovascular and cardiovascular complications, technology of registration of complications, adverse events
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.