Диагностика острых воспалительных демиелинизирующих заболеваний нервной системы: синдром Миллера-Фишера
- Аннотация
- Статья
- Ссылки
- English
Введение
Триада атаксии, арефлексии и офтальмоплегии была впервые описана Дж. Коллиером в 1932 г. В 1956 г. в трех клинических случаях Ч. Миллер Фишер рассмотрел ее как вариант синдрома Гийена – Барре (СГБ) [1]. Фишер признал уникальность этого кластера клинических признаков и его связь с тем, что сейчас считается гетерогенной группой иммуноопосредованных невропатий, классифицируемых как СГБ [1–3]. Синдром Миллера-Фишера (СМФ) считается географически изменчивым вариантом СГБ, наблюдаемым примерно в 1–5% всех случаев СГБ в западных странах и в 19 и 25% на Тайване и в Японии соответственно [4]. Заболевание чаще фиксируется у мужчин (соотношение 2:1). Средний возраст начала заболевания – 43,6 года. При этом СМФ регистрируется во всех возрастных группах [2, 5]. Как при СГБ, так и при СМФ в большинстве случаев имеет место предшествующее инфекционное заболевание, обычно обусловленное Campylobacter jejuni и Haemophilus influenzae. Однако установлена связь СМФ и с другими микроорганизмами, в частности Mycoplasma pneumoniae и цитомегаловирусом. Инфекция верхних дыхательных путей часто описывается как продромальное состояние, за которым следует желудочно-кишечное заболевание [2, 4].
В отличие от классической восходящей слабости или паралича, характерных для более типичных вариантов СГБ, неврологический дефицит при СМФ следует «сверху вниз» и начинается с диплопии, вызванной внешней офтальмоплегией – наиболее распространенным симптомом данного состояния [4, 5]. В клинической серии из 50 описанных случаев СМФ в Японии обнаружено, что 78% случаев изначально проявлялись диплопией, 46% – атаксией и 34% – обоими синдромами. Другие отклонения, о которых сообщалось, хотя и реже, включали дизестезию конечностей, блефароптоз, лицевой, бульбарный и зрачковый параличи, легкие периферические парезы мышц конечностей и нарушение мочеиспускания [4].
Для СМФ типично острое начало, дебютирующее с неврологических симптомов примерно через 8–10 дней (диапазон от одного до 30 дней) после предшествующего заболевания [2–4]. Заболевание прогрессирует до достижения клинического надира примерно через шесть дней (диапазон от двух до 21 дня) после начальных неврологических симптомов [4]. Период восстановления характеризуется постепенным улучшением и часто разрешением симптомов. В редких случаях отмечаются серьезные осложнения, например дыхательная недостаточность или сердечная аритмия (часто имеют место при СГБ, причем в 30% случаев требуется искусственная вентиляция легких) [2]. Атаксия и офтальмоплегия обычно разрешаются в течение 1–3 месяцев после начала, почти полное выздоровление наблюдается в течение шести месяцев [4]. Арефлексия может сохраняться, но она не связана с функциональной инвалидизацией.
Хотя ожидается самоограничивающееся течение болезни, варианты лечения не отличаются от таковых при СГБ и включают введение внутривенного иммуноглобулина и плазмаферез. Преимущества лечения СГБ не так очевидны, но оно способствует более быстрому разрешению симптомов и, возможно, снижению риска развития осложнений [6].
Несмотря на низкую частоту встречаемости, СМФ сыграл важную роль в понимании патогенеза иммуноопосредованных невропатий, которые предположительно включают молекулярную мимикрию, обусловленную предшествующей инфекцией [6–8].
В 1992 г. несколько авторов впервые сообщили о наличии антител к GQ1b и их связи с СМФ, которые могут присутствовать более чем в 90% случаев. Их определение стало важным диагностическим инструментарием при СМФ. Впоследствии этот синдром включили в перечень клинических вариантов СГБ, затрагивающих глазные мышцы [7, 8].
В представленном клиническом случае показаны ключевые клинические особенности СМФ. Рассматриваются целенаправленные дифференциальные диагнозы, тест на определение антител к GQ1b, прогноз и доступные методы лечения. Данный случай помогает понять, стоит ли рассматривать СМФ у пациентов с арефлексией, атаксией и офтальмологическими симптомами.
Клинический случай
Женщина, 63 года, кыргызской этнической принадлежности, обратилась в университетскую клинику Vedanta 23 ноября 2024 г. по поводу двоения предметов, шаткости при ходьбе, светобоязни, сильной головной боли. Из анамнеза известно, что пациентка чувствовала себя плохо в течение последнего месяца из-за затяжного простудного состояния (слабость и кашель до появления имеющихся симптомов). До осмотра в университетской клинике больная получала лечение по месту жительства. В течение двух последних дней находилась на стационарном лечении в частной клинике. Во время предыдущей госпитализации пациентка жаловалась не только на двоение, шаткость при ходьбе, но также на тошноту, позывы к рвоте, головокружение. С подозрением на острое нарушение мозгового кровообращения ее направили на нейровизуализационное исследование (нативная и магнитно-резонансная томография (МРТ) с ангиографией сосудов головного мозга), в ходе которого признаков инфаркта или гематомы в веществе головного мозга не было выявлено, но обнаружен очаг перенесенного ранее лакунарного инсульта в левой лобной доле. Для исключения миастении больной провели прозериновую пробу: результат отрицательный. Состояние пациентки, по данным МРТ, расценили как негативный вариант инфаркта ствола мозга и назначили лечение: блокатор Н1-гистаминовых рецепторов, антиагреганты, гипотензивные средства, коррекция электролитных нарушений. Положительная динамика состояния на фоне терапии отсутствовала. По настоянию пациентки ее транспортировали в Бишкек для исключения острого нарушения мозгового кровообращения.
Неврологический осмотр в день поступления проведен в отделении неотложной помощи.
Медицинские, хирургические и семейные истории пациентки не упростили диагностический поиск. Она проживала в доме с взрослыми детьми, работала гинекологом.
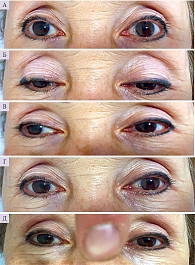
При физическом осмотре: жизненные показатели в пределах нормы, умеренный дискомфорт, предпочитает держать глаза закрытыми. Сознание ясное, пациентка ориентирована, память сохранена, способность к общению не утрачена. Неврологическое обследование выявило выраженный офтальмопарез с вовлечением экстраокулярных мышц во все стороны и двусторонний полуптоз век билатерально (рис. 1). Отмечался мидриаз, который сопровождался светобоязнью. Лицевые мышцы симметричны, без признаков дефицита. Атаксия при исследовании в позе Ромберга, выполнение координаторных проб не нарушено. Глобальная арефлексия. Тестирование мышечной силы выявило легкую слабость в правых конечностях (4 балла из 5, не исключен резидуальный дефицит после перенесенного лакунарного инсульта). Результаты сенсорного обследования в норме. Пациентка не могла самостоятельно ходить.
Лабораторные исследования: общий анализ крови и мочи, гемостазиограмма, комплексная биохимическая панель, уровни тиреотропных гормонов, электролитов, прокальцитонина, D-димера и сердечных маркеров – в норме. Не зафиксировано повышения скорости оседания эритроцитов, уровней С-реактивного белка и креатинкиназы. Результаты серологических исследований на гепатиты B, С, ВИЧ и антикардиолипиновый тест отрицательные.
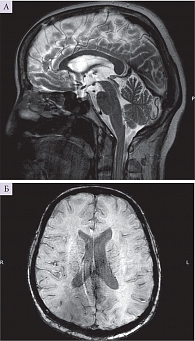
Выполнена нейровизуализация головного мозга с контрастированием. МРТ мозга с контрастным усилением (гадолиний) показала множественные очаги глиоза в белом веществе головного мозга (микроангиопатия) (рис. 2).
В отделении реанимации до получения результатов исследований пациентке назначили стартовую терапию: противовирусную (ацикловир 400 мг три раза в день), иммуносупресивную (пульс-терапия Солу-Медролом) и антибактериальную (карбапенемы). Два других основных конкурирующих диагноза – вирусный/бактериальный менингоэнцефалит и СМФ – рассматривались. Миастения гравис была исключена еще до поступления в университетскую клинику после проведения прозериновой пробы. Результаты серологических лабораторных исследований на определение некоторых наиболее распространенных при СМФ патогенов (M. pneumoniae и цитомегаловирус) положительные. Больной выполнили люмбальную пункцию, результаты которой показали снижение уровня глюкозы, что в отсутствие плеоцитоза нельзя было расценить как патологические изменения. Для исключения туберкулеза провели тест на определение фрагментов ДНК микобактерии туберкулеза методом полимеразной цепной реакции (GeneХpert) сыворотки крови. Результат отрицательный. Для подтверждения диагноза СМФ взяли кровь на определение антител (IgG) к ганглиозидам Q1b и T1A. Результат положительный. Для верификации нарушений нервно-мышечной проводимости провели электронейромиографию (ЭНМГ): потенциалы двигательных единиц и скорость проведения по сенсорным и моторным волокнам в норме. Но с учетом состояния верхних и нижних конечностей после переломов и реконструктивных операций данные ЭНМГ не были специфичными и информативными.
На фоне начатой терапии появилась положительная динамика в виде уменьшения двоения, увеличения объема движений глазных яблок, уменьшения головной боли, головокружения и шаткости при ходьбе. Впоследствии пациентка в течение пяти дней получала сеансы плазмафереза.
Хотя иммуносупрессивное лечение Солу-Медролом и процедуры плазмафереза были начаты на ранней стадии госпитализации и сопровождались положительной динамикой, возраст пациентки и характер симптомов потребовали дальнейшего обследования на предмет паранеопластических расстройств, которые иногда могут указывать на наличие новообразований. Ультразвуковое исследование внутренних органов не выявило поражений. На девятые сутки пациентка начала передвигаться с посторонней помощью, на 15-е – самостоятельно.
Обсуждение
Для СМФ характерна триада: офтальмоплегия, атаксия и арефлексия без явного сенсорного дефицита. В рассмотренном случае имели место типичные симптомы заболевания, но это не привело к своевременной диагностике состояния, вероятно, из-за наличия других симптомов (выраженная головная боль, головокружение и тошнота). Антитела к ганглиозидному комплексу GQ1b регистрируются более чем у 90% пациентов с СМФ и отсутствуют у здоровых людей [3]. Считается, что аутоантитела к GQ1b, нацеленные на эпитопные агенты, которые в изобилии присутствуют на черепно-мозговых нервах III, IV и VI, вызывают характерную офтальмоплегию при СМФ. Однако эти антитела не являются уникальными только для СМФ и обнаруживаются при других состояниях. Не случайно некоторые эксперты обозначают такие состояния как синдром антител против GQ1b.
Как известно, другие патологические процессы способны вызывать офтальмоплегию, атаксию и арефлексию, но не всегда одновременно. Офтальмоплегия, обусловленная СМФ, нередко начинается быстро по сравнению с постепенным течением при хронических заболеваниях, таких как миотоническая дистрофия, тиреоидная болезнь глаз и миастения гравис. Более 50% пациентов с миастенией гравис имеют птоз и/или диплопию. Слабость глазных мышц может переходить с одного глаза на другой и улучшаться или ухудшаться в течение дня в отличие от СМФ, при котором наблюдается постепенное ухудшение до тех пор, пока не будет достигнута надирная точка симптомов. После этого обычно наступает клиническое улучшение [9, 10].
Атаксия, наблюдаемая при многих состояниях, часто затрагивает мозжечок, спиноцеребеллярные тракты или проприоцептивные каналы в периферических нервах и задних столбах. Ишемия мозжечка возникает из-за нарушения процесса кровообращения в системе задней части Виллизиева круга (вертебробазилярная система) и проявляется неспецифическими симптомами неустойчивой походки, головокружением, головной болью, дисфункцией движения глаз, а также тошнотой и рвотой [11]. При этом важно различать центральные и периферические варианты поражения. Проявления СМФ необходимо дифференцировать от ишемического события [12, 13]. Несмотря на то что СМФ и сосудистые нарушения являются острыми событиями, у пациентов с атаксией и СМФ, как правило, отсутствует латерализация атаксии, что помогает дифференцировать СМФ от большинства поражений мозжечка [13]. Токсины и лекарственные средства также способны вызывать острое начало атаксии [14, 15]. Модуляторы натриевых каналов, такие как фенитоин, и химиотерапевтические средства, например фторурацил, способны спровоцировать приступы атаксии. Вероятно, наиболее частая причина атаксии – употребление алкоголя, которое в основном влияет на координацию нижних конечностей и связано с плохим контролем мелкой моторики рук, невнятной речью и нарушением зрения.
В представленном клиническом случае у пациентки наблюдались диплопия и атаксия после перенесенного заболевания верхних дыхательных путей. Имели место и сопутствующие симптомы, в частности головная боль, головокружение и общая слабость. При неврологическом осмотре выявлена атаксия с выраженной офтальмоплегией. Основными дифференциальными диагнозами для этого клинического сценария были вирусный/бактериальный менингоэнцефалит и вариант СГБ – форма Миллера-Фишера. Положительный результат теста на определение антител к Q1b и T1A, благоприятный ответ на иммуносупрессивную терапию и постепенное восстановление неврологического дефицита до улучшения нарушенных функций позволили подтвердить СМФ.
Заключение
СМФ следует включить в перечень заболеваний, требующих дифференциальной диагностики у любого пациента с симптомами атаксии, арефлексии и офтальмоплегии, поскольку сценарии исходов [16, 17], а также коморбидные и предшествующие состояния [18] могут отличаться и требовать разных подходов к лечению (медикаментозных и немедикаментозных).
E.M. Mamytova, PhD, S.O. Omurbekov, M.M. Mamytov, PhD, Prof., B.M. Mamytova, PhD, G.S. Biyalieva, PhD, Ye.N. Akulich, A.T. Israilova, L.R. Akhmadeeva, PhD, Prof.
I.K. Akhunbaev Kyrgyz State Medical Academy
Medical Clinic of the International Higher School of Medicine ‘Vedanta’, Bishkek
National Hospital of the Ministry of Health of the Kyrgyz Republic
Bashkir State Medical University
Russian Railways-Medicine Clinical Hospital, Ufa
Academy of Sciences of the Republic of Bashkortostan
Contact person: Leila R. Akhmadeeva, Leila_ufa@mail.ru
Acute inflammatory demyelinating diseases of the peripheral nervous system can be difficult for a practitioner to diagnose, especially in their rare forms and various course variants. For effective pharmacotherapy of such conditions, it is important to consider individual clinical case and compare our own data with the results of publications by colleagues from different countries. Miller Fisher syndrome (MFS) is a rare variant of Guillain – Barre syndrome, a form of acute inflammatory demyelinating neuropathies. The incidence of this form has geographically different indicators. MFS is mainly a clinical diagnosis based on the key objectively observed signs in the form of ataxia, areflexia, and ophthalmoplegia, however, patients with MFS may also have other neurological symptoms. Serological confirmation of the diagnosis of MFS is available using an analysis for antibodies to GQ1b, which increases diagnostic confidence in the presence of additional symptoms. Self-limiting flow is typical for MFS. The article presents a clinical case of a middle-aged patient who had general weakness, headache, difficulty walking and diplopia after upper respiratory tract disease. The patient had a classic triad of ataxia, areflexia, and ophthalmoplegia, typical for MFS, which facilitated diagnostic work. Our suspected diagnosis of MFS was serologically confirmed by a positive titer of antibodies to Q1b and T1A, and the patient was successfully treated with plasma exchange.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.