Эпидемиологические аспекты первично-множественного рака молочной железы
- Аннотация
- Статья
- Ссылки
- English









Введение
По данным Всемирной организации здравоохранения (ВОЗ), в 2021 г. рак молочной железы (РМЖ) по распространенности вышел на первое место, обогнав рак легкого. 12% всех раков, по данным ВОЗ, приходится на РМЖ. Ожидается, что к 2040 г. в мире ежегодно будут выявлять около 30 млн новых случаев в год, тогда как в 2020 г. выявлено 19,3 млн случаев.
В Российской Федерации (РФ) в 2022 г. РМЖ стойко занимает первое место среди женского населения и составляет 22,4% в общей структуре заболеваемости злокачественными новообразованиями (ЗНО) среди женщин. Средний возраст больных – 61,7 года. Стандартизованный показатель заболеваемости РМЖ в РФ в 2022 г. составил 54,04 на 100 тыс. женского населения. В Челябинской области РМЖ в 2022 г. также занимает первое ранговое место в структуре заболеваемости женского населения, удельный вес его – 21,3%. Средний возраст больных РМЖ в Челябинской области – 60,2 года.
Стандартизованный показатель заболеваемости РМЖ в Челябинской области в 2022 г. – 60,43 на 100 тыс. женского населения. В России в 2022 г. впервые выявлено 68 165 случаев первично-множественных опухолей (ПМО) (52 740 в 2021 г.), заболеваемость составила 46,5 на 100 тыс. населения, 10,9% всех впервые выявленных ЗНО. Синхронные ПМО в РФ в 2022 г. занимают 26,5% [1, 2].
Динамика показателей ПМО в Челябинской области представлена в табл. 1.
Что касается определения ПМО, за основу был взят постулат Н.Н. Петрова (1947 г.): критерии ПМО – опухоли располагаются отдельно друг от друга и не являются метастазами друг друга. При анализе ПМО мы пользовались рекомендациями Международного агентства по изучению рака (МАИР) от 1994 г. – признание существования двух или более ЗНО не зависит от времени их выявления. Новообразования считаются возникшими синхронно в случае, если диагноз второго злокачественного новообразования был установлен менее чем через шесть месяцев после выявления первой опухоли. Опухоли, диагностированные с временным интервалом более шести месяцев, рассматриваются как метахронные [3, 4].
Среди причин роста ПМО молочной железы отмечают следующие: ежегодный рост заболеваемости РМЖ, увеличение средней продолжительности жизни женщин (75 лет – по данным Росстата в 2021 г.), накопление наследственной отягощенности в популяции, рост «болезней цивилизации» – ожирения, гиперлипидемии, сахарного диабета, ановуляции, бесплодия. Среди других факторов – улучшение ранней диагностики, скрининг, раннее выявление РМЖ, как следствие раннего выявления улучшение показателей выживаемости, возможность дожития до второй, третьей и последующих опухолей [3, 5].
Из факторов риска РМЖ наиболее значимыми являются возраст, семейная история РМЖ в молодом возрасте, генетические мутации BRCA1 и BRCA2, лучевая терапия грудной клетки в анамнезе, длительная менопаузальная гормонотерапия, доброкачественные пролиферативные заболевания молочной железы [3, 5, 6].
Что касается возраста больных полинеоплазиями, единого мнения по данному вопросу не существует [3, 4].
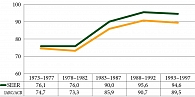
Исследований, посвященных выживаемости больных ПМО молочной железы, в мировой литературе описано недостаточно [6–14]. Интересным представляется исследование, проведенное IARC и SEER по показателю пятилетней выживаемости больных РМЖ с 1972 по 1997 г. (рис. 1) [15]. При этом пятилетняя выживаемость ПМО молочной железы по данным американских исследователей выше, чем по данным МАИР.
ПМО в официальных статистических формах не разбиты по нозологическим группам, что делает проблему актуальной, требующей дальнейшего изучения.
Цель исследования – провести ретроспективный анализ больных ПМО молочной железы по данным Челябинского областного клинического центра онкологии и ядерной медицины (ЧОКЦОиЯМ) с 1999 по 2013 г. Провести анализ сочетаний, интервалов возникновения различных опухолей, среднего возраста больных с первой и последующей опухолями, показателей выживаемости больных первично-множественным РМЖ, в том числе больных с отягощенным семейным анамнезом.
Материал и методы
Методом сплошной выборки проведен ретроспективный анализ историй болезни пациентов с РМЖ, лечившихся в ЧОКЦОиЯМ на протяжении 15 лет (1999–2013 гг.). Определены сочетания опухолей, интервалы их возникновения, средний возраст больных с первой, второй и последующими ПМО молочной железы, проведен анализ постадийной структуры опухолей молочной железы, собран семейный анамнез.
На базе ЧОКЦОиЯМ ведение популяционного ракового регистра (ПРР) осуществляется с 2007 г. Показатели выживаемости онкологических больных Челябинской области рассчитывались автоматизированно при помощи компьютерной программы «Расчет показателей выживаемости» (приложение к ПРР), разработанной ООО «Новелл-СПб» (свидетельство о государственной регистрации № 2009610723 от 30.01.2009) под методическим консультированием профессора В.М. Мерабишвили. Дата установления диагноза явилась точкой отсчета на популяционном уровне. Необходимыми данными для расчета показателей выживаемости явились пол, состояние на конец года (жив, умер от ЗНО, умер от других заболеваний, в результате осложнений, связанных с лечением, выехал, диагноз не подтвердился), дата последнего контакта, причина смерти, дата смерти, код диагноза, морфологический тип опухоли, стадия, дата выезда или снятия с учета. Для определения выживаемости в группе больных первично-множественными ЗНО репродуктивной системы проводилась выборка по начальному и конечному годам установления диагноза, периоду наблюдения, нозологии (топографическому коду диагноза), гистологическому типу опухоли, стадиям, полу, возрасту и возрастной группе. Пациенты считались выбывшими из исследования в следующих случаях: отсутствовала дата последнего контакта; неизвестно состояние на конец года; больной выехал; диагноз не подтвердился. Определялись показатели скорректированной выживаемости, то есть выживаемости больных, умерших от ЗНО, с исключением умерших от других заболеваний, для расчета которых использовался актуриальный метод. Также производился расчет наблюдаемой выживаемости, которая отражает отношение числа больных, переживших контрольный срок, к числу больных, взятых под наблюдение. С помощью программного обеспечения произведен расчет показателей выживаемости как в группе солитарного РМЖ, так и в группе ПМО молочной железы, в том числе с отягощенным семейным анамнезом.
Результаты
За рассматриваемый период в ЧОКЦОиЯМ получили лечение 4652 больных РМЖ. ПМО выявлены
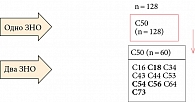
у 463 (9,95%) пациенток. Дизайн исследования представлен в табл. 2. Преобладали метахронные опухоли – у 293 (63,2%), синхронные выявлены у 128 (27,64%). У 37 больных выявлено по три опухоли, у пяти женщин – по четыре.
Сочетания ПМО молочной железы при метахронном развитии представлены на рис. 2. Рак молочной железы чаще был второй опухолью у 278 больных, первой – у 234. У 16 больных РМЖ был третьей опухолью, у трех – четвертой. Преобладал билатеральный РМЖ – у 184 больных. Из других сочетаний – с раком тела матки, щитовидной железы, яичника и правой половины толстой кишки, образуя «гормонозависимый синдром». Из других сочетаний – чаще с ЗНО кожи, реже – с раком легких и шейки матки.
Обращает на себя внимание ранний возраст выявления первой опухоли – 47,6 года, что намного раньше, чем в популяции солитарного РМЖ (61 год – по данным РФ в 2020 г.). Возраст второй опухоли – 54,4 года, что также раньше, чем в популяции солитарного рака у женщин.
Средний интервал между возникновением первой и второй опухоли составил 8,9 года, второй и третьей – 6,41 года. Синхронные раки диагностированы у 128 больных. Сочетания ПМО молочной железы при синхронном развитии представлены на рис. 3. Билатеральный рак выявлен у 60 больных. Из других сочетаний также чаще встречались гормонозависимые локализации: рак тела матки, яичников, щитовидной железы, правой половины ободочной кишки.
Семейный анамнез был отягощен у 66 (14,25%) больных данной группы. Сочетания ПМО молочной железы у больных с отягощенным семейным анамнезом представлены на рис. 4. Билатеральный рак выявлен у 18 больных, из других сочетаний также обращает на себя внимание сочетание с гормонозависимыми опухолями других локализаций. Средний возраст больных с отягощенным семейным анамнезом с первой опухолью составил 50,2 года, со второй – 57,86 года, что раньше, чем в группе солитарных опухолей молочной железы.
Распределение по стадиям в группе ПМО молочной железы было следующим: I cтадия – 29%, II – 54%, III – 15%, IV – 2%. Таким образом, преобладали ранние стадии заболевания (83%). Что касается распределения по стадиям солитарного РМЖ в Челябинской области, ранние стадии (I и II) составляют 67,2%. Анализ распределения по стадиям больных ПМО молочной железы с отягощенным семейным анамнезом показал, что также преобладали ранние стадии заболевания: I стадия – 28,57%, II – 55,1%, III – 14,28%, IV – 2%. Выявление ПМО молочной железы на ранних стадиях способствовало улучшению результатов лечения первой или второй опухоли, доживанию больных до последующих опухолей.
Анализ гистологического строения ПМО молочной железы показал, что чаще встречался инфильтративный протоковый рак (222 случая), реже – дольковый (129 случаев). Также встречались смешанные гистологические формы рака: криброзный, муцинозный, медуллярный, рак Педжета и пр.
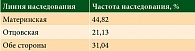
Наследование у больных ПМО молочной железы в большинстве наблюдений шло по материнской линии (табл. 3). Чаще встречалась вертикальная передача заболевания (у 14 больных). В 31% случаев наследование шло с обеих сторон (по материнской и отцовской линиям) (табл. 4).
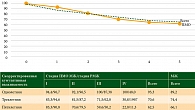
Анализ скорректированной одно-, трех- и пятилетней выживаемости у больных ПМО молочной железы в сравнении с больными солитарным РМЖ представлен на рис. 5. Выживаемость по всем периодам в группе ПМО молочной железы оказалась выше, чем в группе больных солитарным раком. Данные статистически достоверны только по показателю однолетней выживаемости.
Отдельно проведен анализ выживаемости больных ПМО молочной железы при метахронном и синхронном развитии в зависимости от стадии (рис. 6, 7). Одно-, трех- и пятилетняя выживаемость у больных с метахронными опухолями оказалась выше, чем в группе больных солитарным РМЖ. При синхронном развитии выживаемость была выше только при наблюдении в течение года, показатели трех- и пятилетней выживаемости оказались хуже, чем при солитарном РМЖ.
Отдельно проанализирована выживаемость больных ПМО молочной железы с отягощенным семейным анамнезом (рис. 8). В этой группе больных получены самые хорошие результаты по одно-, трех- и пятилетней выживаемости (73% против 66,1% при солитарных опухолях молочной железы). Вероятно, фактор отягощенной наследственности вносит положительный вклад в результаты лечения этой категории больных.
Анализ скорректированной и наблюдаемой выживаемости больных ПМО молочной железы не показал различий по показателю выживаемости (табл. 5). Это позволяет сделать вывод, что больные ПМО молочной железы умерли от ЗНО, а не от других причин.
Выводы
- Наряду с ростом заболеваемости РМЖ в Челябинской области растет заболеваемость ПМО молочной железы. По данным ЧОКЦОиЯМ, за 15 лет (1999–2013 гг.) частота ПМО молочной железы составляет 9,95%.
- Проведенный анализ ПМО молочной железы по данным ЧОКЦОиЯМ показал, что преобладали метахронные опухоли (63%). Синхронные составили 27,6%. Тройные локализации выявлены в 7,6%, четыре локализации – в 1% случаев.
- Как при синхронном, так и при метахронном варианте развития преобладал билатеральный РМЖ, а также сочетания гормонозависимых опухолей при среднем интервале развития между первой и второй опухолью 8,9 ± 0,55 года, между второй и третьей – 6,41 ± 1,47 года.
- Средний возраст больных первой опухолью составил 47,6 ± 1,0 года, второй – 54,4 ± 1,0 года, что меньше, чем в популяции больных солитарным РМЖ.
- Анализ скорректированной общей выживаемости больных ПМО молочной железы показал, что за все рассматриваемые периоды выживаемость была выше, чем в группе больных солитарным РМЖ. По показателю пятилетней выживаемости – на 4,7% выше, чем в группе больных солитарным РМЖ. Самые высокие показатели выживаемости были в группе больных с наследственно отягощенным анамнезом (по показателю пятилетней выживаемости – на 6,9% выше, чем в группе солитарного РМЖ). При синхронном варианте развития показатели трех- и пятилетней выживаемости оказались ниже, чем при солитарном РМЖ. При синхронном развитии симптомы одной опухоли отягощаются симптомами другой, результаты лечения хуже, чем в группе больных метахронным РМЖ.
- Улучшению показателей выживаемости в исследуемой группе способствовали радикальное лечение как первой, так и второй опухоли в силу преобладания ранних стадий заболевания (83%), а также систематичность наблюдения после лечения первой опухоли. Кроме того, преобладание гормонозависимых сочетаний, характеризующихся эндокринно-обменными нарушениями, обусловливает большую гормоночувствительность как солитарного, так и первично-множественного рака, а значит, его меньшую автономность и агрессивность и, как следствие, лучший прогноз.
- Проведенный анализ позволяет говорить, что больные, имеющие РМЖ, находятся в группе риска по развитию вторых, как правило, гормонозависимых опухолей, имеющих общие этиопатогенетические механизмы, такие как повышенная рецепция к эстрогену и прогестерону у женщин.
Таким образом, число ЗНО не влияет на прогноз заболевания у пациента при условии раннего выявления, радикального лечения и тщательного динамического наблюдения после лечения первой опухоли.
S.A. Bekhtereva, PhD, D.M. Rostovtsev, PhD, T.Yu. Vedom, T.S. Novikova
Chelyabinsk Regional Clinical Center of Oncology and Nuclear Medicine
Contact person: Svetlana А. Bekhtereva, Bekhterevasvetlana@gmail.com
Along with the increase in the incidence of breast cancer both in the Russian Federation and in the Chelyabinsk region, the number of primary multiple tumors (PMT) of this localization is growing. An analysis carried out on the basis of the Chelyabinsk Regional Clinical Center of Oncology and Nuclear Medicine for the period from 1999 to 2013 showed that breast cancer was detected in 463 patients, their frequency was 9.95%. Metachronous tumors predominated (63%), the average age of patients with the first tumor was 47.6 ± 1.0 years, the second – 54.5 ± 1.0 years. Analysis of combinations of tumors of various localizations showed that bilateral breast cancers predominated, as well as combinations of “hormone-dependent” tumors with each other, which determines their less autonomy and better prognosis. Five-year survival rates in the group of breast tumors were 4.7% higher than in the group of solitary tumors, and in the group of breast tumors with a family history – by 6.9%. The number of tumors in one patient that developed with an interval of more than 6 months does not affect the prognosis of the disease, subject to early detection, radical treatment and careful follow-up.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.