Фронто-темпоральная деменция и биохимические маркеры
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Нами обследованы три группы субъектов в возрасте от 60 до 75 лет с фронто-темпоральной деменцией, хронической ишемией головного мозга и без признаков когнитивных расстройств. Всем выполнены объективное исследование с полным неврологическим тестированием, включавшим оценку когнитивных функций с использованием нейропсихологических шкал, и исследование крови на уровень гормона дегидроэпиандростерона сульфата.
Результаты. Клиническая картина фронто-темпоральных деменций у пациентов, проживающих в Республике Узбекистан, существенно не отличается от таковой в других популяциях мира. Минимальные уровни гормона дегидроэпиандростерона сульфата зафиксированы в группе пациентов с фронто-темпоральными деменциями – 1,25 мкг/мл, максимальные – у здоровых лиц контрольной группы – 2,29 мкг/мл.
Заключение. Результаты данного исследования свидетельствуют о существовании потенциальной ассоциации между развитием когнитивного снижения и концентрацией гормона дегидроэпиандростерона сульфата в крови. Результаты данного наблюдения должны быть протестированы в последующих исследованиях и использованы для индивидуального подбора фармакотерапии и нефармакологических вмешательств.
Материал и методы. Нами обследованы три группы субъектов в возрасте от 60 до 75 лет с фронто-темпоральной деменцией, хронической ишемией головного мозга и без признаков когнитивных расстройств. Всем выполнены объективное исследование с полным неврологическим тестированием, включавшим оценку когнитивных функций с использованием нейропсихологических шкал, и исследование крови на уровень гормона дегидроэпиандростерона сульфата.
Результаты. Клиническая картина фронто-темпоральных деменций у пациентов, проживающих в Республике Узбекистан, существенно не отличается от таковой в других популяциях мира. Минимальные уровни гормона дегидроэпиандростерона сульфата зафиксированы в группе пациентов с фронто-темпоральными деменциями – 1,25 мкг/мл, максимальные – у здоровых лиц контрольной группы – 2,29 мкг/мл.
Заключение. Результаты данного исследования свидетельствуют о существовании потенциальной ассоциации между развитием когнитивного снижения и концентрацией гормона дегидроэпиандростерона сульфата в крови. Результаты данного наблюдения должны быть протестированы в последующих исследованиях и использованы для индивидуального подбора фармакотерапии и нефармакологических вмешательств.
Введение
В связи с повышением среднего возраста во всем мире число пожилых пациентов резко возросло. Как следствие, увеличилось количество пациентов с когнитивными нарушениями разной степени выраженности. Заболевания, сопровождающиеся когнитивными и поведенческими нарушениями, активно исследуются неврологами и психиатрами всего мира. Одним из таких заболеваний является фронто-темпоральная деменция (ФТД), многие аспекты которой остаются нераскрытыми и подлежат дальнейшему изучению.
ФТД, или лобно-височная деменция, представляет собой группу нейродегенеративных заболеваний с преимущественным поражением лобных и передних отделов височных долей головного мозга, которое проявляется прогрессирующими поведенческими и личностными нарушениями с постепенной утратой эмпатии и способности к продуктивному контакту.
На ФТД приходится примерно 5–7% случаев деменции [1]. Заболеваемость составляет 8,9 случая на 100 тыс. населения в год [2, 3]. Данное заболевание поражает людей средней возрастной группы. Пик заболеваемости приходится на возраст 55–65 лет, хотя описаны редкие случаи начала болезни в 20–40 и даже после 90 лет [3].
С учетом того, что дегенеративному процессу подвергаются лобный и височный отделы головного мозга, становится понятным, почему в клинической картине доминируют прогрессирующий на протяжении всей болезни лобный синдром, нарушения функции речи, отсутствуют первичные дефекты праксиса, нарушения пространственной ориентации и грубые расстройства памяти.
Около 30–50% случаев ФТД имеют семейный характер и связаны с мутациями в трех генах: гене, кодирующем связанный с микротрубочками белок тау (МАРТ), гене програнулина и гене, кодирующем белок С9оrf72 [2]. В большинстве случаев тип наследования данного заболевания аутосомно-доминантный, но бывают и спорадические случаи, когда наследование не может быть объяснено законами Менделя. Имеют значение и факторы риска развития данного заболевания, к которым относят черепно-мозговую травму, повышающую риск развития ФТД в 3,3 раза, заболевания щитовидной железы, на фоне которых риск заболевания возрастает в 2,5 раза [4]. Выживаемость при ФТД составляет около 6–10 лет, реже – 12–15 лет и, как правило, не зависит ни от степени тяжести деменции, ни от возраста дебюта заболевания [4, 5].
Классические клинические критерии диагностики ФТД были предложены D. Neary и соавт. в 1998 г. Согласно этим критериям, ФТД диагностировали при наличии основных клинических проявлений: постепенного начала и неуклонного прогрессирования, рано развивающегося расстройства личности и социального поведения, эмоционального безразличия, снижения критики. По данным Е.Е. Васениной и соавт., чувствительность этих критериев в дебюте заболевания составляет всего 33–58% и только через два года достигает 83%. В настоящее время используются более расширенные критерии диагностики ФТД, опубликованные в 2011 г. международным советом экспертов [6].
Выделяют две основные формы ФТД – поведенческую (ПФФТД) и первичную прогрессирующую афазию (ППА). В свою очередь ППА подразделяют на семантическую, аграмматическую и логопеническую формы [7–12].
Наиболее распространенной считается ПФФТД. Поскольку при этой форме в процесс вовлекаются преимущественно лобные доли головного мозга, клиническая картина складывается соответственно из поведенческих, социальных и личностных нарушений. Пациенты становятся импульсивными, нередко агрессивными, перестают следить за личной гигиеной. У некоторых из них наблюдается синдром Клювера – Бьюси, включающий эмоциональную тупость, гиперсексуальность, гипероральность (в том числе булимию, сосание и причмокивание губами) и зрительную агнозию. Патоморфологическая картина ФТД представлена атрофическими изменениями в лобных и височных долях головного мозга. Возможно вовлечение в патологический процесс теменной коры, черной субстанции, полосатых тел, других подкорковых структур и передних рогов спинного мозга, что находит отражение в клинической картине заболевания [8, 11–13]. По данным Д.А. Гришина, В.В. Захарова, Н.Н. Яхно, у 63% пациентов с ПФФТД имеет место атрофия коры височных долей головного мозга.
ППА характеризуется прогрессирующими расстройствами речи, возникающими исподволь, без видимой причины и имеющими тенденцию к непрерывному прогрессированию в отсутствие или при минимальной клинической представленности других когнитивных нарушений. Речевые нарушения при ППА должны быть доминирующим клиническим синдромом в течение двух лет и более [8, 11, 14–18].
В соответствии с предложенными в настоящее время критериями, выделяют три основные формы ППА – семантическую (СФ) без снижения беглости речи (fluent aphasia, semantic dementia), аграмматическую (АФ) со снижением беглости речи (non-fluent aphasia) и логопеническую формы (ЛФ) [17–21]. Третий – логопенический вариант ППА в большинстве случаев представляет атипичную форму болезни Альцгеймера, а не проявление лобно-височной дегенерации [7, 22, 23]. Выделяют также комбинированную форму ППА, которая имеет признаки, схожие с СФ и АФ ППА [24].
Несмотря на превалирование поведенческих и речевых нарушений, связанных с поражением лобных и височных долей головного мозга, у пациентов с ФТД в той или иной мере присутствуют иные выраженные когнитивные нарушения.
Цель исследования – проанализировать клинико-неврологические особенности течения ФТД, когнитивные и психологические нарушения при данном заболевании, а также взаимосвязь уровня гормона дегидроэпиандростерона сульфата с прогрессированием когнитивных нарушений у обследованных пациентов.
Материал и методы
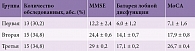
Набор пациентов проводился в трех стационарных неврологических отделениях, а также поликлиническом отделении клиники Андижанского государственного медицинского института (Республика Узбекистан). Было обследовано 43 пациента в возрасте от 60 до 75 лет. Пациенты были разделены на три группы. Первую группу составили 13 пациентов с ФТД (средний возраст – 67 лет), вторую – 15 пациентов с хронической ишемией головного мозга с легкими и умеренными когнитивными нарушениями (средний возраст – 66 лет), третью (контрольную) – 15 лиц без когнитивных нарушений (средний возраст – 68 лет). Всем пациентам были проведены соматический осмотр, полный клинический неврологический осмотр, включая оценку когнитивных функций по шкалам MMSE, MoCA, Батарее лобной дисфункции, глобальной шкале оценки ухудшения первичной дегенеративной деменции, также известной как шкала Рейсберга. Всем пациентам выполнено исследование крови на уровень гормона дегидроэпиандростерона сульфата. Кроме того, пациентам первой и второй групп проведена магнитно-резонансная томография (МРТ) головного мозга.
Результаты
Среди пациентов с ФТД первой группы было 8 (61,5%) пациентов (пять женщин и трое мужчин) с поведенческой формой ФТД и 5 (38,5%) (четыре женщины и один мужчина) с ППА.
Из 15 пациентов второй группы у 4 (26,7%) (три женщины и один мужчина) отмечались легкие когнитивные нарушения, у 7 (46,7%) (две женщины и пять мужчин) – умеренные и у 4 (26,7%) (две женщины и двое мужчин) – выраженные когнитивные нарушения.
В третью группу без когнитивных нарушений вошли 8 (53,3%) мужчин и 7 (46,7%) женщин.
Среди основных жалоб, предъявляемых родственниками пациентов первой группы, были снижение памяти – 100%, изменение поведения – 92,3%, неряшливость – 61,5%, нарушение речи – 46,1%, агрессивность – 38,4%, стереотипии – 30,7%, неконтролируемые физиологические отправления – 23,1%, эмоциональное оскудение – 23,1%, утрата практических навыков – 15,3%.
Во второй группе пациенты жаловались в основном на головную боль – 100%, головокружение – 86,6%, снижение памяти – 80%, нарушение сна – 73,3%, шум в ушах – 66,6%, быструю утомляемость – 53,3%.
Пациенты третьей группы жалоб, связанных с когнитивными нарушениями, не предъявляли.
Для объективной оценки когнитивных нарушений и нейропсихологического статуса всем пациентам выполнено нейропсихологическое обследование, результаты которого представлены в табл. 1.
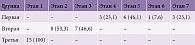
В первой группе средний балл по шкале MMSE составил 12,2, данные теста «Батарея лобной дисфункции» – 6 баллов, средний балл по MoCA – 7,1. По шкале Рейсберга 3 (23,1%) пациента первой группы имели умеренное снижение познавательной способности (этап 4), 6 (46,1%) – умеренно тяжелый когнитивный спад (этап 5), 1 (7,6%) – сильное снижение познавательной способности (этап 6), 3 (23,1%) – выраженное тяжелое снижение познавательной способности (этап 7).
Во второй группе средний балл по шкале MMSE составил 24,4, данные теста «Батарея лобной дисфункции» – 14,1 балла, средний балл по шкале MoCA – 17,9. По шкале Рейсберга 8 (53,3%) пациентов второй группы имели умеренное снижение познавательной способности (этап 2), 7 (46,6%) – умеренный когнитивный спад (этап 3).
В третьей группе по шкале MMSE средний балл составил 29, по тесту «Батарея лобной дисфункции» – 17,1, шкале MoCA – 26,7. По шкале Рейсберга у всех пациентов этой группы когнитивный дефицит отсутствовал (табл. 2).
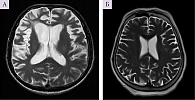
У пациентов первой группы по результатам МРТ головного мозга выявлены признаки атрофии или гипотрофии (разной степени выраженности) коры головного мозга, в частности его лобно-височных отделов. В то же время у пациентов второй группы превалировали МРТ-признаки хронической ишемии головного мозга без выраженных признаков атрофии (рис. 1).
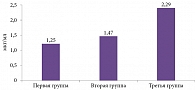
Дегидроэпиандростерона сульфат – андроген, секретируемый в пучковой и сетчатой зонах надпочечников. Согласно результатам исследования, в первой группе с ФТД средний уровень этого гормона составил 1,25 мкг/мл, во второй группе – 1,47 мкг/мл, в третьей – 2,29 мкг/мл (рис. 2).
Обсуждение
Несмотря на то что при ФТД основными клиническими признаками являются поведенческие и речевые нарушения, субъективно родственники больных предъявляют жалобы прежде всего на снижение памяти, на втором месте – изменение поведения, далее по нисходящей – речевые нарушения и другие жалобы. Сами пациенты с ФТД жалоб, связанных с заболеванием, как правило, не предъявляют, особенно при выраженном эмоциональном и когнитивном дефиците. Пациенты второй группы с умеренными когнитивными нарушениями предъявляли жалобы неврологического характера, в частности на головную боль, головокружение, нарушение сна, снижение памяти. Это говорит о том, что они адекватно оценивали и понимали свое состояние. Пациенты третьей группы не предъявляли жалоб неврологического характера, что позволило сформировать из них контрольную группу.
МРТ структур головного мозга показала наличие у пациентов с ФТД признаков атрофии или гипотрофии коры лобной или височной областей головного мозга либо обеих частей одновременно, что соответствовало критериям диагностики ФТД. У пациентов с умеренными и выраженными когнитивными нарушениями преобладали изменения сосудистого характера и признаки дисциркуляторной энцефалопатии.
Будучи гормоном, секретируемым надпочечниками, дегидроэпиандростерона сульфат может оказывать определенное влияние на нервную деятельность и когнитивные функции. Нормальные показатели этого гормона в крови, по данным лаборатории Андижанского государственного медицинского института, для мужчин и женщин старше 60 лет составляют 0,10–2,35 и 0,30–2,60 мкг/мл соответственно.
Хотя показатели во всех трех группах не вышли за пределы нормальных значений, минимальные концентрации дегидроэпиандростерона сульфата выявлены у пациентов первой группы (с ФТД), максимальные – у пациентов третьей группы (здоровые лица). Это может служить поводом для обсуждения влияния уровня данного гормона на когнитивные нарушения и использования указанного лабораторного показателя в алгоритме оптимизации диагностики и дифференциальной диагностики различных форм когнитивных нарушений, включая ФТД.
Выводы
Наиболее частыми жалобами у обследованных нами пациентов с ФТД в Республике Узбекистан были снижение памяти, изменение поведения, неряшливость, агрессивность, нарушение речи, то есть признаки поражения лобной и височной областей головного мозга (наши данные соотносятся с данными мировой литературы).
Несмотря на то что у пациентов с ФТД страдают прежде всего поведенческая и речевая сферы, другие когнитивные нарушения, в том числе память, внимание, ориентировка, играют значительную роль в развитии клинических проявлений данной патологии.
В крови пациентов с ФТД выявлен наименьший уровень гормона дегидроэпиандростерона сульфата. У пациентов с легкими и умеренными когнитивными нарушениями при хронической ишемии головного мозга результат оказался чуть выше. Самый высокий уровень содержания гормона показали анализы крови у здоровых лиц без когнитивных нарушений. Это может свидетельствовать о потенциальной связи между развитием когнитивных нарушений и уровнем гормона дегидроэпиандростерона сульфата в крови.
Полученные результаты могут в дальнейшем послужить базисом для исследований данного гормона как потенциального биохимического маркера для процесса диагностики, дифференциальной диагностики и прогнозирования развития ФТД. Уменьшение уровня данного гормона ассоциируется со снижением кратковременной и долговременной памяти, внимания, способности к вычислению и других когнитивных функций.
Представленная информация призвана помочь при индивидуальном подборе фармакотерапии и немедикаментозных методов коррекции, включая различные методики тренировки памяти, внимания, интеллекта и других когнитивных функций.
Авторы заявляют об отсутствии конфликта интересов и благодарят Башкирский государственный медицинский университет, на базе которого поддерживается межвузовское международное сотрудничество с Андижанским государственным медицинским институтом в рамках реализации программы стратегического академического лидерства «Приоритет 2030».
D.A. Ergashbaeva, PhD, L.R. Akhmadeeva, PhD, Prof., A.A. Abramyan
Andijan State Medical Institute
Bashkir State Medical University
Аcademy of Sciences of Bashkortostan Republic
Contact person: Leila R. Akhmadeeva, Leila_ufa@mail.ru
Here we discuss the problems of fronto-temporal dementia, its clinical picture in patients in Uzbekistan and the results of our investigation of the possible associations between clinical features of frontotemporal dementia and the level of the hormone dehydroepiandrosterone sulfate.
Material and methods. Three groups of patients aged 60 to 75 years, with fronto-temporal dementia, chronic brain ischemia and a healthy control group, were examined. They underwent physical examination, complete neurological clinical testing, including an assessment of cognitive functions using neuropsychological scales, and a blood test for the level of the hormone dehydroepiandrosterone sulfate was performed.
Results. The clinical presentation of fronto-temporal dementia in our patients in Uzbekistan was similar to other populations. The lowest level of the hormone dehydroepiandrosterone sulfate was observed in the group of patients with frontotemporal dementia – 1.25 mcg/ml, and the highest – in the group of healthy controls – 2.29 mcg/ml.
Conclusion. This study demonstrates the existence of a potential association between the development of cognitive impairment and the concentration of the hormone dehydroepiandrosterone sulfate in the blood. It could be tested in the future studies and used for individualized approaches in pharmacotherapy and non-pharmacological interventions.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.