Гормональное здоровье кожи
- Аннотация
- Статья
- Ссылки
- English
Плацентарные препараты позволяют восстановить гормональную саморегуляцию, состояние и функции кожи.
Плацентарные препараты позволяют восстановить гормональную саморегуляцию, состояние и функции кожи.
Введение
Кожа традиционно рассматривается как мишень для ряда гормонов. Так, андрогены, синтезируемые в гонадах и коре надпочечников, воздействуют на волосяные фолликулы и сальные железы, гипофизарные полипептиды – на меланоциты.
В настоящее время установлено, что многие гормоны синтезируются или подвергаются биологической трансформации в коже. В дальнейшем они могут действовать ауто-, интра- и паракринно либо эндокринно [1]. Таким образом, кожу можно рассматривать как самостоятельный орган эндокринной системы.
Состояние кожи отражает состояние эндокринной системы: наличие или отсутствие патологий. Кожа также реагирует на естественное изменение гормонального фона, в частности во время менструального цикла и перименопаузы [2].
Изучение взаимодействия эндокринной системы и кожи стало предметом нового направления медицины – дерматоэндокринологии.
Пути и механизмы действия гормонов в коже
Понятия «гормональная система» и «эндокринная система» нередко рассматриваются как тождественные. Однако большинство гормонов действуют не только эндокринно, но и интракринно, аутокринно, паракринно. В первом случае гормоны достигают своих мишеней через системный кровоток, в трех других – связываются с рецепторами той же клетки, где они образовались; покидают клетку и воздействуют на нее извне; покидают клетку и воздействуют на ее окружение.
Кожа – это орган, состоящий из множества специализированных клеток, гормональная активность которых различается. Например, катехоламины продуцируются в кератиноцитах, но не в меланоцитах. Кроме того, гормональная активность может меняться под влиянием системных факторов. Так, провоспалительные факторы способны индуцировать синтез эйкозаноидов в кератиноцитах и себоцитах.
Защиту кожи от стрессоров обеспечивает система кортиколиберина/проопиомеланокортина [2]. В ответ на синтез провоспалительных цитокинов из кератиноцитов, меланоцитов, эндотелия и нервных волокон выбрасывается кортиколиберин. Гормон активирует свои кожные рецепторы по аутокринному и паракринному пути. Он усиливает синтез и секрецию адренокортикотропного гормона, бета-эндорфина и альфа-меланоцитстимулирующего гормона из проопиомеланокортина с помощью ферментов-конвертаз. Адренокортикотропный гормон в свою очередь активирует стероидогенный острый регуляторный белок, способствуя секреции кортизола, который и контролирует воспаление. Данная система позволяет опередить системную реакцию организма и частично ее заместить.
Андрогены
Андрогеновый рецептор представлен в эпидермальных и фолликулярных кератиноцитах, себоцитах, клетках дермальной папиллы, дермальных фибробластах и клетках эндотелия. Полиморфизм, обусловливающий усиление активности рецептора к андрогенам, связан с несколькими андрогензависимыми кожными заболеваниями. Так, отдельные исследования нуклеотидного повтора CAG свидетельствуют о роли гирсутизма [3]. В то же время вариабельность повтора GGN в гене андрогеновых рецепторов в большей степени влияет на активность гена и ассоциируется с ранним облысением по мужскому типу [4].
В коже синтезируется значимое количество андрогенов, действующих интракринно и паракринно. Их уровень зависит от экспрессии ферментов синтеза андрогенов в соответствующих клетках. Главными поставщиками являются сальные и потовые железы [2].
Клетки кожи, особенно себоциты, способны синтезировать холестерин для клеточных мембран, эпидермального барьера и сального секрета. Себоциты экспрессируют лишь небольшое количество цитохрома P450c17, необходимого для синтеза дегидроэпиандростерона и андростендиона. Однако себоциты, клетки потовых желез и дермальной папиллы способны конвертировать дегидроэпиандростерон, андростендион и, возможно, дегидроэпиандростерон-С в тестостерон и дигидротестостерон.
Молекулярные трансформации андрогенов происходят благодаря ферменту 17-бета-гидроксистероиддегидрогеназе (17-бета-ГСД). В коже экспрессия 17-бета-ГСД обнаружена в сально-волосяных фолликулах и эпидермальных кератиноцитах. Известно 12 ее изоформ. Сальные железы способны продуцировать пять из них. Наиболее активно вырабатываются 17-бета-ГСД-2 и 17-бета-ГСД-5. Первая инактивирует стероиды, вторая конвертирует андростендион в тестостерон. Как следствие, их действие уравновешивается.
На коже лица более активны изоформы 17-бета-ГСД-3 и 17-бета-ГСД-5 [4]. Этим можно объяснить ее большую чувствительность к андрогенам.
Таким образом, индивидуальная чувствительность к андрогенам складывается из особенностей рецептора, баланса разнонаправленных действий изоформ 17-бета-ГСД, а также количества локально продуцируемых гормонов. Она в свою очередь обусловливает эффективность медикаментозной терапии при синдромах, связанных с избытком андрогенов.
Возможно, полученные данные помогут в выработке персонализированного подхода к терапии акне и других патологий.
Установлено, что применение плацентарного препарата Лаеннек в комплексном лечении акне повышает эффективность базисной терапии, способствует сокращению ее длительности и сохранению клинического и эстетического результата.
Системное и локальное действие препарата Лаеннек обеспечивается пептидными факторами, входящими в его состав. Они способствуют балансировке гуморальной регуляторной сети, в том числе в результате нормализации локального гормонального гомеостаза. Как следствие, нормализуется функционирование клеток кожи, улучшаются процессы регенерации и заживления ран.
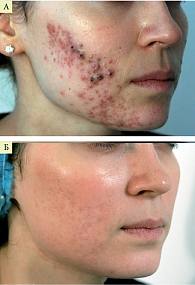
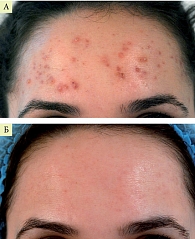
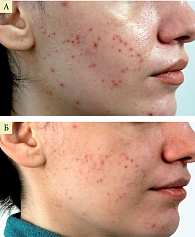
На рисунках 1 и 2 представлена динамика клинических проявлений акне средней степени тяжести на фоне терапии препаратом Лаеннек. Препарат вводился внутривенно капельно по 4 мл два раза в неделю, курс – 6–10 инъекций. Одновременно осуществлялось локальное введение (фармафорез), курс – 8–10 сеансов. Результат применения одной процедуры фармафореза препарата Лаеннек при легкой степени тяжести акне продемонстрирован на рис. 3.
Известно, что андрогены способствуют более интенсивному потоотделению у мужчин по сравнению с таковым у женщин в аналогичных ситуациях. Это различие появляется в период пубертата.
На потовые железы приходится более половины активности 5-альфа-редуктазы, в них также экспрессируются андрогеновый рецептор и ферменты, необходимые для конверсии дегидроэпиандростерона в дигидротестостерон.
Однако секреторная активность потовых желез не зависит от андрогенов напрямую. Установлено, что терапия андрогенами не стимулирует потоотделение у взрослых женщин и не снижает его у мужчин.
Андрогены формируют различие между полами, но не поддерживают его. Возможно, это достигается благодаря дифференциации апоэккриновых желез. Апоэккриновые железы – особый вид потовых желез, которые во время пубертата развиваются из эккриновых или эккриноподобных предшественников. В ответ на аналогичную нервную стимуляцию они развивают секреторную активность в семь раз выше, чем другие потовые железы. Их избыток может быть причиной развития гипергидроза [5].
Эстрогены
Существует два внутриклеточных рецептора к эстрогенам – альфа и бета. Они принадлежат к суперсемейству ядерных гормональных рецепторов и гомологичны примерно на 60%. Кроме того, рецепторы обладают одинаковой аффинностью к эстрадиолу.
В большинстве случаев эстрогены действуют по классическому геномному пути, то есть связываются с рецептором в зоне ядра и влияют на геном клетки. Однако в ряде случаев клеточный ответ на эстрогены наступает быстрее, чем это возможно при чисто геномном ответе. Эстрогеновые рецепторы (ЭР) могут актививировать сигнальные каскады вторичных мессенджеров, в том числе аденилатциклазу, циклический аденозинмонофосфат, фосфолипазу С, протеинкиназу С, лиганд- и вольтажзависимые ионные каналы. В одних случаях ЭР-альфа противостоит ЭР-бета, в других – выступает как его гетеродимер или гомодимер, регулируя активность ряда генов, в том числе антипролиферативных [6].
Изучение первичной культуры фибробластов женской кожи показало, что эти клетки экспрессируют мРНК и белки для ЭР-альфа и ЭР-бета. С помощью методов иммуногистохимии выявлено, что ЭР-бета экспрессируется преимущественно в зоне ядра, ЭР-альфа – в ядре и цитоплазме. Это еще раз подтверждает, что эстрадиол не только воздействует на экспрессию генов, но и вызывает клеточный ответ. Интересно, что в фибробластах кожи в период постменопаузы эстрадиол повышает экспрессию собственных рецепторов [7]. Возможно, это позволяет сохранить на необходимом уровне клеточные эффекты эстрадиола в условиях системной гипоэстрогении.
Эстрогены препятствуют старению кожи, истончению эпидермиса, поддерживая тургор.
Изменения кожи и способы их коррекции
Пери- и постменопауза – самые сложные периоды в онтогенезе женской репродуктивной системы. После многих лет ритмичных колебаний эстрогенов и прогестерона в рамках менструального цикла начинается период перестройки. Нарушается координация между гипоталамусом, гипофизом и яичниками. По мере снижения количества фолликулов и, следовательно, уровня ингибина увеличивается уровень фолликулостимулирующего гормона. Уровень эстрадиола сначала резко колеблется, потом неуклонно снижается. Его влияние на органы и системы женского организма ослабевает, развивается гипоэстрогения.
Выключение функции яичников физиологично, однако очень часто организм женщины не может в полной мере адаптироваться к его последствиям. Такая дезадаптация проявляется вазомоторными (приливы жара, ночная потливость) и психосоматическими (раздражительность, вялость, головные боли, расстройства сна и др.) симптомами, которые отмечаются у 35–80% женщин в пери- и постменопаузе. Указанные симптомы значительно ухудшают качество жизни. Со временем к указанным симптомам присоединяются урогенитальные проблемы и разные обменные нарушения [8].
В пери- и постменопаузе кожа представляет особый интерес для клиницистов. Во-первых, проблемы кожи более очевидны. Изменение состояния кожи может стать причиной обращения к врачу и мотивацией начать лечение.
Во-вторых, при угасании функции яичников кожа переходит на самообеспечение эстрогенами. Нормализация ее функции позволит локально компенсировать гипоэстрогению.
Улучшение состояния кожи будет способствовать улучшению психологического состояния женщин. Как следствие, повысятся адаптационные возможности организма.
Кожные проблемы в пери- и постменопаузе разнообразны. Снижение уровня эстрадиола при сохранной активности тестостерона приводит к выделению более вязкого секрета сальными железами. Кожа становится более сальной, в некоторых случаях развивается акне.
Кроме того, тестостерон стимулирует рост волос, особенно в области лица.
Гипоэстрогения обусловливает перераспределение подкожной жировой клетчатки. В результате появляются морщины, кожа теряет свою подвижность. Уменьшение объема жировой ткани в молочных железах обусловливает изменение их формы.
Дефицит эстрогенов приводит к снижению синтеза и регенерации коллагена и эластина. Волокна изнашиваются, особенно при перегрузке солнечной радиацией, развивается эластоз.
Поскольку эстрогены отчасти контролируют рост и функцию кожных капилляров, вследствие их дефицита снижается и кожный кровоток. Базальный слой эпидермиса лишается необходимого количества кислорода и микронутриентов. Рост кожи замедляется, она становится тоньше, а за счет более активной потери влаги – более сухой.
Такая кожа не способна выполнять свои функции как прежде, в том числе гормональные.
Чтобы устранить или отсрочить указанные выше изменения кожи, необходима как топическая, так и системная терапия.
С этиотропной точки зрения целесообразна менопаузальная гормональная терапия (МГТ). Однако у такой терапии есть ряд противопоказаний. Поэтому согласно рекомендациям Международного общества по менопаузе женщины, которым МГТ противопоказана, а также женщины, которые отказываются применять гормональные препараты, могут использовать иные средства для предотвращения проблем со здоровьем в пери- и постменопаузе [9].
Кроме того, для оздоровления кожи одних гормонов недостаточно. Коже необходимы минералы, мукополисахариды, нуклеиновые и органические кислоты.
Различные витаминно-минеральные комплексы не решат данную проблему, поскольку такой состав очень сложно сформировать искусственно и многие низкомолекулярные органические вещества имеют низкую биодоступность. Возможный выход – использование плацентарных препаратов (ПП). Одним из наиболее изученных препаратов этой группы является Лаеннек (корпорация Japan Bio Products). Препарат разработан в Японии при поддержке правительства страны и сейчас применяется во многих странах мира.
Лаеннек представляет собой раствор очищенного гидролизата плаценты человека, содержащий нуклеиновые кислоты, витамины, жирные кислоты, минералы, интерлейкины и др. Препарат выпускается в ампулах объемом 2 мл для в/м и в/в капельных инъекций.
Производственный цикл препарата Лаеннек состоит из нескольких этапов с многократным контролем качества согласно требованиям GMP (Good Manufacturing Practic – Надлежащая производственная практика). Это обеспечивает стерильность биологического материала.
Лаеннек применяется для антиэйджинговой терапии и в косметологии. Он обладает антиоксидантными и противовоспалительными эффектами. Его применение способствует улучшению регенерации кожи и восстановлению ее функций, в том числе гормональной.
Несмотря на системную гипоэстрогению, кожа начинает регулировать собственные обменные и трофические процессы посредством интракринного и аутокринного действия ее стероидов. При этом необходимость в синтезе эстрогенов de novo отсутствует – нужной концентрации можно достичь путем конверсии андростендиона и дегидроэпиандростерона, содержащихся в препарате Лаеннек. Этот процесс также уравновешивает андрогенные и эстрогенные кожные эффекты.
На фоне терапии препаратом Лаеннек уменьшается количество морщин и пигментных пятен, повышаются эластичность и тонус кожи. Указанные эффекты близки к эффектам МГТ.
На этом сходство действия ПП и МГТ не заканчивается.
В рандомизированном двойном слепом плацебоконтролируемом исследовании изучалась эффективность препарата Лаеннек для облегчения климактерических симптомов. 108 его участниц были разделены на две группы. Пациентки основной группы в течение четырех недель получали ПП в виде инъекций. На фоне проводимой терапии отмечено достоверное снижение индекса Купермана – -12,3 против -7,15 балла в контрольной группе, p = 0,012 [10]. В другом исследовании с аналогичным дизайном в основной группе данный индекс снизился на 14,0 ± 9,4 балла, в контрольной – на 7,6 ± 5,7 балла (p < 0,001) [11].
Еще в одном исследовании пациентки в возрасте от 40 до 64 лет применяли Лаеннек в течение восьми недель. Контрольная группа получала инъекции физиологического раствора. На фоне терапии ПП достоверно сократилось количество баллов по шкале степени менопаузы (MRS II) (p = 0,03), а также повысился уровень эстрадиола (p = 0,03) [12].
Перспективным представляется сочетание препарата Лаеннек с мелатонином, который за счет тканевых антиоксидантных эффектов и влияния на гипоталамо-гипофизарную систему купирует климактерические симптомы.
Эффективность ПП в целом и препарата Лаеннек в частности в отношении улучшения состояния кожи достигается не только за счет опосредованного воздействия на интра- и паракринную гормональную функцию, но и за счет увеличения концентрации инсулиноподобного фактора роста 1 в сыворотке крови [12], стабилизации уровня холестерина, ферментов печени в сыворотке крови [13], индуцирования восстановления естественной пигментации кожи и волос вследствие модуляции экспрессии медь-зависимого фермента тирозиназы и тирозиназа-связанных белков 1 и 2 [14].
Заключение
Интракринные, паракринные и аутокринные эффекты эстрогенов, образующихся в тканях-мишенях, позволяют поддержать состояние организма в условиях гипоэстрогении. К сожалению, эти механизмы очень чувствительны к различным видам стресса. Избыток свободных радикалов, дефицит микронутриентов и другие факторы препятствуют сбалансированной конверсии андрогенов в эстрогены. Гормональный дисбаланс обусловливает запуск механизмов старения. Прежде всего это отражается на состоянии и функциях кожи.
Улучшить состояние кожи в период пери- и постменопаузы и восстановить ее функции возможно с помощью препарата Лаеннек.
D.I. Burchakov, A.G. Stenko, A.M. Talybova, A.V. Gilels
I.M. Sechenov First Moscow State Medical University
Institute of Plastic Surgery and Cosmetology, Moscow
Corporation RHANA, Moscow
Contact person: Denis Igorevich Burchakov, dr.burchakov@yandex.ru
Human skin maintains hormone-dependent homeostasis by means of auto-, intra- and paracrine action of locally produced sex steroids. This production is executed by balanced conversion of hormone precursors. Perimenopause and subsequent systemic lack of estrogen disrupt this balance. Skin condition deteriorates, worsening psychological difficulties, typical for this period of life. Human placenta extracts with their complex compound of active substances recover skin’s ability to self-regulate hormone action and restore it’s esthetics and function.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.