Кератопластика с использованием консервированной частично выделенной десцеметовой мембраны у пациентов с эндотелиальной патологией
- Аннотация
- Статья
- Ссылки
- English
Эндотелиальная кератопластика предполагает замену нефункционирующего заднего эпителия роговицы. Данная технология направлена на восстановление зрения и сохранение структурной целостности глаза. Обычно используется предварительно заготовленный консервированный материал. В связи с этим ведется поиск эффективных и безопасных растворов и способов консервации дефицитного донорского материала. Предварительная подготовка материала на дооперационном этапе позволяет существенно снизить риск его отбраковки и сократить общее время хирургического вмешательства.
Цель – проанализировать результаты хирургического лечения пациентов с эндотелиальной патологией с помощью кератопластики с использованием консервированной частично выделенной десцеметовой мембраны.
Обследовано и пролечено десять пациентов. Использовались как стандартные офтальмологические, так и высокоспециализированные методы исследования: биомикроскопия, визометрия, фоторегистрация, оптическая когерентная томография (ОКТ), зеркальная биомикроскопия.
После хирургического лечения у всех пациентов отмечались стойкое повышение остроты зрения и регресс отека роговицы. По данным ОКТ, толщина в центральной зоне роговицы варьировалась в пределах нормальных значений (450–540 мкм) на протяжении всего периода наблюдения, плотность эндотелиальных клеток соответствовала средним послеоперационным значениям (1500–2200 кл/мм2).
Кератопластика с использованием консервированной частично выделенной десцеметовой мембраны позволяет значительно повысить остроту зрения, сократить время операции без потери ее эффективности. Это безопасный и эффективный способ лечения пациентов с эндотелиальной патологией.
Эндотелиальная кератопластика предполагает замену нефункционирующего заднего эпителия роговицы. Данная технология направлена на восстановление зрения и сохранение структурной целостности глаза. Обычно используется предварительно заготовленный консервированный материал. В связи с этим ведется поиск эффективных и безопасных растворов и способов консервации дефицитного донорского материала. Предварительная подготовка материала на дооперационном этапе позволяет существенно снизить риск его отбраковки и сократить общее время хирургического вмешательства.
Цель – проанализировать результаты хирургического лечения пациентов с эндотелиальной патологией с помощью кератопластики с использованием консервированной частично выделенной десцеметовой мембраны.
Обследовано и пролечено десять пациентов. Использовались как стандартные офтальмологические, так и высокоспециализированные методы исследования: биомикроскопия, визометрия, фоторегистрация, оптическая когерентная томография (ОКТ), зеркальная биомикроскопия.
После хирургического лечения у всех пациентов отмечались стойкое повышение остроты зрения и регресс отека роговицы. По данным ОКТ, толщина в центральной зоне роговицы варьировалась в пределах нормальных значений (450–540 мкм) на протяжении всего периода наблюдения, плотность эндотелиальных клеток соответствовала средним послеоперационным значениям (1500–2200 кл/мм2).
Кератопластика с использованием консервированной частично выделенной десцеметовой мембраны позволяет значительно повысить остроту зрения, сократить время операции без потери ее эффективности. Это безопасный и эффективный способ лечения пациентов с эндотелиальной патологией.
Введение
По данным Всемирной организации здравоохранения, роговичная слепота – одна из основных причин инвалидности по зрению в мире – 5,1%, в России – 18%. Эндотелиальная патология характеризуется нарушением насосной и барьерной функций эндотелиальных клеток, скоплением жидкости под эпителиальным слоем, отеком надлежащих частей роговицы. Чаще в практике офтальмолога встречаются такие эндотелиальные патологии, как буллезная кератопатия (БК) и эндотелиальная дистрофия роговицы Фукса (ЭДРФ). Причины, вызывающие БК, вторичны. К ним можно отнести воспалительные и травматические воздействия вследствие операций на переднем отрезке глаза. Причины ЭДРФ первичны, обычно генетически обусловлены [1–3].
Для клинической картины БК и ЭДРФ характерны следующие симптомы: отек роговицы, начинающийся в строме и прогрессирующий в эпителиальный слой (образуются микроцисты, которые превращаются в буллы), болевой синдром различной степени выраженности при самопроизвольном вскрытии пузырей, активное слезотечение, повышенная чувствительность к свету из-за нарушения слезной пленки, частые кератиты. Острота зрения стремительно снижается наряду с прогрессированием отека и появлением складок в центральной части роговицы [4].
В настоящее время золотым стандартом хирургического лечения БК является задняя послойная кератопластика. В клинической практике наиболее часто применяются такие операции, как DSAEK (Descemet's Stripping Endothelial Keratoplasty – задняя автоматизированная кератопластика) и DMEK (Descemet Membrane Endothelial Keratoplasty – трансплантация десцеметовой мембраны). Эти операции имеют преимущества и недостатки, однако с точки зрения селективности задняя автоматизированная кератопластика относительно проста в исполнении. Трансплантация десцеметовой мембраны (ДМ) более ориентированное вмешательство, обеспечивающее высокие функциональные результаты. Среди ее преимуществ – минимальный индуцированный астигматизм из-за отсутствия швов, малые разрезы, небольшой объем трансплантируемой ткани, низкий процент реакций отторжения, короткий период реабилитации [5]. В то же время техническая составляющая такой операции более сложная, во многом из-за трудоемкого процесса подготовки трансплантата ДМ, осложненного риском его повреждения и отбраковки, что в условиях глобального дефицита донорского материала рассматривается важным лимитирующим фактором [6]. В связи с этим в современной клинической практике применяются технологии дооперационной подготовки и консервации роговицы, то есть трансплантатов ДМ в условиях глазного банка [7]. Такой подход позволяет сократить время операции и свести к минимуму риск повреждения роговицы во время хирургического вмешательства.
По данным литературы, в нашей стране практика предварительной консервации ДМ достаточна скудная, однозначного отработанного алгоритма не существует. Отсутствие зарегистрированных для клинического применения специальных картриджей делает невозможным создание так называемых preload-систем в короткие сроки [8, 9].
Таким образом, разработка и адаптация методов к текущим техническим возможностям являются актуальной задачей, решение которой позволит сократить время операции и предотвратить риск отбраковки материала.
Цель – проанализировать результаты хирургического лечения и особенности разработанной технологии предварительного выделения и консервации ДМ, а также обосновать эффективность ее применения в клинической практике.
Материал и методы
Обследовано и пролечено десять пациентов (десять глаз): пять пациентов с БК и пять пациентов с ЭДРФ. Всем пациентам выполнено хирургическое вмешательство в виде кератопластики с использованием консервированной частично выделенной ДМ через роговичный разрез 2,75 мм. Срок наблюдения составил сутки, шесть месяцев и год соответственно. Хирургическое вмешательство и послеоперационный период во всех случаях протекали без осложнений.
Для проведения оптической когерентной томографии (ОКТ) использовали прибор Optovue (США), для подсчета плотности эндотелиальных клеток – зеркальный микроскоп Tomey 3000 (Япония).
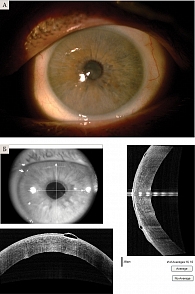
Хирургическое лечение выполнено десяти пациентам с диагнозом БК и ЭДРФ и жалобами на низкую остроту зрения вдаль и вблизи. Зрение стало снижаться постепенно после экстракции катаракты с имплантацией интраокулярной линзы, проведенной по месту жительства. Возникли светобоязнь, ощущение инородного тела, очковая коррекция уже не давала эффекта. У пациентов с БК на поверхности роговицы отмечались единичные буллы (рис. 1А).
Максимально корригированная острота зрения до операции у пациентов с БК и ЭДРФ составляла 0,1 ± 0,2, внутриглазное давление в норме. Плотность эндотелиальных клеток (ПЭК) измерить не удалось из-за выраженного отека, буллезных изменений. ОКТ центральной зоны роговицы – 637 ± 220 мкм (рис. 1Б). Биомикроскопия: роговица отечна, оптический срез утолщен, на передней поверхности буллы, передняя камера глубокая, влага передней камеры прозрачна, радужка структурна, зрачок правильной круглой формы, в центре глубоко лежащие структуры не просматриваются.
Пациентам выполнена трансплантация ДМ. Корнеосклеральный лоскут устанавливали эндотелием наружу, окрашивание выполняли красителем MembraneBlue, после чего удаляли сектор шлеммова канала. Получив доступ к краю ДМ, с помощью шпателя формировали тоннель длиной 2–3 мм к центру роговицы. В сформированный тоннель вводили ирригационную канюлю. С помощью тока жидкости отслаивали ДМ от подлежащих тканей. Сформировавшийся пузырь дренировали, корнеосклеральный лоскут вместе с отсепарованной ДМ помещали в консервационную среду Борзенка – Мороз. Перед кератопластикой корнеосклеральный лоскут с частично выделенной ДМ устанавливали в ложе панча диаметром 7,5 мм (Barron, Katena, США), выполняли несквозную трепанацию и сепаровывали готовый трансплантат с помощью тока жидкости, тем самым исключали физический контакт инструментов с материалом. После ДМ аспирировали в инжектор и использовали для имплантации. Расправление ДМ происходит за счет серии легких ударов и нажатий на поверхность роговицы. Операцию завершали введением воздушно-газовой смеси (10% SF6 и стерильный воздух) в переднюю камеру.
В послеоперационном периоде применяли тобрамицин 0,3% по одной капле три раза в день, дексаметазон 0,1% по одной капле три раза в день в течение 30 дней, затем два раза на протяжении двух месяцев и один раз в день два месяца, препараты искусственной слезы – по одной капле три раза в день в течение полугода.
Результаты
Результаты оценивали через сутки, неделю, шесть месяцев и год после оперативного лечения.
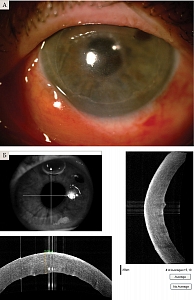
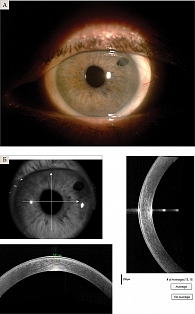
Биомикроскопическая картина через сутки после операции: окружающие ткани глаза не изменены, хемоз конъюнктивы со смешанной инъекцией в области послеоперационной инъекции, узловой шов в области тоннельного разреза на 11 часах чистый, состоятельный. Роговица прозрачная, эпителизация неполная. Оптический срез утолщен, умеренный отек стромы, трансплантат со складками десцеметовой мембраны адаптирован полностью, наложений нет. Передняя камера глубокая, пузырь газа на 1/2 перекрывает область зрачка. Радужная оболочка структурна, зрачок круглый, заднекамерная интраокулярная линза в правильном положении, центрирована. Глазное дно не офтальмоскопируется. Острота зрения – 0,3 ± 0,2. Посчитать ПЭК не представлялось возможным из-за сохранявшегося отека (рис. 2А и 2Б). Vis через шесть месяцев после операции – 0,8 ± 0,1; ПЭК варьировалась в пределах 1690–2245 кл/мм2, ОКТ в центральной зоне роговицы – 450 ± 150 мкм. Vis через год после хирургического вмешательства – 1,0; ПЭК – 1636 ± 479 кл/мм2, ОКТ – 450 ± 150 мкм. Тонометрия сохранялась в пределах нормы (рис. 3А и 3Б).
У всех пациентов были достигнуты высокие функциональные результаты, исчезли жалобы на светобоязнь, ощущение инородного тела, боль. Острота зрения сохранялась без регресса на протяжении всего срока наблюдения. Показатели гидродинамики также оставались в пределах нормальных значений на протяжении всего периода наблюдения. Отторжения трансплантата не зафиксировано. Повторного введения газовоздушной смеси не потребовалось ни в одном случае.
Заключение
Во всех случаях после хирургического лечения удалось достичь улучшения зрительных функций, которые оставались стабильными на протяжении всего периода наблюдения. Кератопластика с использованием консервированной частично выделенной ДМ эффективна у пациентов с БК и ЭДФ. Благодаря данному методу общее время операции значительно сокращается.
Авторы заявляют об отсутствии конфликта интересов.
R.R. Ibragimova, I.A. Loskutov, PhD, A.A. Kovrizhkina, A.Yu. Andreev
I.M. Sechenov First Moscow State Medical University
M.F. Vladimirsky Moscow Regional Scientific Research Institute
Research Institute of Eye Diseases
Contact person: Raisa R. Ibragimova, Rafael669@yandex.ru
Until recently, penetrating keratoplasty was considered the leading treatment for corneal transparency, but nowadays surgeons prefer selective methods. Endothelial keratoplasty is a technology of replacement of non-functioning posterior corneal epithelium. This technology is a pathogenetically directed vector of vision restoration and preservation of the structural integrity of the eye. Pre-prepared preserved material is often used for material preparation. Therefore, effective and safe solutions and methods for the preservation of scarce donor material are being sought. Preliminary preparation of the material at the preoperative stage allows to significantly reduce the risk of its rejection and reduce the total time of surgical intervention.
The aim of the present work is to study the results of surgical treatment of patients with endothelial pathology by keratoplasty using preserved partially isolated descemet membrane.
This work was based on the examination and treatment of 10 patients. Both standard ophthalmological and highly specialised research methods such as: biomicroscopy, visometry, photoregistration, optical coherence tomography, mirror biomicroscopy were used.
According to the results of the surgical treatment, all patients showed persistent increase of visual acuity, regression of corneal oedema. According to the optical coherence tomography data, the thickness in the central zone of the cornea varied within normal values (450–540 μm) during the whole period of observation, the density of endothelial cells corresponded to the average postoperative values (1500–2200 kl/mm2).
Thus, the use of keratoplasty with the use of preserved partially isolated descemet membrane allows to significantly increase the visual acuity of patients, reduce the time of surgery without losing its effectiveness. It is a safe and effective way to treat patients with endothelial pathology, improving the process of surgical intervention.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.