Клеточные механизмы сна: нейроглиальные регуляции
- Аннотация
- Статья
- Ссылки
- English
Участие астроцитов глиальных клеток в развитии сна
Расширение области изучения процессов сна от связей между нейронами [1] до множественных нейроглиальных взаимодействий и открытия новых свойств цитоскелета в совокупности с визуализацией ионных потоков [2] расширили пространство нейрофизиологии сна до континуума активной среды мозга [3]. В этом континууме объединены в общее пространство деятельность множества церебральных клеток с микроциркуляцией крови в капиллярах с током лимфы в крошечных протоках вокруг клеток с динамикой градиентов ионов. Активная среда мозга под влиянием разнообразных активаций, изменяясь во время сна, контролирует через транскрипты экспрессию молекулярных регуляторов клеточных, межклеточных, внутриклеточных взаимодействий в нервной системе в состоянии сна [4, 5].
В активной среде мозга астроциты глиальных клеток обеспечивают структурную и метаболическую поддержку нейронов, а их близость к кровеносным сосудам и микропротокам церебральной лимфатической системы позволяет им участвовать в формировании и поддержании гематоэнцефалического барьера, обеспечивая нервно-сосудистые взаимодействия и регулируя интенсивность кровотока в нейронных пулах [6–8]. Астроциты за счет внеклеточного калия регулируют ионный и водный гомеостаз [9, 10]. Они нейтрализуют активные формы кислорода [11], а также участвуют в процессах созревания и трансформации синапсов [12]. Кроме того, астроциты, будучи участниками воспалительных реакций нервной системы [15], поддерживают фагоцитоз [16]. Астроциты взаимодействуют друг с другом через щелевые соединения и формируют обширные сети, модулирующие активность множества нейронных центров [17–20]. Эти функциональные сети участвуют в реализации сложных интегральных функций, таких как локомоция, дыхание, жевание, глотание, вокализация, перистальтика желудочно-кишечного тракта, кормление, проприоцептивная регуляция, сохранение положения тела и других двигательных автоматизмов, а главное – поддержание многочисленных ритмических адаптаций, лежащих в основе цикла «сон – бодрствование» (ЦСБ) [21–23]. Астроциты модулируют циркадианные ритмы с помощью своих молекулярных часов. Тем самым они играют ключевую роль в поддержании циркадианных ритмов как фундаментального процесса регуляции сна. Наиболее изучены молекулярные и клеточные механизмы деятельности циркадианных часов. Молекулярная регуляция реализуется через замыкание так называемой петли обратной связи транскрипции/трансляции множественных генов. Решающую роль в супрахиазматическом ядре играет экспрессия генов, кодирующих белки PER и CRY, задающих период и амплитуду астроцитарных молекулярных часов. При этом реализация посттранскрипционных процессов во многом обеспечивается путем фосфорилирования/дефосфорилирования и убиквитинирования. Следует отметить, что петля обратной связи транскрипции/трансляции не замыкается исключительно астроцитами. Нейроны также участвуют в поддержании циркадианной ритмичности. Хотя недавно было доказано, что только астроцитарных часов вполне достаточно для управления как циркадианными колебаниями в нервной системе, так и околосуточными изменениями поведения мышей [25].
От молекулярной к клеточной регуляции сна
Связь молекулярной регуляции астроцитарных часов с клеточной прослеживается на примере циркадианных преобразований гамма-аминомасляной кислоты (ГАМК), осуществляемых транскриптомной регуляцией транспортеров ГАМК посредством трех нейротрансмиттеров GAT1, GAT2, GAT3. Однако главная роль в этом отводится нейротрансмиттеру GAT3. Именно он демонстрирует самую сильную циркадианную регуляцию [26]. Причем днем активация GAT3 снижает уровень ГАМК, активируя нейроны и высвобождая множество нейропептидов циркадианной сигнализации в нервной системе. Ночью снижение уровня GAT3, наоборот, ведет к накоплению внеклеточной ГАМК, что уменьшает возбудимость окружающих нейронов. Такая зависящая от времени суток модуляция поглощения ГАМК позволяет астроцитам на клеточном уровне стимулировать нейронную активность днем и подавлять ее ночью. Благодаря этому механизму обеспечивается синхронизация ГАМКергической сигнализации с молекулярными циркадианными ритмами [26]. Это свидетельствует о роли астроцитов в циркадианной регуляции ЦСБ на молекулярном и клеточном уровнях.
Сравнительно недавно была приоткрыта тайна, связанная с одной из интригующих загадок сомнологии – механизмом деятельности щелевых контактов астроцитов в ЦСБ. Все началось с транскрипционного анализа астроцитов коры головного мозга и подкорковых образований во время ЦСБ. Были выявлены существенные различия в экспрессии генов на протяжении этого цикла. Выяснилось, что из всех астроцитарных транскриптов, изменяющихся в состоянии бодрствования, 55 транскриптов сверхэкспрессируются во время сна. При этом ген CIRP посредством связывающего белка взаимодействует с нетранслируемыми участками сотен транскриптов, способствуя синтезу белка, пролиферации клеток и ингибированию апоптоза [27]. В то же время ген UBA1 кодирует фермент, участвующий в деградации белка и синаптическом гомеостазе сна. В отличие от этого во время бодрствования наблюдается избыточная экспрессия гораздо большего количества транскриптов (почти 400). Их значительная часть участвует в формировании внеклеточного матрикса и в синтезе цитоскелета клеток астроцитарных сетей [2]. Интересно, что среди этих транскриптов есть ген GJB6, кодирующий белок коннексин 30 (Cx30). Экспрессия коннексинов регулируется на транскрипционном и трансляционном уровнях. Она достаточно динамична из-за короткого периода жизни как самого белка, так и области щелевого контакта, где он располагается. Вновь образованная молекула каждого коннексина имеет свою структуру с внутриклеточными, внеклеточными и мембранными доменами. Каждый из них выполняет определенную функцию. В процессе миграции к плазматической мембране коннексины концентрируются в гексагональную структуру – коннексон-субъединицу щелевых мембранных полуканалов, образующих поры диаметром 1,5 нм, обеспечивающие высокую морфологическую пластичность астроцитов [29]. За счет указанных механизмов астроциты быстро трансформируют собственные периферические процессы. Как правило, это происходит в ответ на активацию нейронов для изменения уровня синаптического глутамата в головном мозге. Благодаря этому во время бодрствования астроцитарные влияния всегда реализуются ближе к синапсам, облегчая трансформацию глутамата. Вместе с тем снижение активности астроцитов во время сна способствует диффузии глутамата, что усиливает синхронизацию нейронов и ведет к развитию медленного сна [2]. Конечно, необходимы дальнейшие тщательные исследования данного механизма в различных областях мозга, участвующих в динамике сна и бодрствования.
Другой немаловажный момент – энергетические нейроглиальные взаимодействия в ЦСБ. Сегодня не вызывает сомнения, что астроциты играют ключевую роль в регуляции сна посредством экспрессии мРНК, кодирующей белок, оперирующий с жирными кислотами. Этот белок FABP7 регулирует внутриклеточный транспорт жирных кислот, особенно в астроцитах. Он запускает сигнальные каскады, управляющие ростом, морфологией и подвижностью клеток в целом [30], что может нарушать сон у мышей и людей [31]. Вместе с другими белками FABP7 необходим для транспорта лактата в энергообмене между астроцитами и нейронами во время сна [2].
Гликоген хранится в астроцитарном дереве и служит энергетическим резервом, который, расщепляясь на глюкозу и лактат через астроцитарные листочки, обеспечивает нейронный метаболизм нейрональной активации [32]. Изначально казалось, что восстановление астроцитарного гликогена во время медленной фазы сна – ключевая функция этого состояния [33], компенсирующего истощение запасов гликогена в мозге во время бодрствования [34, 35]. Но впоследствии возникла «гликогенетическая» гипотеза, согласно которой синтез и использование гликогена неизменно возрастают в состоянии бодрствования. В то же время снижение возбуждения нейронов во время сна создает дисбаланс, который и приводит к накоплению гликогена [36]. Поэтому восстановление гликогена происходит преимущественно во время бодрствования [37]. Повышенная экспрессия гликогенсинтазы киназы-3β, ключевого фермента синтеза гликогена, связана скорее с фрагментацией состояний и не затрагивает регуляцию общей продолжительности периодов сна или бодрствования [38].
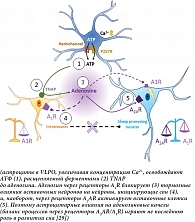
Следовательно, вместо простого восполнения запасов клеточной энергии астроцитарное накопление и деградация гликогена, по-видимому, имеют решающее значение для поддержания цикличности периодов бодрствования и сна. Помимо накопления энергии астроциты демонстрируют внутриклеточные динамические кальциевые колебания, которые необходимы для модуляции нейронной активности, глиотрансмиссии и осуществления переключений в ЦСБ. Так, астроциты за счет изменения концентрации внутриклеточного Са2+ при участии ферментов тканевой неспецифической фосфатазы (TNAP) в вентролатеральной преоптической области гипоталамуса (VLPO) управляют механизмом аденозиновых качелей, регулирующих сон (рисунок) [29].
И еще один момент. Негативное влияние недосыпания на выработку энергии за счет снижения липидного обмена, уменьшения транспорта глюкозы и лактата указывают на способность астроцитов адаптировать функционирование нейронов путем восстановления энергетического метаболизма во время сна [31].
Пространство нейроглиальных взаимодействий в состоянии бодрствования и сна
Как уже упоминалось, астроциты взаимодействуют между собой через щелевые контакты. Эти контакты образованы коннексинами Cx30 и Cx43, объединенными в гексагональные коннексомы, которые реализуют обмен малыми молекулами в пространстве глиальной сети. Пространственные размеры такой сети определяются количеством взаимодействующих астроцитов. Причем за счет изменений экспрессии коннексинов расширяется или уменьшается пространство сети. Это в свою очередь модулирует нейронную возбудимость, что важно для регуляции сна [17].
Психостимуляторы, повышающие уровень бодрствования, селективно увеличивают экспрессию Cx30 в коре головного мозга, что усиливает сопряжение астроцитов, но не влияет на уровень Cx43 [39]. Напротив, снотворные агенты, такие как ГАМК, снижают процесс сопряжения астроцитов и уменьшают размер астроцитарной сети. То есть связность астроцитарных сетей динамически меняется в течение ЦСБ [40]. При этом сопряжение астроцитов возрастает в периоде бодрствования и снижается во время сна. Таким образом, астроцитарные сети играют ключевую роль в регуляции процесса сна путем адаптации размера пространства сети под текущие физиологические потребности.
Такая динамическая модуляция не только сказывается на деятельности кортикальных нейронов, но и влияет на активность нейронных сетей подкорковых образований мозга. На это указывает то, что подавление нейронной активности тетродотоксином способно значительно уменьшать размеры пространства астроцитарной сети [20]. И наоборот, повышенная активность зрительной коры за счет усиленного притока афферентных раздражителей приводит к увеличению до 70% экспрессии Cx30 [40]. Становится понятно, что астроциты способны тонко настраивать нейронную возбудимость, модулируя размер пространства своей сети как динамического регулятора возбудимости нейронов и запуска переходов от сна к бодрствованию и наоборот. Астроцитарные сети физиологически оптимизированы под балансировку нейронной возбудимости церебральных образований для регуляции ритмичности сна. Нарушение оптимизации из-за чрезмерного уменьшения или увеличения размера сети деформирует нейронную организацию процесса бодрствования или фрагментирует развитие сна за счет изменений нейроглиальных взаимодействий.
Есть еще один важный момент в понимании пространства астроцитарной сети: астроциты не являются однородной популяцией. Они демонстрируют заметную гетерогенность по областям мозга, что отражает региональную специализацию и демонстрирует их эволюционные корни [41]. Такое разнообразие, вероятно, приводит к специфическому региональному вкладу в регуляцию сна, поскольку астроциты разных областей мозга экспрессируют различные рецепторы. Например, астроциты коры головного мозга модулируют медленноволновую активность во время ночного сна, регулируя уровень внеклеточного глутамата и способствуя синхронизации нейронов [42]. И наоборот, астроциты подкорковых отделов переднего мозга, похоже, необходимы для поддержания бодрствования, поскольку их стимуляция вызывает длительное возбуждение без компенсаторного восстановления сна [43]. Аналогично астроциты преоптической области латерального ядра гипоталамуса, согласно результатам экспериментов, усиливают быстрый сон за счет высвобождения аденозина, который воздействует на нейроны, активные в состоянии бодрствования [44]. Помимо этих специфичных региональных функций астроциты играют важную роль в гомеостазе сна, а их внутриклеточная динамика Ca2+ связана с потребностью в сне. Исследования показали, что активность астроцитов Ca2+ наиболее высока в состоянии бодрствования и снижается во время сна. В большей степени это выражено после длительного периода бодрствования, что указывает на потенциальную роль астроцитов преоптической области латерального ядра гипоталамуса в нарастании давления сна [29, 45]. Однако вопрос, управляют ли астроциты переходом между состояниями сна и бодрствования или только поддерживают участие нейронных цепей в регуляции этих процессов, остается открытым.
Заключение
Несмотря на растущее признание роли астроцитов в регуляции сна, серьезные методологические проблемы пока не позволяют точно оценить их вклад. Одно из основных ограничений – невозможность выделить функции, специфичные для астроцитов, из-за их сложного взаимодействия с нейронами, микроглией и сосудистыми клетками. Интеграция передовых методов, таких как одноклеточная транскриптомика, микроскопия с высоким разрешением и пространственная протеомика, может дать более глубокое представление об астроцитах. В сочетании с новыми приемами протеомики это способно расширить представление о гетерогенности астроцитов и уточнить их функциональную роль в регуляции сна. И конечно, не следует забывать, что деятельность астроцитов связана с нейровоспалением, фагоцитозом и реактивным глиозом, то есть с теми процессами, которые развиваются при нарушениях сна вплоть до нейродегенеративных изменений [46]. Исходя из этого астроциты могут играть не последнюю роль в развитии таких патологий, как бессонница, гиперсомния и фрагментация сна, часто встречающихся при нейродегенеративных процессах [46, 47]. Поскольку нарушения сна затрагивают более трети населения и представляют серьезную угрозу для здоровья, понимание роли астроцитов в регуляции сна имеет ключевое значение.
Будущие исследования, направленные на совершенствование экспериментальных стратегий, расширят представление о специфичности астроцитов, а также их взаимодействии с другими глиальными клетками и нейронами для целенаправленного фармакологического влияния на расстройства сна.
Публикация подготовлена в рамках выполнения ГЗ ЮНЦ РАН, проект № 125011200139-7.
Ye.V. Verbitsky, PhD, Prof.
Federal Research Center Southern Scientific Center of the Russian Academy of Sciences, Rostov-on-Don
Contact person: Yevgeny V. Verbitsky, e_verbitsky@mail.ru
The entire biota, which includes a wide variety of living beings (from cellular forms of life to plants and animals, including humans), is influenced by the rotation of our planet around its axis. Over the course of approximately 4 billion years, changes in light and shadow, temperature, humidity, and other geophysical factors have transformed the functioning of all living beings on Earth. These changes have been genetically encoded in the form of circadian adaptations that are synchronized with environmental fluctuations. Thanks to the rapid development of cell physiology and the widespread use of electrophysiological research methods in the 20th and early 21st centuries, many important aspects of sleep-wake cycles have been revealed. Numerous mediators have been discovered that regulate the activity of various neural systems involved in maintaining wakefulness, sleep development, and sleep disorders. For some time, it seemed that the receptors of these systems were the most appropriate targets for effective pharmacotherapy of sleep disorders. However, new technologies in neuroscience and sleep medicine have cast doubt on these hopes, as new insights into the neuroglial interactions of the nervous system and their role in regulating the ‘sleep – wake’ cycle have emerged. Therefore, the current focus is on the involvement of astrocytes in the development of sleep, the molecular and cellular mechanisms of sleep regulation, and the significance of regulating neuroglial interactions during sleep and wakefulness.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.