количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Корнеотерапия как метод коррекции эпидермальных нарушений при хронических дерматозах у детей
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Дерматовенерология и дерматокосметология" № 3
- Аннотация
- Статья
- Ссылки
Приводятся современные представления о формировании барьерных свойств кожи и раскрываются патогенетические особенности их нарушения при воспалительных и десквамативных дерматозах у детей. По результатам клинического исследования эффективности монотерапии препаратом Латикорт крем 0,1% (гидрокортизона бутират) в сравнении с комбинированной терапией препаратом Латикорт крем и Клобейз крем у детей, больных атопическим дерматитом, показано, что применение комбинированной терапии быстрее уменьшает выраженность основных клинических проявлений заболевания, продлевает ремиссию и позволяет сократить длительность терапии топическим кортикостероидом.
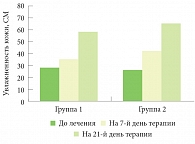
Рис. 1. Изменение показателей увлажненности кожи пациентов
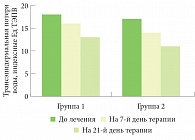
Рис. 2. Изменение показателей ТЭПВ у пациентов
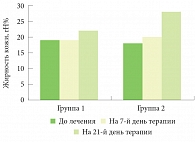
Рис. 3. Изменение показателей жирности кожи пациентов

Рис. 4. Динамика эритемы кожи пациентов
Являясь основным органом человека, контактирующим с внешней средой, кожа осуществляет множество функций, позволяющих человеческому организму сохранять гомеостатические константы. В условиях современной экологической ситуации значительно участились случаи неблагоприятного воздействия на кожу различных аллергенов, поллютантов, а также физических и химических факторов [1]. В этой связи большую актуальность приобретает защита барьерных свойств кожи и их восстановление у пациентов, страдающих дерматозами, в основе которых лежат воспалительные и десквамативные процессы, происходящие в эпидермисе.
В первую очередь это касается детей первых лет жизни, имеющих ряд анатомо-конституциональных особенностей строения кожи, обусловливающих незрелость эпидермальных и дермальных барьерных структур. К таким особенностям относятся нежный и рыхлый эпидермис, тонкая базальная мембрана, нейтральный или слабощелочной уровень рН поверхности кожи, повышенная проницаемость эндотелия сосудов, высокая резорбционная способность жирорастворимых веществ.
Защитные свойства кожи реализуются посредством многочисленных кооперативных взаимодействий различных структур эпидермиса, дермы, клеток местного иммунологического надзора, экскреторной функцией сальных и потовых желез и т.д.
Одну из ведущих ролей среди защитных барьеров эпидермиса в настоящее время отводят роговому слою. Наружные ряды клеток, регулярно отторгаясь, очищают поверхность кожи от внешних загрязнений и микробных агентов, в средней зоне расположены плотно упакованные ряды корнеоцитов, образующие малопроницаемый слой, в нижней части располагается липидный эпидермальный барьер.
Считается, что роговой слой представляет собой не отмершие участки кожи с аморфной массой кератиновых нитей, а живую, динамичную и очень активную ткань с выраженным метаболизмом в межкератиноцитарном матриксе таких липидов, как церамиды, гликосилцерамиды, свободные сфингоидные основания, холестерин и его сульфаты, жирные кислоты, фосфолипиды и некоторые другие. Кроме того, это ткань, характеризующаяся упорядоченной структурой и движением кератиноцитов [2, 3, 4]. При этом липиды рогового слоя отличаются от находящихся на поверхности кожи липидов кожного сала как своим составом, так и способностью организовывать определенные структуры, от состояния которых зависит надежность барьера [5]. Церамиды – это сфинголипиды, которые представляют собой соединения сфингоидного основания (с количеством атомов углерода от 16 до 32) и жирной кислоты (олеиновая, линолевая и др.). Двойные ковалентные связи жирных кислот прочно, подобно цементу, скрепляют липидные пласты между собой, а также с роговыми «кирпичиками» корнеоцитов. Следствием этой уникальной особенности строения рогового слоя является обеспечение одной из жизненно важных функций кожи – предотвращения трансэпидермальной потери воды.
Содержание и распределение воды в роговом слое играют важную роль в поддержании его прочности и контроле проницаемости. Для обеспечения надежности эпидермального барьера важное значение имеет и наличие на его поверхности водно-липидной мантии Маркионини, являющейся смесью кожного сала, секрета эккринных потовых желез и церамидов рогового слоя [2].
Эмульгирование кожного сала происходит благодаря гидрофильным высокомолекулярным спиртам и холестерину, входящему в его состав. При этом на поверхности кожного покрова устанавливается слабокислый уровень рН (4,5–5,5). Благодаря такому составу данная водно-липидная эмульсионная пленка выполняет ряд уникальных функций:
Эмульгирование кожного сала происходит благодаря гидрофильным высокомолекулярным спиртам и холестерину, входящему в его состав. При этом на поверхности кожного покрова устанавливается слабокислый уровень рН (4,5–5,5). Благодаря такому составу данная водно-липидная эмульсионная пленка выполняет ряд уникальных функций:
- поддержание нормальной эластичности кожи, препятствие ее пересушиванию;
- поддержание постоянной температуры тела (за счет изменений ее физического состава);
- нейтрализация щелочей органическими жирными кислотами, поддержание постоянного слабокислого уровня pH;
- подавление размножения микроорганизмов благодаря свободным низшим жирным кислотам кожного сала;
- один из путей экскреции продуктов метаболизма, лекарственных и токсических веществ.
Таким образом, сложная динамическая система межклеточных взаимодействий и межкератиноцитарного обмена липидов создает стойкий, малопроницаемый эпидермальный барьер, надежно защищающий организм от воздействия факторов внешней среды, а также предотвращающий трансэпидермальные потери влаги.
Одним из частых клинических проявлений многих кожных заболеваний, в частности, ихтиоза, кератодермии, атопического дерматита, экземы, псориаза, хейлита, болезни Дарье, болезни Девержи и др., является сухость кожи.
Сухая кожа – это истонченная кожа с шелушением и/или мелкими трещинами и субъективным ощущением стягивания. Причинами сухости, как правило, являются дегидратация рогового слоя и нарушения кератинизации, свидетельствующие о снижении барьерной функции кожи. В некоторых случаях изменение проницаемости кожи является первичным патогенетическим звеном, влекущим за собой комплекс патологических изменений, в других случаях нарушение барьерной функции рогового слоя ухудшает течение уже существующих заболеваний [5]. В последнее время все большее число исследователей доказывают, что во многих случаях в развитии воспаления и гиперплазии эпидермиса существенную роль играют цитокины, вырабатываемые самими кератиноцитами при повреждении эпидермального барьера. Установлено, что сразу после повреждения рогового слоя повышается концентрация интерлейкина альфа (ИЛ-1-альфа) и фактора некроза опухоли альфа (ФНО-альфа), которые действуют по сигнальному механизму – каждая сигнальная молекула способна стимулировать выработку других сигнальных молекул с различными функциями, которые, в свою очередь, побуждают клетки к секреции новых биологически активных веществ [5, 6].
При повреждении рогового слоя в эпидермисе развивается ответная реакция, направленная на восстановление его липидных структур. Если восстановление происходит недостаточно быстро, то клетки эпидермиса подвергаются массированной атаке со стороны микроорганизмов и токсинов, в процессе которой поврежденные кератиноциты начинают секретировать цитокины, запускающие воспалительную реакцию. Воспаление всегда сопровождается продукцией свободных радикалов, что приводит к дальнейшему повреждению клеток эпидермиса, которые уже не могут обеспечить полное восстановление липидного барьера, поэтому эпидермис постепенно обезвоживается. Кожа становится сухой, шелушащейся и воспаленной.
Наиболее распространенным заболеванием кожи в детской дерматологической практике является атопический дерматит (АтД) [7]. Нарушения барьерных свойств кожи при этом дерматозе связаны со сложными и многогранными процессами, протекающими в эпидермисе. Так, в роговом слое отмечается снижение уровня свободных церамидов, в частности С1-линолеата, который играет важную роль в формировании билипидного слоя и которому принадлежит особо важная роль в защитном механизме при повторном раздражении – именно с его нехваткой связывают предрасположенность кожи к экзематозным реакциям под воздействием различных ирритантов. Кроме того, отмечается повышение активности фермента сфингомиелиназы, свободных жирных кислот, сфингозинфосфатидилхолина, на которые в значительной степени влияют уровень рН и осмотическое давление. Все это в значительной степени нарушает нормальную регуляцию метаболизма липидов, оказывает влияние на гидролитическую деградацию корнеодесмосом при терминальном разъединении роговых клеток и высвобождение кератиноцитами ИЛ-1-альфа, активирующего ответ эпидермиса на внешние раздражители. Помимо сказанного, имеются данные о дефиците филагрина у пациентов, страдающих АтД. Аминокислоты, высвобождающиеся в процессе деградации этого белка, в норме создают высокое осмотическое давление в клетке, создавая приток воды в корнеоциты по градиенту концентраций, делая роговые чешуйки упругими. Напротив, обезвоживание эпидермиса стимулирует выброс провоспалительных цитокинов, способствуя формированию кожных патологических реакций [3, 7].
Указанные изменения приводят к формированию атопического ксероза, нарушению барьерных функций кожи и снижению ее способности препятствовать агрессии различных микробных агентов, играющих важную роль в хронизации воспаления, носящего атопический или неатопический характер. Сегодня уже общеизвестно, что практически в 100% случаев АтД кожный покров пациентов колонизирован штаммами золотистого стафилококка, который высевается как с пораженных, так и с непораженных участков кожи. При этом клинические признаки инфекционного процесса на коже нередко отсутствуют [7, 8].
Колонизация золотистым стафилококком становится возможной вследствие наличия на клеточной стенке бактерий рецепторов адгезинов к ламелину и фибронектину эпидермиса, формирования фолликулярных структур между клетками золотистого стафилококка и корнеоцитами, что приводит к формированию бактериальной биопленки, участвующей в адгезии стафилококка [9].
Кроме стафилококка при АтД высеваются и другие микроорганизмы, наиболее часто – стрептококк. Зачастую в очагах поражения обнаруживается микст-инфекция.
Нарушения барьерных свойств кожи наблюдаются и у пациентов с псориазом. Эти изменения происходят вследствие снижения концентрации свободных и связанных церамидов C3b, C5 и В соответственно. Вместе с тем отмечается снижение уровня экспрессии свободных церамидов – C2, C3a и C4; кислот – гидроксикислот, жирных кислот (олеатов и линолеатов, ковалентно связанных с корнеоцитами). Совокупность указанных трансформаций приводит к изменениям сцепления корнеоцитов и нарушениям десквамации.
Особенностью нарушений барьерных свойств кожи при ихтиозе является снижение уровней свободных церамидов C3b, C5 и уровня сфингозина на фоне повышенной концентрации свободных церамидов C2, C3a и C4. Результатом этих процессов является формирование ретенционного гиперкератоза [2].
Кроме того, нарушения эпидермального барьера у детей, страдающих воспалительными дерматозами, могут быть вызваны многочисленными внешними воздействиями, приводящими к повреждению кожного покрова, в том числе расчесами, травмами, различными аллергенами и ирритантами, вторичной инфекцией, а зачастую и неправильным уходом за кожей [1]. В известной степени нарушает барьерные свойства кожи и неправильное использование больными наружных лечебных и косметических средств. В особенности это касается часто применяемых глюкокортикостероидных лекарственных препаратов, которые вызывают изменения липидного барьера кожи.
Целями наружной терапии воспалительных и десквамативных дерматозов и состояний кожи у детей являются купирование воспаления и зуда путем назначения противовоспалительных средств, а также восстановление водно-липидного слоя и барьерной функции кожи посредством использования смягчающих питательных средств. Важен также и адекватный уход за кожей после лечения, осуществляемый с использованием очищающих и увлажняющих средств, позволяющих продлить ремиссию у пациентов [10].
Для проведения рациональной наружной терапии необходимо оценивать характер и локализацию морфологических изменений кожи. Выбирать лекарственное средство следует с учетом механизмов его действия, а подбор адекватной лекарственной формы осуществлять в зависимости от активности воспалительного процесса, выраженности сухости кожи и степени нарушения ее барьерных свойств.
В качестве современных средств увлажнения кожи используют различные лечебные косметические формы. Одни из них – средства непосредственного увлажнения на основе натуральных увлажняющих компонентов (пирролидонкарболовая кислота, мочевина, производные молочной кислоты), липосом, полиолов, полисахаридов, хондроитинсульфатов, коллагена, эластина и др. Вторая косметическая форма средств, препятствующих потере воды, представляет собой средства, в состав которых входят вещества, образующие пленку на поверхности кожи, – воски, вазелин, парафин, пергидросквален, ланолин, многоатомные спирты, жирные кислоты, триглицериды, силиконы; либо препараты с кератолитическим действием.
Особенностью современных тенденций создания средств лечебной косметики является комбинация биосовместимых увлажнителей и пленкообразующих веществ; кроме того, в состав многих таких средств входят микроэлементы. Тем самым достигается наибольшая эффективность увлажнения и дополнительная модификация действия посредством включения тех или иных микроэлементов [11].
Тем не менее, если обратиться к динамике восстановления кожи, становится очевидно, что эффективное восстановление ее барьерной функции наблюдается лишь при использовании смеси трех ключевых липидов (церамидов, холестерина и жирных кислот), взятых в определенном, а именно в эквимолярном, соотношении [5]. Кроме того, важно помнить, что, несмотря на косметологические инновации последних лет, не все кремы, состоящие из вышеуказанных ингредиентов, могут хорошо переноситься пациентами, страдающими воспалительными и десквамативными поражениями кожи.
В этой связи особенно выделяется зарегистрированный в России Клобейз крем, производимый компанией «Ельфа А.О.» (Польша). В состав Клобейз крема входит медилан, представляющий собой высокоочищенный ланолин. Медилан является эффективным увлажняющим и смягчающим средством, поскольку обладает рядом химических и физических свойств, которые схожи со свойствами липидов рогового слоя кожи человека, и именно поэтому он может имитировать и усиливать многие функции кожных липидов человека [12].
Биоэквивалентность медилана и кожных липидов человека подразумевает как химическое подобие (сходство со структурой холестерина, ланостерина и других восковых эфиров, чистых и этерифицированных жирных кислот, углеводородов), так и физическое (фазовый переход из твердого состояния в жидкое при температуре кожи человека, способность образовывать жидкокристаллические структуры, мультиламеллярные (многослойные) везикулы и частично окклюзионные пленки).
Установлено, что благодаря своим биомиметическим свойствам медилан накапливается преимущественно в областях между корнеоцитами и проникает в межклеточные липидные бислои, а также в трехслойные структуры, образуя наружную оболочку корнеоцитов [12]. Медилан, входящий в состав Клобейз крема, обеспечивает вторичный механизм, посредством которого в роговом слое эпидермиса может храниться влага, дополнительная к тому запасу, который имеется в липидных бислоях [13, 14].
И медилан, и все остальные компоненты Клобейз крема зарекомендовали себя как безопасные и эффективные:
- вазелин – «золотой стандарт» создания окклюзионной пленки;
- белый пчелиный воск – смесь эфиров жирных кислот и спиртов – хорошо впитывается кожей и придает ей упругость;
- пропиленгликоль – «несущий элемент» – обладает стабилизирующим и увлажняющим эффектом;
- сорбитана сесквиолеат – эмульгатор.
На базе детского отделения ГБУЗ «Клинический кожно-венерологический диспансер» Департамента здравоохранения Краснодарского края было проведено исследование, целью которого явилась сравнительная оценка эффективности монотерапии препаратом Латикорт крем для наружного применения 0,1% (гидрокортизона бутират) в сравнении с комбинированной терапией Латикорт кремом и Клобейз кремом у детей, больных АтД.
В открытое проспективное исследование было включено 80 детей в возрасте от 3 до 17 лет с АтД средней тяжести. Пациенты были разделены на 2 группы по 40 человек, сопоставимые по гендерному и возрастному составу, а также по антропометрическим данным пациентов и тяжести течения АтД, оцененной по индексу SCORAD. Исходные показатели индекса SCORAD в группе наблюдения колебались от 12,3 при легкой форме АтД до 78,5 при тяжелой форме заболевания. Пациенты 1-й группы наносили на пораженные участки кожи Латикорт крем 2 раза в день тонким слоем, пациенты второй группы – Латикорт крем 2 раза в день и Клобейз крем 2 раза в день; Латикорт и Клобейз наносили на кожу раздельно с интервалом между нанесениями не менее 1 часа. Длительность курса лечения в обеих группах не превышала 21 день и зависела от индивидуальной динамики регресса кожного патологического процесса.
Клиническую эффективность оценивали на основании следующих критериев: увлажненность кожи, трансэпидермальная потеря воды (ТЭПВ), жирность (сухость) кожи, уровень pH, выраженность эритемы.
Измерение биофизических параметров кожи проводилось на диагностическом комбайне Multi Skin Test Center MC 900 до, во время и после лечения.
Уже к 7-му дню лечения у детей отмечалась положительная динамика регресса кожного патологического процесса – уменьшались эритема, сухость кожи, шелушение, отчетливо наблюдалась эпителизация трещин. Субъективно дети старшей возрастной группы отмечали снижение ощущения зуда и чувства стянутости кожи. К 14–21-му дню лечения заметно уменьшалась выраженность лихенификации, значительно улучшалась текстура кожи, определяемая при пальпации. Отсутствие эффекта наблюдалось у 1 ребенка (1,25%) с тяжелой формой АтД, сочетавшейся со сложной полиорганной патологией. Достоверность уменьшения основных симптомов атопического дерматита наглядно демонстрируют показатели измерений мультитестера (рис. 1–4). В дальнейшем, к 20-му дню лечения, у большинства больных детей 2-й группы было отмечено стойкое улучшение показателей и состояния кожного покрова.
У больных детей 2-й группы показатели увлажненности кожи, ТЭПВ и сухости кожного покрова нормализовывались более быстро по сравнению с больными 1-й группы. Так, увлажненность кожи к концу терапии составила 65 СМ, что является достаточным уровнем увлажненности и превышает этот показатель в 1-й группе на 10,8%. ТЭПВ к окончанию лечения в 1-й группе соответствовала коже с нарушенным трансэпидермальным барьером, а во 2-й группе – нормальной коже с несколько пониженным барьером. Приблизительно такая же картина наблюдалась при сопоставлении показателей жирности кожи: у детей 1-й группы кожа к концу лечения была более сухой, ее жирность составила 22 rH%, что на 21,4% ниже показателей, отмеченных у пациентов 1-й группы. Интенсивность эритемы во 2-й группе снижалась несколько быстрее.
Таким образом, комбинированное использование кремов Латикорт и Клобейз приводит к более быстрому уменьшению основных проявлений АтД по сравнению с монотерапией топическими кортикостероидами.
В результате наблюдения за пациентами обеих групп было установлено, что средняя длительность использования препарата Латикорт крем в 1-й группе составила 14,2 ± 1,3 дня, а во 2-й – 7,3 ± 0,8 дня.
Таким образом, включение Клобейз крема в комбинированную терапию обострения АтД позволило уменьшить длительность использования топического глюкокортикостероида.
В сравнении с группой, получавшей монотерапию Латикорт кремом, наступление ремиссии у пациентов группы, использовавшей комбинированное наружное лечение с дополнительным применением Клобейз крема, ускорялось в 2,35 раза. Пациентам с проявлениями атопического хейлита Клобейз крем назначался на зоны поражения 3–5 раз в день. Это позволило уже в течение первой недели наблюдения добиться значительной положительной динамики в большинстве случаев. Значительно уменьшались отечность, шелушение, сухость кожи, морщиноподобная складчатость в углах рта, активно эпителизировались трещины, заметно ослабевали ощущения жжения и зуда.
Клобейз крем использовался в качестве средства наружной терапии у пациентов с ламеллярным, вульгарным и Х-сцепленным ихтиозом, а также ихтиозиформной эритродермией Брока. Явления крупнопластинчатого шелушения у больных значительно уменьшались через 1,5–2 недели его применения.
Каких-либо нежелательных и побочных реакций при использовании данных наружных средств не отмечалось ни у одного пациента.
Адекватное использование местного лечения с применением современных дерматологических технологий безопасно, обеспечивает стойкую ремиссию заболеваний, предупреждает их рецидивирование и значительно улучшает качество жизни маленьких пациентов и членов их семей.
1. Аравийская Е.Р., Соколовский Е.В., Соколов Г.Н. и др. Эритема лица, особенности диагностики и ухода за кожей // Клин. дерматология и венерология. 2003. № 3. С. 69–73.
2. Скрипкин Ю.К. Кожные и венерические болезни. Руководство для врачей в 4-х т. Т. 3. М.: Медицина, 1995. С. 239–292.
3. Суворова К.Н., Тогоева Л.Т., Гришко Т.Н. и др. Корнеотерапия при воспалительных и десквамативных дерматозах у детей // Вопр. соврем. педиатрии. 2005. Т. 4. № 6. С. 39–44.
4. Kligman A.M. The biology of the stratum corneum // Montagna W., Lobitz M.C. The Epidermis. Jerusalem – New York: Academic press, 1964. 387–433.
5. Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства // М.: ИД «Косметика и медицина», 2005. С. 9–37.
6. Nickoloff B.J., Naidu Y. Perturbation of epidermal barrier function correlates with initiation of cytokine cascade in human skin // J. Am. Acad. Dermatol. 1994. Vol. 30. № 4. P. 535–546.
7. Короткий Н.Г., Тихомиров А.А., Таганов А.В., Моисеенко А.В. Атопический дерматит у детей. Руководство для врачей. Тверь: Издательство «Триада», 2003. С. 35–39.
8. Мазитова Л.П. Роль микробной гиперсенсибилизации в развитии аллергодерматозов у детей // Вестн. дерматологии и венерологии. 2007. № 2. С. 36–38.
9. Leyden J.J., Marples R.R., Kligman A.M. Staphylococcus aureus in the lesions of atopic dermatitis // Br. J. Dermatol. 1974. Vol. 90. № 5. P. 525–530.
10. Смирнова Г.И. Современные технологии местного лечения атопического дерматита у детей // Иммунопатология, аллергология, инфектология. 2003. № 3. С. 75–82.
11. Man MQ M., Feingold K.R., Thornfeldt C.R., Elias P.M. Optimization of physiological lipid mixtures for barrier repair // J. Invest. Dermatol. 1996. Vol. 106. № 5. P. 1096–1101.
12. The Lanolin Book / Ed. by U. Hoppe. Hamburg: Beiersdorf AG, 1999.
13. Clark E.W., Steel I. Microstructure of human stratum corneum treated with lanolin. Poster presentation at American Academy of Dermatology meeting. Poster № 2. Washington D.C., 1993.
14. Clark E.W., Steel I. Investigations into biomechanisms of the moisturizing function of lanolin // J. Soc. Cosmet. Chem. 1993. Vol. 44. P. 181–195.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.