Лучевые методы в скрининге злокачественных новообразований легкого. Обзор достижений
- Аннотация
- Статья
- Ссылки
- English
Для снижения смертности от ЗНО легкого созданы скрининговые программы. Для этого применяются методы лучевой диагностики – флюорография, рентгенография и компьютерная томография. Однако, несмотря на широкое использование и доступность, флюорография и рентгенография имеют технические ограничения, препятствующие выявлению новообразований небольших размеров. Компьютерная томография является наиболее информативным методом для обнаружения ЗНО легкого, и во многих странах имеется опыт применения низкодозной компьютерной томографии в качестве основного метода скрининга. Некоторые из подобных программ доказали свою эффективность.
Алгоритмы искусственного интеллекта способны выступить в качестве инструмента совершенствования скрининга, а дополнительные исследования для определения пациентов целевой группы риска могут увеличить эффективность скрининговых программ.
Для снижения смертности от ЗНО легкого созданы скрининговые программы. Для этого применяются методы лучевой диагностики – флюорография, рентгенография и компьютерная томография. Однако, несмотря на широкое использование и доступность, флюорография и рентгенография имеют технические ограничения, препятствующие выявлению новообразований небольших размеров. Компьютерная томография является наиболее информативным методом для обнаружения ЗНО легкого, и во многих странах имеется опыт применения низкодозной компьютерной томографии в качестве основного метода скрининга. Некоторые из подобных программ доказали свою эффективность.
Алгоритмы искусственного интеллекта способны выступить в качестве инструмента совершенствования скрининга, а дополнительные исследования для определения пациентов целевой группы риска могут увеличить эффективность скрининговых программ.
Введение
Во всем мире среди злокачественных новообразований (ЗНО) рак легкого занимает одну из лидирующих позиций по заболеваемости и смертности для обоих полов [1]. В русскоязычной литературе этот термин является дословным переводом lung cancer. Выделяют два наиболее распространенных гистологических типа опухолей легких: мелкоклеточный и немелкоклеточный [2], что имеет принципиальное значение для проведения лечебных мероприятий и определения прогноза заболевания. Поскольку опухолевый процесс может развиваться из любого типа клеток, а не только эпителиального ростка, охарактеризовать весь спектр новообразований легкого способен только термин «злокачественное новообразование». Именно так обозначена группа заболеваний в Международной классификации болезней 10-го пересмотра (МКБ-10), и поэтому обобщенное название будет использоваться в настоящем обзоре [3].
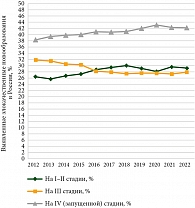
В МКБ-10 ЗНО трахеи, бронхов и легкого присвоены коды С33–С34 [3]. В 2022 г. в России более чем 44 000 пациентов были выставлены диагнозы с этими кодами заболеваний [4]. В период с 2012 по 2022 г. доля пациентов с диагнозами С33–С34, выявленными на запущенной (IV) стадии, выросла до 42,2% (прирост 3,9%), а доля ЗНО, впервые выявленных на I–II стадии, – до 29,2% (прирост 2,8%) (рис. 1) [4]. Эта ситуация побудила Министерство здравоохранения России запустить в 2018 г. национальный приоритетный проект в сфере здравоохранения «Борьба с онкологическими заболеваниями» [5], созданный для обеспечения доступности и качества медицинской помощи для пациентов с ЗНО.
На протяжении долгого времени ЗНО легкого могут иметь бессимптомное течение, вследствие чего существует риск позднего установления диагноза [6]. Для таких пациентов излечение маловероятно, и лишь небольшая их часть выживает дольше 1–2 лет [7]. Залогом хорошего прогноза для пациентов с ЗНО является его выявление на ранних стадиях. Ввиду бессимптомного течения ЗНО легкого на ранних стадиях возникает необходимость реализации программ скрининга у пациентов в группе риска.
Согласно определению Всемирной организации здравоохранения (ВОЗ), скрининг – это выявление той или иной болезни у внешне здоровых лиц с помощью скрининг-тестов. Для скрининга ЗНО легкого возможно применение рентгенографии и флюорографии, а также компьютерной томографии (КТ) органов грудной клетки [8]. Настоящий литературный обзор посвящен изучению возможностей, преимуществ и недостатков данных методов для выявления опухолевых очагов.
Материал и методы
Поиск выполнялся по ключевым словам: chest X-ray, lung cancer, fluorography, screening, low-dose computed tomography, computed tomography, «рентгенография», «флюорография», «скрининг рака легкого», «низкодозная компьютерная томография», «низкодозовая компьютерная томография», «компьютерная томография» в научных базах данных PubMed, eLibrary и поисковой системе Google Scholar за период с 2018 по 2023 г. Двумя авторами независимо производился анализ сначала названия, а затем резюме на предмет соответствия теме литературного обзора; включались оригинальные исследования, систематические обзоры и метаанализы, исключались клинические случаи, литературные обзоры и тезисы конференций. Списки источников включенных публикаций дополнительно анализировались на предмет релевантных публикаций без ограничения по временным рамкам. В процессе написания обзора проводился дополнительный поиск литературы по вопросам, требующим дальнейшего уточнения. Последняя дата поиска – 27.12.2023.
Результаты
Всего в литературный обзор включены 50 источников литературы, из них 31 зарубежная публикация и 19 отечественных публикаций. Пик публикационной активности для оригинальных исследований пришелся на 2022 г.
Флюорография
В 1937 г. бразильским врачом Мануэлем де Абреу при поддержке производителей медицинской техники была предложена новая конструкция рентгеновского аппарата [9], позволявшая с помощью зеркальной оптической системы снимать органы грудной клетки на малоформатную рентгеновскую пленку, выполненную в виде ленты, заряженной в кассету. При этом рентгеновский аппарат имел фиксированное фокусное расстояние и позволял снимать только в вертикальном положении. Предложенная схема существенно удешевила и ускорила обследование, что позволило внедрить массовый скрининг туберкулеза [10].
Скрининговые тесты предназначены не для диагностики, а для выявления людей с высокой вероятностью наличия у них признаков того или иного заболевания. Пациенты, у которых были выявлены положительные или подозрительные результаты, должны направляться к врачам для установления диагноза и необходимого лечения [11]. Скрининг в контексте рентгенографических исследований предполагает просмотр большого числа медицинских изображений врачами-рентгенологами и увеличивает вероятность возникновения врачебных ошибок из-за повышенной нагрузки и пониженного качества исследований. С задачами улучшения качества, хранения и дальнейшего пересмотра помогает справиться оцифровка исследований. Массовое внедрение цифровой флюорографии в России и в мире началось с 1990-х гг. Появление плоскопанельных детекторов и последние технические достижения позволяют сделать вывод о том, что современная цифровая флюорография фактически не отличается по информативности от рентгенографии легких.
В России применение флюорографии в качестве метода скрининга основывается на приказе Минздрава РФ от 27 апреля 2021 г. № 404н «Об утверждении Порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения» [12]. В Российской Федерации диспансеризация имеет централизованный характер и охватывает существенную часть населения [13]. Однако ценность программы диспансеризации периодически подвергается сомнению [13, 14]. Так, отчеты Минздрава России свидетельствуют о 2,6-кратном росте числа выявленных онкологических заболеваний благодаря проведению профилактических осмотров (с 21 300 в 2013 г. до 55 000 в 2019 г.). В то же время, по данным онкологов, вклад диспансеризаций в число впервые выявленных случаев ЗНО не является ключевым и составляет всего 25% в 2013 г. и 36% в 2018 г. [13].
В качестве вспомогательного инструмента могут применяться алгоритмы искусственного интеллекта (ИИ), которые потенциально могут быть включены в соответствующие программы скрининга [15]. Ожидаемый положительный эффект от использования ИИ в лучевой диагностике послужил причиной ряда перспективных организационных решений и проектов в здравоохранении. Ярким примером применения алгоритмов ИИ в рамках российской системы здравоохранения является Московский эксперимент по использованию инновационных технологий в области компьютерного зрения для анализа медицинских изображений и дальнейшего применения в системе здравоохранения г. Москвы, направленный на объективное и комплексное изучение рутинного применения алгоритмов ИИ в практике врача-рентгенолога [16]. В рамках проекта в системе единого радиологического информационного сервиса (ЕРИС) уже функционирует ряд алгоритмов ИИ, среди прочего нацеленных на выявление очагов по данным флюорографии [17]. Качество работы алгоритма часто представляют с помощью ROC-кривой (receiver operating characteristic, «кривая ошибок»), а основной метрикой диагностической точности в Московском эксперименте является площадь под этой кривой – AUC (AUC = area under the curve, «площадь под кривой»). Согласно матрице зрелости ИИ-сервисов по направлению «флюорография», AUC данных алгоритмов достигает 82,5% [18]. Важно отметить, что все представленные сервисы нацелены на выявление целого ряда патологий (минимум семи) и данный показатель на момент написания обзора отражает работу сервиса в целом.
Однако флюорография выполняется в одной проекции, что снижает ее информативность. Более информативным методом является рентгенография (РГ), позволяющая получить двухпроекционное исследование органов грудной клетки.
Рентгенография
В России, согласно приказу Минздрава РФ от 27 апреля 2021 г. № 404н, РГ также может быть использована в качестве скринингового метода при профилактических осмотрах взрослого населения [12]. Методологическим аспектам скрининга с помощью РГ также был посвящен ряд исследований [19–21].
По результатам крупномасштабного исследования скрининга ЗНО предстательной железы, легких, толстой кишки и яичников (Prostate, Lung, Colorectal, and Ovarian trial, PLCO, США), в котором принял участие 154 901 пациент в возрасте 55–74 лет, ежегодный скрининг с помощью РГ грудной клетки в течение четырех лет с последующим наблюдением на протяжении 13 лет в форме ежегодных опросов о состоянии здоровья не привел к значительному снижению летальности от ЗНО легких по сравнению с отсутствием скрининга [19]. В PLCO не было обнаружено никаких различий между группой с ежегодным скринингом и контрольной группой со стандартным ведением в выявленных стадиях ЗНО и их гистологических типах, в обеих группах превалировали III и IV стадии ЗНО легкого. Самый частый гистологический тип был представлен аденокарциномой [19]. В отношении ЗНО легкого Американским онкологическим обществом использование ежегодной РГ не рекомендовано вследствие низкой диагностической точности [20].
Попытка объективной оценки диагностической точности РГ для выявляемости легочных узлов была предпринята в систематическом обзоре J.H. Kim и соавт. [21]. По результатам этого метаанализа чувствительность и специфичность для РГ составили 0,47 (95% доверительный интервал (ДИ) 0,44–0,51) и 0,37 (95% ДИ 0,34–0,40). Отметим, что при исключении из рассмотрения публикаций, демонстрирующих низкую диагностическую ценность РГ (три работы из 12), чувствительность РГ для выявления легочных узлов выросла до 0,61 (95% ДИ 0,56–0,65), специфичность до 0,87 (95% ДИ 0,83–0,91).
В рамках Московского эксперимента функционирует ряд комплексных ИИ-сервисов по направлению «рентгенография органов грудной клетки», в числе прочего нацеленных на поиск объемных образований [17]. AUC для данных алгоритмов в целом достигает 82,2%, что сопоставимо с показателями для флюорографии.
В систематическом обзоре D. Li и соавт. было показано, что применение алгоритмов ИИ способствует повышению чувствительности, специфичности и уменьшению времени описания РГ и КТ [22]. Это подтверждается в более позднем исследовании, проведенном D. Ueda и соавт.: чувствительность результатов описаний врачей общей практики, расшифровывавших рентгенограммы после применения ИИ, возросла с 0,47 до 0,60, а специфичность – с 0,96 до 0,97. Чувствительность при работе врачей-рентгенологов в этом исследовании возросла с 0,51 до 0,60, специфичность не изменилась, составив 0,96 [23]. Тем не менее при оценке другого коммерческого алгоритма ИИ не было выявлено значимой разницы в чувствительности и специфичности между алгоритмом ИИ и врачами-рентгенологами [24]. Чувствительность алгоритма составила 0,90, специфичность – 0,89, в то время как чувствительность результатов описаний врачей была 0,90, а специфичность – 0,95.
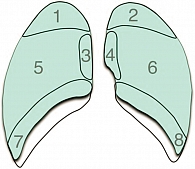
Выявление легочных очагов на рентгенограммах как врачом-рентгенологом, так и алгоритмом ИИ зависит от ряда факторов: размер очага, его контуры и расположение. Осложнено выявление очагов размером менее 10 мм; более того, в медиастинальных, наддиафрагмальных и апикальных зонах легких визуализация очагов затруднена или невозможна (рис. 2, зоны 1–4 и 7–8) вследствие наложения анатомических структур грудной клетки, например органов средостения, костных и хрящевых структур, корней легких [25]. Частота пропущенных ЗНО легкого по данным рентгенографии составляет 20–90% [26]. Наиболее часто отмечаются пропуски ЗНО в апикальных зонах (в 45–81% случаев) [27]. В медиастинальных зонах частота пропусков очагов размером менее 30 мм составляет 65% [27]. Также важно отметить, что для РГ нет международных критериев оценки злокачественности очаговых изменений и при их выявлении пациента следует направить на дообследование с помощью КТ.
Применение алгоритмов глубокого обучения показало наибольшую чувствительность (0,87) для очагов размером 31–50 мм с четкими контурами [28], в то время как для очагов с нечеткими контурами она составила 0,21. Алгоритм лучше всего определял очаги в латеральных отделах (чувствительность 0,87), при этом для всех остальных отделов легких на рентгенограммах показатель чувствительности составил 0,50–0,64 [28].
Анализ рентгенограмм органов грудной клетки с помощью нейронной сети может обнаружить на медицинских изображениях закономерности, которые определяют курильщиков с высоким долгосрочным риском развития рака легкого, для их дальнейшего направления на скрининг с помощью потенциально более информативного метода – низкодозной компьютерной томографии (НДКТ).
Компьютерная томография
«Золотым стандартом» для выявления мелких очагов, характерных для ранней стадии ЗНО легких, является КТ [29]. Главный недостаток КТ – существенная лучевая нагрузка, которая для стандартнодозного протокола составляет примерно 6,1 мЗв [30]. По этой причине КТ никогда не применялась как целевой скрининговый метод. На данный момент возможно применение КТ в рамках оппортунистического скрининга. Оппортунистический скрининг в данном случае подразумевает выявление нецелевой патологии в исследовании, выполненном с конкретной диагностической целью [31]. Одной из задач Московского эксперимента является проверка целесообразности такого оппортунистического подхода [15]. Комплексные ИИ-сервисы по направлению «компьютерная томография органов грудной клетки» имеют максимальный AUC 95,9 [17].
Согласно Европейским рекомендациям, для организованного скрининга ЗНО легкого предлагается применение НДКТ, что позволяет снизить радиационное воздействие на пациента и сохранить приемлемое качество изображений [29]. При применении НДКТ для скрининга в зарубежных исследованиях лучевая нагрузка может составлять от 0,4 до 1,6 мЗв в зависимости от массы тела пациента [32], в Российской Федерации в соответствии с критериями профилактических рентгеновских исследований взрослого населения (СанПиН 2.6.1.1192-03) лучевая нагрузка при скрининге не должна превышать 1 мЗв. Качество изображений при выполнении НДКТ ниже, чем при КТ, но оно может быть улучшено при применении итеративных реконструкций и алгоритмов шумоподавления [33].
Первые программы НДКТ-скрининга были проведены в 1990-х гг. [34], благодаря им было показано, что НДКТ превосходит РГ в выявлении мелких некальцинированных очагов, которые могут являться признаками ЗНО легкого на ранней стадии. За последние 20 лет в различных странах было проведено более 20 скрининговых программ. В пяти программах было выявлено снижение летальности от ЗНО легкого (NLST, NELSON, MILD, LUSI, National Lung Cancer Screening program cohort study), в большей части других исследований статистически значимого снижения летальности выявлено не было [34].
В Российской Федерации также проводились аналогичные программы скрининга с помощью НДКТ, например Московский скрининг рака легкого, скрининг в Тюменской области [35, 36]. В опубликованных работах были показаны потенциальные эффективность и целесообразность проведения подобных программ. На основании Московского скрининга рака легкого также была создана общедоступная анонимизированная база данных НДКТ с очагами в легком [37].
Чувствительность НДКТ для выявления легочных очагов составляет 0,97 (95% ДИ 0,94–0,98), существенно превосходя показатель для РГ (среднее значение в диапазоне 0,47–0,82); специфичность на схожем с РГ уровне 0,87 (95% ДИ 0,82–0,91) [38].
Классификация выявленных при НДКТ легочных узелков и прогнозирование их злокачественности являются важными задачами при скрининге ЗНО легкого. В 2014 г. Американский колледж радиологии опубликовал руководство Lung-RADS по интерпретации результатов НДКТ в скрининге ЗНО легкого, основной целью которого было стандартизировать интерпретацию изображений врачами-рентгенологами и определить рекомендации по тактике ведения пациентов в зависимости от характеристик выявленных очагов в легком [39]. Последняя версия этого руководства вышла в 2022 г. Оценка в первую очередь основывается на размере, структуре, форме и темпе роста очагов. Согласно этим критериям подозрение на злокачественность начинается для следующих выявленных изменений:
- солидный очаг ≥ 8 и < 15 мм (≥ 268 и < 1,767 мм3) при первичном исследовании, или увеличивающийся < 8мм (< 268 мм3), или новый от 6 до < 8 мм (от 113 до < 268 мм3);
- субсолидный очаг размером ≥ 6мм (≥ 113 мм3) с солидным компонентом ≥ 6 мм и < 8 мм (≥ 113 и < 268 мм3) при первичном исследовании или появление или увеличение солидного компонента размером < 4 мм (< 34 мм3);
- эндотрахеальный или эндобронхиальный очаг (сегментарный или субсегментарный узел в бронхах при первичном исследовании);
- атипичная легочная киста с толстыми стенками, или многокамерная киста при первичном исследовании, или киста в динамике, ставшая многокамерной.
Было показано существенное согласие между врачами-рентгенологами при классификации очагов в легких по категориям Lung-RADS, основной причиной разногласий являлся выбор разных изменений наиболее подозрительными на наличие злокачественности [40].
Расхождения в интерпретации могут привести к увеличению времени последующего наблюдения и необоснованным биопсиям [40]. В качестве способов повышения согласованности измерений можно выделить измерение объема (волюметрию) вместо изменения линейного размера [41].
Рекомендованы следующие критерии группы высокого риска для скрининга ЗНО легкого: возраст от 55 до 74 лет с минимальным стажем курения 30 пачка/лет (индекс пачка/лет = количество пачек сигарет, выкуриваемых в день × количество лет курения), курение в настоящее время или отказ от курения в течение последних 15 лет, отсутствие установленного диагноза ЗНО легкого [42]. Тем не менее было показано, что на Тайване примерно 53% пациентов с выявленным ЗНО легкого никогда не курили [43], а для популяции Китая при указанной выше группе риска частота пропущенных диагнозов может достигать 90,8%, что является обоснованием для пересмотра критериев популяции скрининга [44]. На данный момент исследования, посвященные применимости рекомендованной группы риска при скрининге ЗНО легкого, для других стран пока не проводились.
Применение математических алгоритмов ИИ для НДКТ-скрининга обычно рассматривается с точки зрения снижения количества ошибок и повышения эффективности работы [45]. На основании данных Московского скрининга рака легкого было показано, что чувствительность и специфичность алгоритма ИИ для автоматизированного выявления очагов в легких составили 0,82 и 0,93 соответственно [46]. Систематический обзор, посвященный выявлению и классификации легочных очагов, продемонстрировал, что чувствительность алгоритмов составляет 0,34–0,99, а специфичность – 0,71–1,0 [47]. Однако недавнее исследование, проведенное S. Park и соавт., не показало значимого увеличения согласованности между рентгенологами при применении ИИ: коэффициент каппа Флейса 0,60 (95% ДИ 0,57–0,63) до применения ИИ по сравнению с 0,65 (95% ДИ 0,63–0,68) после применения ИИ [48]. Мы считаем, что это могло быть связано как с выбором разного доминантного узла врачами (по утверждению авторов рукописи), так и с особенностями работы алгоритма ИИ, не приведенными в публикации.
ИИ также нашел свое применение как метод шумоподавления для улучшения качества НДКТ-изображений. Большое количество публикаций указывает на активное развитие этой области. Однако на момент написания настоящего обзора были опубликованы только систематические обзоры, не сопровожденные метаанализами [49, 50]. Методы, основанные на глубоком обучении, способны лучше, чем традиционные, обучаться и автоматически обнаруживать признаки и их сочетания даже без предварительной информации, в то время как традиционные методы (например, итеративные реконструкции, методы обратной фильтрованной проекции) по-прежнему имеют проблемы, связанные с наличием артефактов и высокой вычислительной стоимостью. Тем не менее значимым недостатком таких решений являются технические сложности внедрения алгоритмов в информационные системы медицинских организаций [50].
В заключение можно сделать вывод, что, несмотря на достигнутые успехи в разработке и применении алгоритмов ИИ в качестве вспомогательного инструмента врача-рентгенолога для диагностики рака легкого, по-прежнему остаются вопросы, требующие дальнейшего изучения.
Заключение
ЗНО легкого являются одной из лидирующих причин заболеваемости и смертности от злокачественных новообразований для обоих полов в мире. Для скрининга ЗНО легкого с помощью методов лучевой диагностики возможно применение флюорографии, рентгенографии и компьютерной томографии. Несмотря на низкую стоимость и повсеместное использование, флюорография и РГ не предоставляют существенных преимуществ по сравнению с КТ. Возможным решением для увеличения эффективности флюорографии с точки зрения скрининга ЗНО является применение алгоритмов ИИ с целью выявления пациентов, которым необходимо дообследование с помощью КТ.
КТ является наиболее информативным методом лучевой диагностики для выявления ЗНО легкого, но вследствие высокой лучевой нагрузки данный метод никогда не применялся для целевого скрининга. По всему миру проводились различные программы скрининга с применением низкодозной КТ, и некоторые из них доказали свою эффективность. Для повышения эффективности скрининговых программ целесообразны изучение возможностей алгоритмов ИИ в комбинации с массовыми профилактическими обследованиями и проведение дополнительных исследований для выявления оптимальной группы риска с позиций клинической и экономической эффективности.
Финансирование
Данная статья подготовлена авторским коллективом в рамках НИР «Оппортунистический скрининг социально значимых и иных распространенных заболеваний» (№ ЕГИСУ: № 123031400009-1) в соответствии с Приказом Департамента здравоохранения города Москвы от 21.12.2022 № 1196 «Об утверждении государственных заданий, финансовое обеспечение которых осуществляется за счет средств бюджета города Москвы государственным бюджетным (автономным) учреждениям, подведомственным Департаменту здравоохранения города Москвы, на 2023 г. и плановый период 2024 и 2025 гг.».
Конфликт интересов
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Благодарности
Авторы выражают благодарность Блохину Ивану Андреевичу, Рыжову Сергею Анатольевичу и Водоватову Александру Валерьевичу за консультирование авторов при написании литературного обзора.
M.M. Suchilova, Yu.A. Vasilev, PhD, N.V. Nudnov, PhD, A.S. Domozhirova, PhD, I.V. Soldatov, R.V. Reshetnikov, PhD
Research and Practical Clinical Center for Diagnostics and Telemedicine Technologies, Moscow
Russian Scientific Center of Roentgenoradiology, Moscow
Contact person: Maria M. Suchilova, suchilovaMM@zdrav.mos.ru
Lung cancer is one of the leading causes of morbidity and mortality worldwide. Lung cancer risk factors are numerous, including heredity, active and passive smoking, environmental and professional conditions, as well as many other conditions, such as chronic obstructive pulmonary disease and HIV infection. Due to prolonged asymptomatic progression, lung cancer can be diagnosed at advanced stages, which significantly worsens the prognosis for these patients.
Screening programs have been established to reduce mortality rates from lung cancer. This involves the use of radiology modalities such as fluorography, radiography and computed tomography. However, despite their widespread use and availability, fluorography and radiography have technical limitations in detecting small-sized neoplasms. Computed tomography is the most informative method for detecting lung cancer and many countries have used low-dose computed tomography as a screening method. Some such programs have proven to be effective.
Artificial intelligence algorithms can act as an additional tool to improve screening, and additional research to identify the optimal group of patients at risk may increase the effectiveness of screening programs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.