Междисциплинарный консенсус RE.GA.IN.: что нового? Часть 2: редкие формы гастрита, гастрит и микробиота желудка, эпидемиология гастрита и связанных с ним предопухолевых и опухолевых изменений
- Аннотация
- Статья
- Ссылки
- English
RE.GA.IN. суммировали существующие научные сведения, чтобы выработать ориентированные на ведение пациента ключевые положения с позиций доказательной медицины, призванные помочь врачам-специалистам в их повседневной клинической практике. В данной статье представлены положения консенсуса RE.GA.IN. относительно редких форм гастрита, микробиоты желудка в условиях воспаления слизистой оболочки желудка, эпидемиологии гастрита и связанных с ними предопухолевых и опухолевых изменений, отражен взгляд на использование искусственного интеллекта при ведении пациентов с гастритом.
RE.GA.IN. суммировали существующие научные сведения, чтобы выработать ориентированные на ведение пациента ключевые положения с позиций доказательной медицины, призванные помочь врачам-специалистам в их повседневной клинической практике. В данной статье представлены положения консенсуса RE.GA.IN. относительно редких форм гастрита, микробиоты желудка в условиях воспаления слизистой оболочки желудка, эпидемиологии гастрита и связанных с ними предопухолевых и опухолевых изменений, отражен взгляд на использование искусственного интеллекта при ведении пациентов с гастритом.


В данной статье представлены положения консенсуса RE.GA.IN. относительно редких форм гастрита, микробиоты желудка в условиях воспаления слизистой оболочки желудка, эпидемиологии гастрита и связанных с ним предопухолевых и опухолевых изменений, использования искусственного интеллекта при ведении пациентов с гастритом [1]. Обзор положений консенсуса RE.GA.IN., отражающих современное представление о базовых определениях, Нelicobacter pylori-ассоциированном и аутоиммунном гастрите, был опубликован ранее [2].
В консенсусе RE.GA.IN. градация голосования экспертов по положениям включала четыре уровня: 1) полное согласие; 2) согласие с незначительными возражениями; 3) несогласие; 4) полное несогласие. Первые два уровня были в итоге объединены как отражение согласия, в то время как последние два уровня рассматривались как несогласие. Положение считалось одобренным консенсусом, если ≥ 80% голосов отражали согласие.
Исходя из типа исследований, уровни доказательности и степень рекомендации для разработки клинических практических рекомендаций основывались на системе GRADE, которая учитывает качество доказательства и силу рекомендаций следующим образом.
Качество доказательства:
- А – высокое качество: маловероятно, что дальнейшие исследования изменят нашу уверенность в оценке эффекта;
- В – умеренное качество: маловероятно, что дальнейшие исследования окажут существенное влияние на нашу уверенность в оценке эффекта и смогут изменить оценку;
- С – низкое качество: дальнейшие исследования с большой вероятностью окажут существенное влияние на нашу уверенность в оценке эффекта, что, скорее всего, изменит оценку;
- D – очень низкое качество: любая оценка эффекта очень неопределенна.
Сила рекомендации:
- сильная рекомендация;
- слабая рекомендация.
2.6. Редкие формы гастрита
Подробное описание характерных признаков редких форм гастрита не являлось приоритетом настоящего консенсуса. В ходе работы экспертной группы подчеркивалась необходимость дальнейшего накопления данных и своевременного анализа последних исследований [1]. Неопределенный этиопатогенетический профиль редких форм гастрита не позволяет проводить специфическую этиологическую терапию. Из-за низкой распространенности и минимального риска развития рака желудка либо отсутствия такового клиническая значимость этих заболеваний остается низкой. Заметным исключением является гастрит, вызванный вирусом Эпштейна – Барр (EBV), который ассоциирован с развитием специфического подтипа рака желудка с уникальными геномными аберрациями и клинико-морфологическими особенностями [3].
2.6.1. Существует несколько установленных, а также предполагаемых факторов риска развития Helicobacter pylori-негативного гастрита (уровень согласия: полное согласие – 52%, согласие с незначительными возражениями – 36%, качество доказательств – С, сила рекомендации – 2).
Комментарий
Существует несколько возможных этиологических факторов хронического H. pylori-негативного гастрита, такие как лекарственные препараты, химическое повреждение, радиация, аутоиммунный гастрит, другие инфекции (например, EBV, цитомегаловирус, Mycobacterium avium intracellulare, Herpes simplex virus) или иммуноопосредованные заболевания (например, лимфоцитарный гастрит, болезнь Крона).
Исследования этиологической роли «не-H. pylori» бактерий рода Helicobacter (non-Helicobacter pylori Helicobacter species – NHPH), передающихся человеку от свиней, собак и кошачьих, показали, что распространенность инфекций, вызванных NHPH, составляет от 0,2 до 6% в зависимости от методов диагностики и обследуемой популяции. Зоонозы человека, вызванные инфекцией NHPH, ассоциированы с хроническим гастритом, язвенной болезнью, MALT-лимфомой низкой степени злокачественности и раком желудка [4].
2.6.2. Хронические (длительно протекающие) гастриты специфической этиологии встречаются редко и обычно представляют собой фенотипическое проявление заболевания, затрагивающего другие отделы желудочно-кишечного тракта. Это может быть заболевание инфекционной или неинфекционной этиологии, которое отличается от гастрита (уровень согласия: полное согласие – 52%, согласие с незначительными возражениями – 48%, качество доказательств – С, сила рекомендации – 2).
Комментарий
Редкие формы гастрита часто бессимптомные, реже с клиническими проявлениями по типу синдрома диспепсии, могут быть выявлены случайно во время гастродуоденоскопии, проводимой в рамках исследования по поводу имеющихся у пациента желудочно-кишечных симптомов, при наличии системных заболеваний в анамнезе или во время плановых профилактических осмотров [5].
За некоторыми исключениями, наши знания об этих формах гастрита получены из отдельных сообщений и относительно небольших серий наблюдений, а причинно-следственная связь с клиническими симптомами еще не установлена [6]. При оценке этиологии очень важно критически осмыслить различные факторы, включая анамнез пациента, клиническую картину и течение заболевания, наличие или отсутствие симптомов, характер поражения, ограниченного лишь слизистой оболочкой желудка (СОЖ) или же связанного с экстрагастральной патологией, а также ответ на лечение.
2.6.3. Лекарственные препараты могут вызывать как острые самоограничивающиеся, так и длительно существующие поражения СОЖ. Идентификация этиологических агентов основывается главным образом на причинно-следственной (временной) связи с приемом препаратов и в некоторых случаях подтверждается результатами морфологического исследования (уровень согласия: полное согласие – 52%, согласие с незначительными возражениями – 48%, качество доказательств – С, сила рекомендации – 2).
Комментарий
Клинические проявления лекарственно-индуцированного гастрита (ЛИГ) весьма разнообразны и варьируют от бессимптомного состояния до легкой диспепсии и клинических симптомов тревоги (признаки острого и хронического желудочно-кишечного кровотечения, анемия). Существенными факторами, определяющими выраженность проявлений, являются доза, продолжительность и тип применяемых препаратов. Лекарства могут также вызывать невоспалительные поражения слизистой оболочки (то есть гастропатию). Они представляют собой поражения, которые не входят в спектр гастрита, но упоминаются здесь в связи с их частой встречаемостью; к ним относятся, в частности, полипы кислотопродуцирующих (фундальных) желез, связанные с длительным приемом ингибиторов протонной помпы (ИПП), и отложения лантана (депозиты), возникающие в результате применения карбоната лантана при лечении гиперфосфатемии у пациентов с хронической почечной недостаточностью [7, 8].
Ключом к установлению диагноза ЛИГ является хронологическая связь между приемом препарата и появлением клинических, эндоскопических и морфологических изменений, а также исчезновение или значительное уменьшение этих проявлений после отмены препарата [9].
Эндоскопические данные неспецифические и включают эритему, петехии и поражения слизистой оболочки (эрозии и язвы), чаще всего наблюдаемые на фоне приема нестероидных противовоспалительных препаратов (НПВП), аспирина, пероральных препаратов железа или калия.
При отсутствии коагулопатии рекомендуется проведение биопсии СОЖ в соответствии со стандартным обновленным протоколом Сиднейской системы. Морфологическая оценка может дать результаты, позволяющие связать конкретные виды лекарств с клиническими проявлениями и повреждением СОЖ (табл. 4). Лечение ЛИГ заключается в отмене препарата и применении антисекреторной терапии (H2-гистаминоблокаторы, ИПП). При наличии H. pylori показана эрадикация, особенно при НПВП/аспирин-индуцированной гастропатии [10]. При гастрите, связанном с ингибиторами иммунных контрольных точек, может потребоваться назначение дополнительной терапии стероидами и инфликсимабом [11, 12].
ЛИГ не прогрессирует при отмене ответственного препарата. Развитие предраковых изменений и рака желудка не было описано при ЛИГ. Интересно, что на фоне применения низких доз аспирина и некоторых НПВП было отмечено снижение риска развития опухолевых заболеваний желудочно-кишечного тракта [13].
2.6.4. Некоторые системные заболевания, в том числе иммуноопосредованные, могут быть связаны с повреждением СОЖ (уровень согласия: полное согласие – 58%, согласие с незначительными возражениями – 42%, качество доказательств – C, сила рекомендации – 2).
Комментарий
Для некоторых иммуноопосредованных системных заболеваний, включая системную красную волчанку, склеродермию, синдром Шегрена и IgG4-ассоциированные заболевания, была выявлена ассоциация с поражением желудка и атрофическим гастритом. Пациенты часто не имеют симптомов, и хронический гастрит обнаруживается случайно во время гастродуоденоскопии, проводимой по другим показаниям [14, 15].
У пациентов с уремией симптомы диспепсии встречаются чаще, чем при других системных заболеваниях, а поражение желудка представляет собой геморрагическую гастропатию [16]. Саркоидоз редко поражает желудочно-кишечный тракт, но при его наличии обычно происходит поражение именно желудка. Обнаруживают гранулемы без некроза, без сопутствующего воспаления, пациенты могут предъявлять жалобы на потерю веса и гипоальбуминемию [17, 18]. Мастоцитоз желудка, обычно ассоциированный с инфильтрацией мастоцитами стенки кишечника, часто проявляется болью в животе и диареей [19].
Диагноз основывается на особенностях клинического течения, серологических данных (при иммуноопосредованных системных заболеваниях), эндоскопическом и морфологическом исследовании. Аутоантитела могут быть обнаружены у некоторой части пациентов (до 55%) с системными заболеваниями и H. pylori-негативным гастритом.
Эндоскопические признаки включают эритему, отек, очаговые петехиальные кровоизлияния, эрозии и язвы. Наиболее распространенные морфологические изменения СОЖ при системных заболеваниях представлены в табл. 5. Опубликованы единичные сообщения о мультифокальной дисплазии низкой степени у пациентов с атрофическим гастритом, связанным с аутоиммунным системным заболеванием [20].
2.6.5. Большинство лимфоэпителиомоподобных карцином желудка этиологически связаны с EBV-инфекцией, в то время как в небольшой группе аденокарцином обнаруживается клональный рост EBV-инфицированных эпителиальных клеток. Отсутствуют убедительные доказательства обнаружения EBV при предраковых изменениях СОЖ (уровень согласия: полное согласие – 80%, согласие с незначительными возражениями – 20%, качество доказательств – С, сила рекомендации – 1).
Комментарий
Этиологическая роль EBV в канцерогенезе желудка до конца не изучена. Предыдущие исследования предполагают причинно-следственную связь между EBV-инфекцией и редким типом карциномы желудка, известной как лимфоэпителиомоподобная (LEL, lymphoepithelioma-like) карцинома желудка [21, 22]. Распространенность EBV-позитивности в мире среди больных LEL составляет 90% [23]. По оценкам, от 7,5 до 10% аденокарцином желудка имеют моноклональные эписомы EBV, при этом значительных различий между популяциями не наблюдается [24].
EBV-позитивный рак желудка является наиболее распространенной EBV-злокачественной опухолью во всем мире, примерно 80 000 случаев регистрируется ежегодно [25]. EBV-позитивный рак желудка имеет демографические, клинико-морфологические и молекулярные отличия от EBV-отрицательных опухолей [26]. Вероятность EBV-позитивности опухоли ассоциирована с мужским полом, курением, локализацией не в антральном отделе желудка, диффузным морфологическим типом рака желудка (по Lauren) и развитием после гастрэктомии. EBV-позитивный статус при раке желудка также является благоприятным прогностическим фактором с точки зрения исхода и возможного ответа на терапию [27]. Наличие сходного иммунного ответа на специфические белки H. pylori как при EBV-позитивных, так и при EBV-негативных аденокарциномах отражает существенную этиологическую роль H. pylori в EBV-позитивном раке желудка [28].
Результаты исследования пациентов с атрофическим гастритом, подтверждающие наличие ДНК EBV методом ПЦР, не содержат информации о локализации вирусных генных продуктов (вирусного генома) в тканях желудка и неубедительны [29]. Необходимы дальнейшие исследования, чтобы прояснить неизученные аспекты EBV-позитивного рака желудка.
2.7. Гастрит и микробиота желудка
Микробиота здорового желудка в основном состоит из транзиторных микроорганизмов, происходящих из полости рта и переносимых в тонкую кишку с желудочным содержимым.
Показатель микробного разнообразия (альфа-разнообразие) более выражен в аспиратах желудка, чем в тканевых образцах. Это подтверждает гипотезу о том, что в нормальных условиях микроорганизмы представлены лишь в слое слизи и не колонизируют поверхность слизистой оболочки. В настоящее время неизвестно, могут ли некоторые виды желудочной микробиоты, не относящиеся к H. pylori, быть вовлечены в развитие воспаления СОЖ в качестве этиологического фактора (например, при H. pylori-негативном гастрите).
При инфекции H. pylori альфа-разнообразие микроорганизмов значительно снижается, при этом происходит факультативное снижение распространенности некоторых видов. После эрадикации H. pylori происходит ремодуляция микробиоты желудка в зависимости от фенотипа постэрадикационного гастрита (неатрофический или атрофический гастрит), что коррелирует с уровнем продукции соляной кислоты. При атрофическом гастрите микробный профиль характеризуется значительным проканцерогенным потенциалом [30].
2.7.1. Инфекция H. pylori влияет на состав микробиоты желудка (уровень согласия: полное согласие – 92%, согласие с незначительными возражениями – 8%, качество доказательств – А, сила рекомендации – 1).
Комментарий
При сравнении c биоптатами неинфицированной СОЖ при наличии H. pylori показаны уменьшение микробного разнообразия, изменение состава микробного сообщества и снижение взаимодействия между микроорганизмами [31]. Нехеликобактерная микробиота попадает в желудок с проглоченной слюной и, по-видимому, является транзиторной, не обладая очевидной способностью постоянно колонизировать СОЖ [32]. Значение бактерий желудка и их влияние на модуляцию воспалительного ответа при гастрите, вызванном H. pylori, неизвестны.
2.7.2. Микробиота желудка может играть патогенетическую роль в развитии гастрита, особенно при наличии атрофии СОЖ и ахлоргидрии (уровень согласия: полное согласие – 81%, согласие с незначительными возражениями – 19%, качество доказательств – А, сила рекомендации – 1).
Комментарий
Роль других видов бактерий, кроме H. pylori, считалась незначимой в развитии гастрита. Однако последние данные изменили это мнение, и микробиоте, не относящейся к H. pylori, уже приписывается этиологическая роль при заболеваниях желудка, а также предполагается их вероятное участие в морфогенезе атрофии СОЖ [33]. Более того, разнообразие потенциальных патогенных бактерий увеличивается в ряду от нормальной слизистой оболочки к предраковым состояниям [34].
В ряде исследований сообщалось, что при прогрессирующей атрофии СОЖ и нарушении секреции кислоты в микробиоте желудка начинают преобладать компоненты микробиома полости рта и/или кишечника. В условиях сниженной секреции при атрофии СОЖ исчезает несоответствие между микробным профилем микроорганизмов, адгезированных на СОЖ (при исследовании биопсийного материала), и профилем, выявляемым в желудочном соке (см. раздел 2.7.1). Эти данные подтверждают гипотезу о том, что микрофлора полости рта, которая обычно считается транзиторной, может задерживаться в СОЖ при атрофии и выступать в качестве дополнительного компонента в каскаде канцерогенеза [35, 36].
2.7.3. Микробиота желудка может влиять на динамику смены стадий канцерогенеза в СОЖ, инициированного H. pylori. Необходимы дальнейшие исследования для выявления канцерогенных путей, обусловленных микробиотой (уровень согласия: полное согласие – 81%, согласие с незначительными возражениями – 19%, качество доказательств – В, сила рекомендации – 1).
Комментарий
Экспериментальные и небольшие клинические исследования подтверждают потенциальную роль микроорганизмов, помимо H. pylori, в реализации различных этапов каскада канцерогенеза в желудке [37, 38]. Популяция микробиоты желудка является «динамичной» и модулируется кислотообразованием, изменяясь при воспалении, развитии атрофии, метаплазии СОЖ и рака желудка [39]. Дисбиотические микробные профили, которые развиваются вместе с прогрессированием гастрита (от неатрофического к атрофическому), могут нести в себе генотоксический потенциал, выступая в качестве ко-промоторов онкогенеза [30]. Дисбиотическая микробиота также обнаруживается в СОЖ при H. pylori-колонизации [34]. Микробные сообщества, характерные для прогрессирующего атрофического гастрита, неодинаковы в разных популяциях и обусловлены образом жизни, пищевыми привычками и выраженностью изменений СОЖ, в зависимости от стадии гастрита (OLGA/OLGIM III–IV) [40].
При прогрессирующем атрофическом гастрите H. pylori может больше не обнаруживаться, а бактериальное сообщество состоит в основном из родов Fusobacterium, Neisseria, Prevotella, Veillonella и Rothia [34]. В метаанализе было подтверждено обилие Fusobacterium, но также указано, что, помимо них, другие бактерии, такие как Leptotrichia, Bifidobacterium, Lactobacillus и Streptococcus anginosus, представлены в большом количестве при раке желудка по сравнению с пациентами с гастритом. Результаты другого метаанализа подтвердили наличие при раке желудка условно-патогенных (оппортунистических) патобионтов Fusobacterium, Parvimonas, Veillonella, Prevotella и Peptostreptococcus [41].
Среди бактерий, обнаруженных в наибольшем количестве при пренеопластических состояниях, Fusobacterium nucleatum может способствовать их прогрессированию, активно подавляя иммунные реакции и антиоксидативные системы. Механизмы воздействия желудочных микробов после начальных событий, инициированных H. pylori, предстоит выяснить в ходе будущих исследований.
2.8. Эпидемиология гастрита и связанных с ним предраковых и раковых поражений
Эпидемиология гастрита различается по географическим регионам и тесно связана с региональной распространенностью инфекции H. pylori [42]. Подтипы гастрита характеризуются сходными тенденциями: за редкими исключениями, гастрит-ассоциированные предраковые изменения и рак желудка имеют высокую частоту в районах с высокой распространенностью инфекции H. pylori.
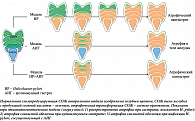
Влияние H. pylori-негативного гастрита и не-H. pylori микроорганизмов этого же рода (см. раздел 2.6.1) гораздо менее значимо. Вариабельность диагностических критериев, принятых для определения аутоиммунного статуса в СОЖ, приводит к противоречивой информации о распространенности аутоиммунного гастрита. Последние данные подтверждают гипотезу о том, что текущая или предшествующая коморбидность с H. pylori является кардинальным фактором, повышающим риск развития рака желудка у пациентов с аутоиммунным гастритом. Распространение атрофических изменений СОЖ при различных этиологических моделях хронического гастрита представлено на рисунке. Эпидемиологическую значимость гастрита (как атрофического, так и неатрофического) при вирусных инфекциях, особенно вызванных EBV, еще предстоит выяснить (см. раздел 2.6.5).
2.8.1. Заболеваемость и смертность от рака желудка во всем мире значительно различаются по географическому признаку, причем около 75% новых случаев приходится на Азию (уровень согласия: полное согласие – 100%, согласие с незначительными возражениями – 0%, качество доказательств – А, сила рекомендации – 1).
Комментарий
В 2020 г. в мире на долю рака желудка приходилось 1,1 млн новых случаев и 770 000 смертей от рака, в связи с чем он является пятым по счету по частоте встречаемости и четвертым – среди причин смерти от всех видов рака соответственно [42]. Рак желудка входит в тройку наиболее распространенных видов рака в 19 странах и в тройку наиболее распространенных причин смерти от рака в 42 странах [43]. Согласно базе данных GLOBOCAN 2020, большинство случаев рака желудка в мире приходится на Азию (n = 819 944, 75%) и Китай – 44%, далее следуют Европа (12,5%), Южная Америка и Карибский бассейн (6,2%), Африка (3%), Северная Америка (2,7%) и Океания (0,3%). Самые высокие показатели смертности от рака желудка наблюдались в Азии (n = 575 206, 75%), из них 49% – в Китае [42]. Существуют значительные географические различия в заболеваемости и смертности от рака желудка, при этом стандартизованные по возрасту показатели заболеваемости (показатель на 100 тыс. человек, оба пола вместе) варьируют от 5 в большинстве африканских регионов, 5–10 в Америке, Океании, Западной Европе и Азии (за исключением Восточной Азии) до 17 в Центрально-Восточной Азии и 33 в Восточной Азии. Рак желудка встречается чаще у мужчин по сравнению с женщинами. Страны с самыми высокими показателями заболеваемости среди мужчин включают Японию (48,1%), Монголию (47,2%) и Республику Корея (39,7%), в то время как самый высокий уровень заболеваемости среди женщин выявлен в Монголии (20,7%) и Таджикистане (18,8%).
Когда бремя рака желудка оценивали применительно к анатомическому отделу, некардиальный рак желудка доминировал и составлял > 80% всех случаев рака желудка, с высоким уровнем заболеваемости в Азии, а также в Южной и Центральной Америке. Глобальное распределение рака кардии желудка имеет другую картину: самые высокие показатели заболеваемости наблюдаются в Восточной Азии, некоторых частях Океании, Западной Европе и Западной Азии [44].
Наиболее важным прогностическим фактором выживаемости при раке желудка является его стадия на момент постановки диагноза, пятилетняя выживаемость составляет > 60% при раннем раке желудка и ~5% – при распространенном с метастазами [45].
С учетом того что рак желудка часто выявляется поздно, показатели пятилетней выживаемости остаются низкими и составляют 20–30% в большинстве стран мира [46], за исключением Японии и Кореи, где широко практикуется эндоскопический скрининг [45]. В Корее, например, реализация национальных программ скрининга привела к тому, что увеличилось число случаев, диагностированных на ранних, излечимых стадиях, и высокой пятилетней выживаемости в период с 2013 по 2017 г., которая составила более 76% [47].
2.8.2. Несмотря на снижение заболеваемости во всем мире, бремя рака желудка, по прогнозам, будет расти и оставаться серьезной проблемой для общественного здравоохранения в глобальном масштабе (уровень согласия: полное согласие – 100%, согласие с незначительными возражениями – 0%, качество доказательств – А, сила рекомендации – 1).
Комментарий
Показатели заболеваемости раком желудка снижаются во многих регионах мира. Недавнее исследование, проведенное с использованием высокодостоверных данных из 92 регистров в 34 странах, показало, что общие показатели заболеваемости будут продолжать снижаться до 2035 г. в большинстве стран независимо от фоновых показателей заболеваемости [48].
Тем не менее, по прогнозам, абсолютное число новых случаев заболевания будет продолжать расти во многих странах в связи с ростом численности и увеличением продолжительности жизни населения. Если текущие показатели останутся стабильными, к 2040 г. ожидается 1,8 млн случаев заболевания и 1,3 млн смертей, что на 66 и 71% выше, чем в 2020 г. Даже при предполагаемом ежегодном снижении уровня заболеваемости на 2% в год бремя болезни (показатели заболеваемости и смертности) будет возрастать: к 2040 г. прогнозируется 1,18 млн новых случаев и 0,85 млн смертей [49].
Следует отметить, что наблюдаемые стабильные или снижающиеся тенденции были более очевидны в старших возрастных группах, в то время как в более молодых возрастных группах это не всегда происходило. Увеличение заболеваемости среди лиц в возрасте < 50 лет прогнозируется в 15 из 34 стран как с низким, так и с высоким уровнем заболеваемости, включая Беларусь, Чили, Нидерланды, Канаду и Великобританию [48].
2.8.3. Распространенность предраковых состояний и изменений желудка варьирует в разных популяциях и обычно коррелирует с заболеваемостью раком желудка, распространенностью инфекции H. pylori, семейным анамнезом рака желудка, факторами риска, связанными с окружающей средой (например, курение и диета) и с хозяином (уровень согласия: полное согласие – 81%, согласие с незначительными возражениями – 16%, качество доказательств – А, сила рекомендации – 1).
Комментарий
В связи с неоднородностью исследуемых групп и методов диагностики сообщаемая распространенность предраковых изменений желудка, включая атрофический гастрит и кишечную метаплазию (КМ), широко варьирует.
Распространенность атрофического гастрита и КМ обычно выше у мужчин, у лиц в возрасте 40 лет и старше, а также у лиц с семейным анамнезом рака желудка [50]. Одной из причин отличий в распространенности атрофического гастрита является использование разных методов диагностики, включая серологические, эндоскопические и морфологические методы. Последние два метода также подвержены значительным межисследовательским вариациям.
В странах с высоким уровнем дохода заболеваемость атрофическим гастритом и КМ снижается, что подтверждается периодическими и когортными исследованиями [51]. В Азии аналогичная тенденция наблюдалась и в отношении распространенности атрофического гастрита в Японии, которая снизилась с 82% в 1970-х годах до 19% в 2010-х годах [52]. Напротив, в Корее распространенность атрофии тела желудка и КМ снизилась только у женщин [53]. Необходимы дальнейшие долгосрочные исследования для уточнения тенденций развития атрофического гастрита и КМ в разных странах.
2.8.4. Распространенность H. pylori снижается во многих регионах мира, особенно среди молодого населения. Вклад других факторов в эпидемиологию хронического гастрита в отсутствие H. pylori или после его эрадикации еще предстоит выяснить (уровень согласия: полное согласие – 97%, согласие с незначительными возражениями – 3%, качество доказательств – А, сила рекомендации – 1).
Комментарий
По оценкам систематических обзоров и метаанализов, до 4 млрд человек во всем мире инфицированы H. pylori [54], однако распространенность инфекции H. pylori снижается во многих развитых странах, прежде всего среди молодого населения [24]. С постепенным снижением распространенности инфекции H. pylori как благодаря успешной эрадикации, так и благодаря снижению числа новых случаев инфицирования может произойти смещение относительной доли и значимости других этиологических агентов, способствующих развитию гастрита, для изучения которых потребуется большое количество эпидемиологических исследований [55]. В настоящее время роль других микроорганизмов, входящих в состав микробиоты желудка, в патогенезе гастрита и предопухолевых поражений остается неопределенной (см. раздел 2.7.3) [56].
2.8.5. Риск прогрессирования предраковых изменений желудка различается в зависимости от наличия активной инфекции H. pylori, степени и тяжести изменений СОЖ, типа КМ, а также различных факторов хозяина и окружающей среды (уровень согласия: полное согласие – 92%, согласие с незначительными возражениями – 4%, качество доказательств – А, сила рекомендации – 1).
Комментарий
Дисплазия (синонимы: интраэпителиальная неоплазия, неинвазивная неоплазия) является наиболее выраженным предраковым изменением СОЖ. В метаанализе ежегодная частота прогрессирования дисплазии до рака желудка составила 40,4 (95%-ный доверительный интервал (95% ДИ) 27,1–55,7) на 1000 человеко-лет, при этом для дисплазии высокой степени и низкой степени – 186,4 (95% ДИ 106,6–285,6) и 11,3 (95% ДИ 3,9–21,2) соответственно [57]. Для атрофического гастрита суммарная частота прогрессирования до рака желудка составила 1,24 (95% ДИ 0,80–1,76) на 1000 человеко-лет, а до КМ и дисплазии – 41,4 (95% ДИ 3,1–64,5) и 6,2 (95% ДИ 2,34–11,5) на 1000 человеко-лет соответственно [58]. Для КМ как ключевого изменения, относящегося к спектру атрофии желудка, заболеваемость раком желудка составила 3,38 (95% ДИ 2,13–4,85) на 1000 человеко-лет, а частота прогрессирования до дисплазии – 12,51 (95% ДИ 5,45–22,03) на 1000 человеко-лет [58].
КМ может быть подразделена на полную и неполную [59]. Неполная КМ ассоциируется с 3,3-кратным (отношение шансов – 3,33; 95% ДИ 1,96–5,64) повышением риска развития рака желудка по сравнению с полной КМ в течение периода наблюдения от 3 до 12,8 лет [60].
Семейный анамнез рака желудка, диетические привычки и курение также способствуют повышению риска развития рака желудка [61].
Пациенты с гастритом стадий III и IV по OLGA/OLGIM имеют повышенный риск развития метахронного рака желудка после хирургического лечения (эндоскопической подслизистой диссекции) по поводу раннего рака желудка [62].
2.9. Использование искусственного интеллекта в клиническом ведении гастрита
Суперкомпьютеры в сочетании со сложным программным обеспечением последнего поколения воплощают в жизнь мечту о «машине, способной воспринимать, распознавать и идентифицировать окружающую среду без обучения и контроля со стороны человека» [63]. Искусственный интеллект (ИИ) обещает революционные изменения практически во всех областях человеческой деятельности, включая медицину и, в частности, клиническую гастроэнтерологическую практику [64]. Глубокое структурированное обучение может решить задачу использования в режиме реального времени огромных объемов информации, включая эпидемиологические данные, данные о генетических и эпигенетических факторах риска, клинических признаках и симптомах, а также предиктивные показатели на основе традиционных биомаркеров, предоставленных омикcными технологиями. Ожидаемые результаты – превышение сугубо человеческих возможностей распознавания заболеваний, принятие терапевтических решений, сбалансированных с точки зрения затрат и выгод, и надежность прогнозирования исхода заболевания [65].
Однако во всем мире существует неравенство доступных технологий, отсутствие стандартизированной таксономии и клинических процедур, расхождения в юридических и правовых аспектах защиты данных. Системное решение всех этих проблем является предварительным условием того, что ИИ в итоге выполнит свои потенциальные задачи [66].
В клинической гастроэнтерологии эффективность ИИ изучалась при воспалительных, предраковых и опухолевых заболеваниях. Y. Zhang и соавт. использовали в диагностике атрофического гастрита искусственный интеллект и предложили модель ИИ на основе нейронной сети, разработанной специально для анализа визуальных данных, с точностью 94,2%, чувствительностью 94,5% и специфичностью 94,0%, что превосходит показатели экспертов-эндоскопистов [67]. Аналогичные результаты были получены в результате исследования, в котором применялась система глубокого обучения на основе набора данных из 200 изображений в белом свете в режиме реального времени [68]. В работе из Таиланда в тех же условиях с помощью метода семантической сегментации в реальном времени удалость достичь высоких показателей чувствительности, специфичности, положительного и отрицательного прогностических значений, точности, стабильно превышающих 90% в отношении диагностики КМ при гастрите [69]. Метаанализ эффективности ИИ в диагностике как инфекции H. pylori, так и предраковых изменений желудка продемонстрировал совокупную точность 79,6% (95% ДИ 66,7–90,0) и 90,3% (95% ДИ 84,3–94,9) соответственно [70]. На основании этих результатов авторы пришли к выводу, что их ИИ-система может быть ценным дополнительным диагностическим ресурсом. Недавняя работа тайваньских исследователей с применением методики scSE-CatBoost (пространственного и канального сжатия и возбуждения – Spatial and Channel Squeeze and Excitation) для оценки статуса H. pylori в когорте из 302 пациентов, подвергшихся эндоскопии, позволила достичь точности 0,90, чувствительности 1,00, специфичности 0,81, положительного и отрицательного прогностических результатов 0,82 и 1,00 соответственно [71].
Традиционно диагностика и выбор метода лечения сочетают в себе анализ научных данных и подход, ориентированный на пациента [72]. Последний предполагает отношения между людьми, способность врача проявить эмпатию и обдумывать потребности пациентов; эта часть, как правило, игнорируется при рядовом моделировании клинической ситуации.
Эффективная интеграция ИИ в клинический рабочий процесс потенциально может улучшить качество медицинской помощи. Однако в своем нынешнем виде и в большей части стран Востока и Запада фактические потенциальные преимущества ИИ лишь частично используются в реальной клинической практике [73]. В заключение стоит отметить, что, по мнению экспертов, в сфере медицинской помощи, ориентированной на пациента, ИИ следует использовать параллельно, с обязательным участием врача, несмотря на присущий человеку риск интеллектуальных ошибок [66].
Заключение
Подходы к диагностике, прогнозу и лечению хронического гастрита изучаются научным сообществом уже более трехсот лет. За этот период менялись наши представления о гастрите как о «флегмазии» слизистой оболочки желудка, функциональной патологии и, наконец, как о предраковом заболевании при формировании атрофии и кишечной метаплазии [74]. Последние десятилетия стали прорывными в оценке этиологических факторов и прежде всего инфекции H. pylori, механизмов персистенции воспаления и прогрессирования структурных изменений, возможностей персонифицированного прогноза в отношении развития рака желудка. Междисциплинарный консенсус RE.GA.IN. стал значимым событием и позволил объединить усилия ведущих экспертов для детального глубокого анализа современных возможностей изучения хронического гастрита. В заключительном документе не только дана всесторонняя оценка роли ведущих этиологических факторов в формировании различных фенотипов гастрита, но и представлен стратифицированный анализ риска развития рака желудка при каждом из них. На наш взгляд, важным достижением консенсуса является не только систематизация результатов крупных и хорошо спланированных научных исследований, но и то, что самые современные инновационные технологии в изучении хронического гастрита были подвергнуты критическому анализу с определением уровня доказательности данных для наиболее эффективного их применения в реальной клинической практике.
D.S. Bordin, PhD, Prof., S.I. Mozgovoy, PhD, Prof., M.A. Livzan, PhD, Prof., Corresponding member of the RAS, O.V. Gaus, PhD, I.V. Maev, PhD, Prof., Academician of the RAS
A.S. Loginov Moscow Clinical Scientific Center
Russian University of Medicine, Moscow
Tver State Medical University
Omsk State Medical University
Contact person: Dmitry S. Bordin, d.bordin@mknc.ru
As part of the international group work for the study of gastritis in clinical practice – Real-World Gastritis Initiative (RE.GA.IN.) topical issues were considered, starting with the revision of the definition of the disease and ending with clinical diagnosis and prognosis assessment. In an interdisciplinary consensus work RE.GA.IN. recognized gastritis experts from five continents took part. After a lively debate on the most controversial aspects, the consensus participants RE.GA.IN. summarized the existing scientific information in order to develop patient-oriented key provisions from the standpoint of evidence-based medicine, designed to help specialist doctors in their daily clinical practice. This article presents the provisions of the consensus RE.GA.IN. regarding rare forms of gastritis, the microbiota of the stomach in conditions of inflammation of the gastric mucosa, the epidemiology of gastritis and related precancerous and tumor changes, a view on the use of artificial intelligence in the management of patients with gastritis is reflected.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.