количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Муколитические и бронхолитические средства в терапии бронхиальной обструкции при оРВи у детей
Эффективная фармакотерапия. Педиатрия. СПЕЦВЫПУСК.
- Аннотация
- Статья
- Ссылки
У детей с острыми респираторными вирусными инфекциями в патологический процесс нередко вовлекаются нижние отделы дыхательных путей с развитием обструктивного синдрома. Применение комбинированного препарата Аскорил экспекторант (бромгексин + сальбутамол + гвайфенезин) благодаря его сочетанному бронхолитическому и муколитическому действию приводит к быстрому регрессу симптомов заболевания, предупреждая его переход в более тяжелое длительное течение, и снижает в последующем потребность в назначении антибиотиков. Клиническая эффективность и высокий профиль безопасности Аскорила экспекторанта позволяют рекомендовать его в качестве препарата выбора у детей старше 2 лет при легком и среднетяжелом течении бронхиальной обструкции на фоне ОРВИ.
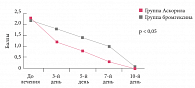
Рис. 1. Динамика симптомов ночного кашля у детей на фоне терапии комбинированным препаратом (бромгексин + сальбутамол + гвайфенезин), по сравнению с монотерапией муколитиком (бромгексин)

Рис. 2. Динамика симптомов дневного кашля у детей на фоне терапии комбинированным препаратом (бромгексин + сальбутамол + гвайфенезин), по сравнению с монотерапией муколитиком (бромгексин)
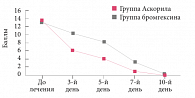
Рис. 3. Эффективность терапии комбинированным препаратом (бромгексин + сальбутамол + гвайфенезин) в сравнении с монотерапией муколитиком (бромгексин) по суммарной балльной оценке симптомов, M ± m
ОРВИ регистрируют в течение всего года, однако наибольшее число заболеваний отмечается в период с ранней осени до поздней весны.
У детей с респираторными заболеваниями, особенно раннего возраста, в патологический процесс нередко вовлекаются нижние отделы дыхательных путей с развитием обструктивного синдрома (ОС). Различают несколько фенотипов бронхиальной обструкции, имеющих как клиническое, так и прогностическое значение. Транзиторная обструкция наблюдается у детей только в первые три года жизни, персистирующая –
преимущественно в первые 6 лет жизни. ОС может развиваться у детей после трех лет жизни (позднее начало). В этом случае выделяют атопический и неатопический фенотипы обструктивного синдрома, то есть ОС в сочетании с атопией и без нее. Полученные при длительном наблюдении сведения показывают, что у детей с транзиторной обструкцией легочная функция изменена с рождения, еще до первого эпизода обструкции. Напротив, у детей с персистирующей обструкцией и высоким риском развития бронхиальной астмы (БА) при рождении функция легких нормальная, а обструктивные нарушения у них формируются к 4–6 годам. Вероятно, одним из существенных факторов, предрасполагающих к вирус-индуцированным симптомам обструкции в первые годы жизни, является уменьшение просвета дыхательных путей вследствие нарушения развития плода в антенатальном периоде.
Обструктивный синдром при заболеваниях легких у недоношенных детей обычно связывают с комбинацией незрелости легких, оксигенотерапии и вентиляционной поддержки. Прежде всего это касается детей с низкой массой тела при рождении и тяжелым неонатальным респираторным заболеванием. Однако и у недоношенных детей с изначальным отсутствием заболеваний неонатального периода при обследовании в более позднем возрасте диагностируют сниженную респираторную функцию. Предполагается, что при недоношенности у детей может быть склонность к обструктивному паттерну. Тестирование здоровых недоношенных детей на втором году жизни показывает, что у них не нормализуется легочная функция в период наибольшего роста легких. Механизм персистирующего снижения легочной функции у детей, родившихся недоношенными, не детерминирован. Этот процесс может быть результатом более узкого просвета дыхательных путей и снижения эластичности легочной ткани, что вторично ведет к изменению альвеоляризации легочной паренхимы.
Респираторные вирусные инфекции в раннем возрасте могут быть более важным фактором риска бронхиальной обструкции, чем атопия. В осенне-зимний период тяжелые случаи бронхиолита у детей первых двух лет жизни нередко вызываются респираторно-синцитиальным вирусом (РСВ) и носят типичный сезонный характер. Установлено, что тяжелое течение бронхиолита в 30–40% случаев сочетается с вероятностью развития астмы. РСВ при сочетании с бокавирусом человека вызывает более тяжелое течение заболевания.
Вторым по частоте этиологическим фактором бронхиолита является риновирус (РВ). При умеренном или тяжелом течении заболевания он повышает риск развития астмы. Следует отметить: многие другие вирусные инфекции – грипп, парагрипп, коронавирусная инфекция, энтеровирусная, аденовирусная, а также инфекции, вызываемые человеческими метапневмовирусом и бокавирусом, – поражая мелкие бронхи и бронхиолы, протекают с клиникой бронхиолита. У новорожденных с риском атопии показано, что умеренные/тяжелые обструкции при РВ-заболевании – более значимый фактор риска не только развития повторных эпизодов обструкции к 3 годам, но и формирования астмы к 6 годам. Данные ряда исследований показали, что ведущими факторами риска рецидивирующей бронхиальной обструкции после острого бронхиолита являлись РВ-инфекция и отягощенная наследственность по астме. У детей с РВ-инфекцией, которые получали терапию оральными глюкокортикостероидами, вероятность развития рецидивирующей обструкции в последующем была существенно меньше. Исследование баланса между Th1- и Th2-типами иммунного ответа показало, что у детей с атопией периферические мононуклеарные клетки, инкубированные с РВ-вирусом, продуцируют интерлейкин-10 (ИЛ-10), тогда как у пациентов без атопии – гамма-интерферон и ИЛ-12. Сниженная способность мононуклеарных клеток крови к продукции гамма-интерферона и ИЛ-12 уменьшает вирусный клиренс и может приводить к развитию обострения астмы путем поддержки воспаления Th2-типа и недостаточности антивирусного иммунного ответа Th1-типа. На сегодняшний день обсуждается: ведет ли рецидивирующая инфекция дыхательных путей к повреждению и таким образом к астме или дети предрасположены к БА, так как у них измененный уровень интерферона или другой цитокиновый ответ.
Для лучшего понимания постнатальных процессов имеет значение информация об антенатальном периоде развития. Ветвление дыхательных путей происходит в первой половине беременности, следовательно, особенности течения антенатального периода могут влиять на их калибр. Важную роль в антенатальном развитии легких, особенно в морфогенезе разветвления дыхательных путей в 3–5-летнем возрасте, играет ген ADAM33. Этот ген определяет также калибр дыхательных путей.
Отмечено сочетание атопии у матери с ухудшением легочной функции у новорожденных, однако механизм этого процесса не изучен. У детей, родившихся у матерей с преэклампсией, гипертензией, диабетом, повышен риск развития ранней транзиторной, персистирующей и более поздней обструкции. Назначение антибиотиков во время родов может обусловливать как раннюю транзиторную, так и персистирующую обструкцию.
Курение матери оказывает прямое негативное влияние на развитие легких у плода, так как приводит к снижению ИЛ-4 и гамма-интерферона и повышает пролиферацию мононуклеарных клеток в пуповинной крови на домашнюю пыль. Другие исследования клеток пуповинной крови показывают, что курение матери сочетается с увеличением ИЛ-13 и уменьшением гамма-интерферона мРНК ответа после стимуляции, а также продукцией ФНО-альфа. Эпидемиологическими исследованиями подтверждено, что материнское курение и атопия сочетаются с последующим бронхиолитом у детей первого года жизни. Таким образом, курение матери существенно влияет на характер иммунного ответ у новорожденных, равно как и на анатомические особенности строения нижних дыхательных путей (недоразвитие альвеол).
РСВ-бронхиолит сочетается с увеличением экспрессии цитокинов Th2-паттерна или снижением Th1. Это делает привлекательной гипотезу о том, что РСВ вызывает астму. Бронхиальная гиперреактивность после бронхиолита сохраняется длительно, этим можно объяснить предрасположенность к бронхиальной обструкции в более позднем возрасте. Однако обнаружение у детей с бронхиолитом специфических РСВ-IgE свидетельствует о том, что результатом ранней РСВ-инфекции у отдельных пациентов может быть иммунный ответ по Th2-типу, который предрасполагает к развитию БА у этих детей.
Генетическими исследованиями установлено, что полиморфизм генов ИЛ-8, ИЛ-10 и генов толл-подобных рецепторов (TLR) сочетается с тяжестью РСВ-инфекции. Предполагается, что к развитию астмы у не имеющего отклонений ребенка приводит не сама РСВ, а предшествующие воздействия неблагоприятных генетических и антенатальных факторов на фоне РСВ-бронхиолита. Это позволяет рассматривать бронхиолит как маркер данных проблем, а не причину последующих нарушений. Присоединение вирусных инфекций у таких детей будет протекать с осложнениями и более тяжелыми проявлениями обструкции дыхательный путей, что требует срочного и адекватного лечения.
Существует гипотеза, согласно которой ранняя экспозиция вирусных инфекций может предупреждать возникновение БА в более позднем возрасте. Установлена связь между началом посещения ребенком организованного учреждения в раннем возрасте и более частой обструкцией, при этом астма у таких детей к 6 годам развивается реже, чем у «домашних» детей. Известно, что большинство обострений астмы сочетаются с вирусными инфекциями. В раннем возрасте диагностирование БА представляется сложной задачей в связи с вариабельностью и неспецифичностью клинических проявлений, а также трудностями проведения функциональной диагностики. У детей дошкольного и школьного возраста отмечается взаимодействие между экспозицией аллергенов, сенсибилизацией к ним и вирусными инфекциями.
Неатопический фенотип бронхиальной обструкции создает наибольшие трудности при диагностике заболевания. Известно, что тяжелая аденовирусная инфекция может вести к длительной бронхиальной обструкции у ранее здорового ребенка. Респираторные вирусы (РВ, РСВ, метапневмовирус, вирус гриппа) влияют на эпителий нижних дыхательных путей и провоцируют местную иммунологическую реакцию, так же как протективный противовирусный ответ с продукцией интерферонов, хемотаксисом и активацией NK-клеток. Эпителий дыхательных путей является ключевым компонентом в респираторных нарушениях. Респираторные вирусы повреждают мерцательный эпителий слизистой оболочки дыхательного тракта, увеличивают ее проницаемость для аллергенов, токсических веществ, повышают чувствительность рецепторов подслизистого слоя бронхов, что вызывает их гиперреактивность и возникновение обструктивных проявлений у детей. Бронхиальный эпителий продуцирует секрет, содержащий факторы неспецифической и специфической противоинфекционной защиты, и отвечает на сигналы иммунных клеток, которые вовлечены в инициацию и созревание врожденного и адаптивного иммунного ответа, включая воспалительную реакцию на патогены, иммунный ответ по Th2-типу, структурные изменения дыхательных путей и ангиогенез.
Однако независимо от предрасполагающих факторов повторные эпизоды респираторных заболеваний, сопровождающихся бронхиальной обструкцией, формируют и/или усугубляют бронхиальную гиперреактивность, что, вероятно, может способствовать развитию рецидивирующих и хронических форм бронхитов или реализации риска БА. Поиск оптимальных лечебно-диагностических технологий, позволяющих проводить своевременную коррекцию нарушений проходимости бронхов, является важной задачей педиатра и пульмонолога.
Учитывая разнообразие и степень выраженности клинических симптомов, при лечении детей с респираторными вирусными инфекциями используются препараты, действующие на различные компоненты патологического процесса. Значимое место в терапии кашля при ОРВИ занимают мукоактивные средства (амброксол, ацетилцистеин, карбоцистеин). Они способствуют разжижению мокроты, повышению секреции ее жидкой части, стимулируют работу реснитчатого эпителия, способствуют выработке сурфактанта. Основным направлением действия препаратов данной группы является оптимизация реологических свойств секрета дыхательных путей, что может положительно влиять на восстановление нарушенного мукоцилиарного клиренса.
Основу комплексной медикаментозной терапии бронхиальной обструкции при респираторных инфекциях составляют бронхолитические лекарственные средства. При нетяжелых проявлениях бронхиальной обструкции и наличии трудноотделяемой мокроты на фоне ОРВИ эффективно назначение комбинированных препаратов, содержащих муколитики и бронхолитики. Комбинированный препарат Ускорил обеспечивает бронхорасширяющий и отхаркивающий эффекты, сокращает длительность кашля, делает его продуктивным, что способствует усилению мукоцилиарного транспорта.
Компоненты препарата Аскорил – бромгексин + сальбутамол + гвайфенезин – оказывают бронхолитическое, муколитическое и отхаркивающее действие. Сальбутамол, как быстродействующий бета-2-агонист, оказывает бронхолитическое действие. Бромгексина гидрохлорид с его активным метаболитом амброксолом обладает выраженным муколитическим и отхаркивающим действием за счет деполимеризации и разрушения мукопротеинов и мукополисахаридов мокроты. Он также стимулирует деятельность секреторных клеток слизистой оболочки бронхов. Гвайфенезин стимулирует секрецию жидкой части бронхиальной слизи, уменьшает поверхностное натяжение и адгезивные свойства мокроты, снижает тревожность, уменьшает психогенную и вегетативную симптоматику, улучшает сон. Ментол (рацементол) оказывает мягкое спазмолитическое действие, обладает слабыми антисептическими свойствами. По нашим данным, применение Аскорила экспекторанта у детей в возрасте от 2 до 10 лет с легким или среднетяжелым течением обструктивного синдрома при ОРВИ оказывает выраженное положительное влияние на течение заболевания, как по оценке врачей, так и по результатам анкетирования родителей. Острые респираторные заболевания у наблюдаемых детей протекали с кашлем вследствие вовлечения в воспалительный процесс различных отделов дыхательной системы (ларинготрахеит, бронхит).
У детей до 6 лет Аскорил экспекторант назначали по 5 мл (1 чайная ложка) 3 раза в сутки, детям от 6 до 10 лет – по 5–10 мл (1–2 чайные ложки) 3 раза в сутки. Лучшие результаты лечения наблюдались при его раннем начале – с первых суток заболевания. Продолжительность терапии составила 7–10 дней в зависимости от динамики регресса симптомов. Обоснованность использования бета-2-агонистов короткого действия (сальбутамол) в составе Аскорила обусловлена наличием у более 60% детей нарушений бронхиальной проходимости по данным бронхофонографии. Осцилляции в высокочастотной части спектра (более 5000 Гц), а также отклонения на спирограмме в виде легких и умеренных проявлений бронхиальной обструкции наблюдались более чем у 50% детей. Очевидные клинические признаки бронхиальной обструкции характеризовались кратковременными эпизодами одышки, приступами малопродуктивного кашля, небольшим количеством хрипов в легких только у 15% детей. У пациентов, получавших комбинированный препарат (бромгексин + сальбутамол + гвайфенезин), по сравнению с контрольной группой детей, получавших только муколитик (бромгексин), наблюдалась более ранняя положительная динамика. Ко 2–3-му дню лечения кашель становился влажным, наблюдалось облегчение отхождения мокроты, к 6–7-му дню терапии у большинства детей симптомы исчезли (p < 0,05).
Наличие в препарате бронхолитика короткого действия, а также взаимодополняющее действие муколитического, седативного, противовоспалительного компонентов определяло выраженную клиническую эффективность и приводило к исчезновению симптомов кашля на 3–4 дня раньше, чем у больных в группе сравнения (p < 0,05 к 9–10-му дню).
Снижение выраженности симптомов кашля сопровождалось улучшением сна, увеличением активности детей, нормализацией их эмоционального состояния. Суммарная балльная оценка клинических симптомов на фоне лечения показала, что эффективность терапии Аскорилом экспекторантом была статистически достоверно (p < 0,05).
Трем детям (4%) группы терапии Аскорилом в связи с недостаточной эффективностью лечения была добавлена антибактериальная составляющая, однако необходимость ее назначения была существенно ниже (в 2,5 раза), чем в группе детей, получавших муколитик (у 3 детей – 10%; p< 0,05).
Положительная динамика клинических симптомов сопровождалась достоверным улучшением показателей бронхофонографии и спирографии, что свидетельствует о нормализации бронхиальной проходимости. У 1 ребенка наблюдалась аллергическая реакция на препарат в виде сыпи. У остальных детей побочных эффектов и нежелательных реакций не отмечено.
Таким образом, комбинированный препарат Аскорил экспекторант, оказывая сочетанное бронхолитическое и муколитическое действие, потенцирует восстановление мукоцилиарного клиренса и приводит к более быстрому регрессу симптомов ОРВИ, предупреждая переход заболевания в более тяжелое длительное течение, и снижает в последующем потребность в назначении антибиотиков. Клиническая эффективность и высокий профиль безопасности позволяют использовать Аскорил экспекторант в качестве препарата выбора у детей старше 2 лет при легком и среднетяжелом течении бронхиальной обструкции на фоне ОРВИ.
При оказании неотложной помощи детям с выраженным бронхообструктивным синдромом основу медикаментозного лечения составляют бронхолитические препараты короткого действия. Бронхолитики необходимы при обструктивном бронхите, бронхиолите, угрозе обострения или обострении БА. В педиатрии для купирования остро возникающих нарушений бронхиальной проходимости используют различные группы бронхолитиков: бета-2-агонисты, антихолинергические препараты, метилксантины.
Действие бета-2-агонистов основано на стимуляции адренергических рецепторов и связано с активацией сопряженной с рецептором аденилатциклазы, что приводит к увеличению образования ц-АМФ и стимуляции работы кальциевого насоса. В результате снижения концентрации кальция в миофибриллах происходит дилатация бронхов. При ингаляционном применении они дают быстрый (в течение 3–5 минут) бронходилатирующий эффект и способствуют улучшению мукоцилиарного транспорта. Способ введения препаратов зависит от возраста ребенка и тяжести заболевания: с помощью дозированных аэрозольных ингаляторов (ДАИ), ДАИ со спейсером, в виде растворов для ингаляции через небулайзер и/или энтерально.
Для купирования бронхиальной обструкции у детей используется комбинация короткодействующих бета-2-агонистов с холинергическими средствами. Согласно международным рекомендациям Global Initiative for Asthma (GINA, 2010) и Российской национальной программе «Бронхиальная астма у детей. Стратегия лечения и профилактика» (2008), фиксированная комбинация фенотерола и ипратропиума бромида (Беродуал®) является первой линией терапии обострений у детей начиная с раннего возраста. Компоненты препарата имеют различные точки приложения и механизмы действия. В препарате с фиксированной комбинацией благодаря синергическому эффекту используется более низкая доза бета-2-агониста (фенотерола), что уменьшает риск развития побочных эффектов. Ингаляции раствора Беродуала через небулайзер проводят до 3–4 раз в день в соответствующей возрасту ребенка дозировке (на 1 ингаляцию): новорожденные и дети грудного возраста – 1 капля/кг массы тела; дети от 1 до 6 лет – 10 капель; дети старше 6 лет – 10–20 капель. После ингаляции необходимо наблюдать ребенка в течение 30–40 минут.
При бронхиальной обструкции с выраженными симптомами дыхательной недостаточности назначают ингаляционные кортикостероиды (будесонид). Применение суспензии будесонида (Пульмикорт®) для небулайзерной терапии у детей хорошо изучено. В настоящее время опубликовано более 15 рандомизированных контролируемых клинических исследований эффективности и безопасности данного препарата с участием детей в возрасте от 3 месяцев до 18 лет с различной степенью тяжести бронхиальной обструкции. Так, открытое исследование эффективности суспензии Пульмикорт® проведено на этапе скорой помощи в Екатеринбурге и Нижнем Новгороде. Препарат применяли у детей со среднетяжелыми обострениями БА в домашних условиях в дозах 0,25–0,5 мг, что привело к нормализации состояния больных и позволило отказаться от госпитализации во всех случаях. В Нижнем Новгороде применяли дозы препарата 0,125–0,25 мг 2 раза в день в течение 2 недель у детей с обострениями, что позволяло купировать все симптомы к началу второй недели терапии. У детей раннего возраста в детской клинической больнице Первого МГМУ им. И.М. Сеченова использовали комбинированную терапию (Пульмикорт + Беродуал + амброксол). Данная комбинация оказывала более быстрый положительный эффект, чем ингаляции отдельно раствором Беродуала или Беродуал + амброксол.
При лечении обострений БА или купировании обструкции при инфекциях нижних дыхательных путей начальная доза суспензии Пульмикорт® составляет 0,5–1 мг 2 раза в день для детей от 6 месяцев. Исследования также показали эффективность назначения суспензии 1 раз в день.
В настоящее время суспензия Пульмикорт® является единственным ингаляционным глюкокортикостероидом, предназначенным для использования через небулайзер, зарегистрированным для лечения стенозирующего ларинготрахеита. При стенозирующем ларинготрахеите ингаляции Пульмикорта применяются для лечения острых симптомов крупа в дозе 1 мг 2 раза через 30 минут.
При неэффективности ингаляционных стероидов или невозможности проведения ингаляций назначают системные стероиды (внутрь или парентерально). Показаниями к применению системных стероидов при острой обструкции являются:
- недостаточный эффект бронхолитиков (бета-2-агонистов или антихолинергических средств);
- тяжелые и жизнеугрожающие состояния;
- применение стероидов в анамнезе для купирования обострений.
Так как у больных БА ОРВИ могут провоцировать обострения, практикующий врач должен знать алгоритм купирования обострений астмы. В случае легкого обострения терапию начинают с ингаляций бета-2-агониста короткого действия с помощью ДАИ со спейсером. При необходимости ингаляции повторяют каждые 20–30 минут в течение часа. У детей раннего возраста целесообразно использовать комбинированный бронхолитик (бета-2-агонист и ипратропиума бромид), а в качестве средства доставки использовать небулайзер. Если в динамике нет тенденции к уменьшению клинических симптомов обструкции, следует пересмотреть степень тяжести обострения.
При среднетяжелом обострении БА показано назначение ингаляционных стероидов (Пульмикорт® суспензия) в сочетании с бронхолитиками через небулайзер.
Тяжелое обострение БА является показанием к госпитализации. На амбулаторном этапе начинают оказание неотложной помощи по ранее изложенным принципам. Следует помнить, что ингаляционная терапия бронхолитиками проводится одновременно с введением системных стероидов и оксигенотерапией.
У детей раннего возраста при обструкции на фоне ОРВИ эффективна комбинация ингаляционного бронхолитика, муколитика, ингаляционного глюкокортикостероида. Включение в медикаментозный комплекс мукоактивных средств, обладающих многофакторным действием, целесообразно со 2–3-х суток. Препаратом выбора для ингаляционной терапии через небулайзер является амброксол. Не следует использовать для ингаляций через небулайзер минеральную воду. Все бутилированные минеральные воды («Ессентуки», «Нарзан» и др.) предназначены для лечения заболеваний желудочно-кишечного тракта и почек и не показаны для ингаляционной терапии, тем более с помощью небулайзера.
Таким образом, только комплексный подход к терапии обструктивного синдрома при ОРВИ с учетом клинической ситуации и возраста ребенка может обеспечить высокую терапевтическую эффективность и оказать положительное влияние на качество жизни пациента.
При нетяжелых проявлениях бронхиальной обструкции и наличии трудноотделяемой мокроты на фоне ОРВИ эффективно назначение комбинированных препаратов, содержащих муколитики и бронхолитики. Комбинированный препарат Аскорил обеспечивает бронхорасширяющий и отхаркивающий эффекты, сокращает длительность кашля, делает его продуктивным, что способствует усилению мукоцилиарного транспорта.
1. Baker J.G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3-adrenoceptors // Br. J. Pharmacol. 2010. Vol. 160. No 5. P. 1048–1061.
2. Jackson D.J. et al. Wheezing rhinovirus illnesses in early life predict asthma development in high-risk children // Am. J. Respir. Crit. Care Med. 2008. Vol. 178. No 7. P. 667–672.
3. Kotaniemi-Syrjänen A., Vainionpää R., Reijonen T.M., Waris M., Korhonen K., Korppi M. Rhinovirus-induced wheezing in infancy – the first sign of childhood asthma? // J. Allergy Clin. Immunol. 2003. Vol. 111. No 1. P. 66–71.
4. Martinez F.D. What have we learned from the Tucson Children's Respira- tory Study? // Paediatr. Respir. Rev. 2002. Vol. 3. No 3. P. 193–197.
5. Midulla F. et al. Respiratory syncytial virus, human bocavirus and rhinovi- rus bronchiolitis in infants // Arch. Dis. Child. 2010. Vol. 95. No 1. P. 35–41.
6. Papadopoulos N.G., Gourgiotis D., Javadyan A., Bossios A., Kallergi K., Psar- ras S., Tsolia M.N., Kafetzis D. Does respiratory syncytial virus subtype in- fluences the severity of acute bronchiolitis in hospitalized infants? // Respir. Med. 2004. Vol. 98. No 9. P. 879–882.
7. Pala P., Bjarnason R., Sigurbergsson F., Metcalfe C., Sigurs N., Openshaw P.J. Enhanced IL-4 responses in children with a history of respiratory syncytial virus bronchiolitis in infancy // Eur. Respir. J. 2002. Vol. 20. No 2. P. 376–382.
8. Rusconi F. et al. Maternal complications and procedures in pregnancy and at birth and wheezing phenotypes in children // Am. J. Respir. Crit. Care Med. 2007. Vol. 175. No 1. P. 16–21.
9. Sanderman R., Wempe J.B., Schokker M.C. Psychological aspects of patients with a chronical disease of the lungs // Graduate School for Health Re- search, Nederlands. 2007. No 1.
10. Simpson A., Maniatis N., Jury F., Cakebread J.A., Lowe L.A., Holgate S.T., Woodcock A., Ollier W.E., Collins A., Custovic A., Holloway J.W., John S.L. Polymorphisms in a disintegrin and metalloprotease 33 (ADAM33) predict impaired early-life lung function // Am. J. Respir. Crit. Care Med. 2005. Vol. 172. No 1. P. 55–60.
11. Smyth R.L., Fletcher J.N., Thomas H.M., Hart C.A., Openshaw P.J. Respira- tory syncytial virus and wheeze // Lancet. 1999. Vol. 354. No 9194. P. 1997– 1998.
12. Xepapadaki P., Papadopoulos N.G. Childhood asthma and infection: virus- induced exacerbations as determinants and modifiers // Eur. Respir. J. 2010. Vol. 36. No 2. P. 438–445.
13. Геппе Н.А., Кондюрина Е.Г., Мещеряков В.В. и др. ингаляционная небулайзерная терапия заболеваний респираторной системы у детей. М., 2010.
14. Геппе Н.А., Селиверстова Н.А., Малышев В.С., Утюшева М.Г., Старостина Л.С., Озерская И.В. Бронхофонографическое исследование легких у больных бронхиальной астмой раннего возраста // пульмонология. 2008. No 3. С. 38–41.
15. Геппе Н.А., Батырева О.В., Малышев В.С. и др. Волнообразное течение бронхиальной астмы у детей. терапия обострений // трудный пациент. 2007. No 2.
16. Геппе Н.А., Малахов А.Б. Современные подходы к выбору медикаментозного комплекса неотложной терапии обструктивного синдрома при заболеваниях органов дыхания детей и подростков // Эффективная фармакотерапия. педиатрия. 2012. No 1. С. 32–36.
17. национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика». М., 2008.
18. Охотникова Е.Н. Синдром бронхиальной обструкции инфекционного и аллергического генеза у детей раннего возраста и муколитическая терапия // Здоровье ребенка. 2007. No 3. С. 7–9.
19. Стенина О.И., Паунова С.С., Чакветадзе С.С., Донин И.М. ингаляционная терапия бронхообструктивного синдрома у грудных детей с острыми респираторными заболеваниями // педиатрия. 2010. No 4. С. 62–65.
20. Царькова С.А., Абелевич М.М. небулизированный будесонид (суспензия пульмикорта) при острой обструкции дыхательных путей // педиатрическая фармакология. 2003. No 2. С. 36–39.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.