Опыт применения низкотемпературной аргоновой плазмы в комплексной терапии ливедоидной васкулопатии
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить эффективность лечения ливедоидной васкулопатии с применением низкотемпературной аргоновой плазмы (НТАП).
Материал и методы. Лечение ливедоидной васкулопатии проведено 22 пациентам (18 женщин и четверо мужчин) в возрасте от 34 до 78 лет после предварительного подтверждения диагноза результатами гистологического и дерматоскопического исследований. Перед началом лечения пациенты были распределны случайным образом в группу контроля и группу исследования. Всем пациентам была проведена капилляроскопия с целью оценки капиллярной перфузии в области поражения; пациенты заполнили анкеты DLQI (Dermatology Life Quality Index) и Pain Detect. Консервативное лечение включало в себя: системные глюкокортикостероиды (преднизолон в средних терапевтических дозах 30–40 мг в сутки с постепенным снижением в течение двух месяцев) в сочетании с корригирующей терапией, при упорном течении – азатиоприн (50 мг два раза в сутки в течение месяца), антикоагулянты (ривароксабан 10 мг в сутки), антиагреганты (дипиридамол 75 мг в сутки), вазодилатирующие препараты (пентоксифиллин), стимуляторы регенерации тканей (актовегин), венотоники (детралекс 1000 мг в сутки), витамины С и Р (аскорутин две таблетки три раза в день в течение месяца). Наружно при язвенных дефектах: антисептическая обработка раневой поверхности, эпителизирующие мази (офломелид, левосин), антибактериальные кремы для заживления (аргосульфан, дермазин), коллагеновые губки, сетки, гидрогелевые повязки.
В группе исследования пациентам дополнительно, кроме консервативной терапии, было проведено в среднем 6–10 процедур обработки НТАП с применением установки «Плазморан» ежедневно или через день с экспозицией 30–60 секунд и расстоянием от струи плазмы до области обработки 10–15 см; пациенты находились на стационарном лечении в среднем 15 дней.
Результаты. Комплексная терапия ливедоидной васкулопатии с применением НТАП позволила добиться существенного улучшения качества жизни пациентов, снизить проявления ливедо и ускорить эпителизацию язвенных дефектов по сравнению с контрольной группой.
Заключение. На основе клинических данных, результатов повторного капилляроскопического исследования и повторного заполнения анкет можно сделать вывод, что комбинированная терапия ливедоидной васкулопатии с применением НТАП дает видимые положительные результаты при отсутствии у пациентов побочных эффектов и может быть внедрена в дерматологическую практику.
Цель исследования – оценить эффективность лечения ливедоидной васкулопатии с применением низкотемпературной аргоновой плазмы (НТАП).
Материал и методы. Лечение ливедоидной васкулопатии проведено 22 пациентам (18 женщин и четверо мужчин) в возрасте от 34 до 78 лет после предварительного подтверждения диагноза результатами гистологического и дерматоскопического исследований. Перед началом лечения пациенты были распределны случайным образом в группу контроля и группу исследования. Всем пациентам была проведена капилляроскопия с целью оценки капиллярной перфузии в области поражения; пациенты заполнили анкеты DLQI (Dermatology Life Quality Index) и Pain Detect. Консервативное лечение включало в себя: системные глюкокортикостероиды (преднизолон в средних терапевтических дозах 30–40 мг в сутки с постепенным снижением в течение двух месяцев) в сочетании с корригирующей терапией, при упорном течении – азатиоприн (50 мг два раза в сутки в течение месяца), антикоагулянты (ривароксабан 10 мг в сутки), антиагреганты (дипиридамол 75 мг в сутки), вазодилатирующие препараты (пентоксифиллин), стимуляторы регенерации тканей (актовегин), венотоники (детралекс 1000 мг в сутки), витамины С и Р (аскорутин две таблетки три раза в день в течение месяца). Наружно при язвенных дефектах: антисептическая обработка раневой поверхности, эпителизирующие мази (офломелид, левосин), антибактериальные кремы для заживления (аргосульфан, дермазин), коллагеновые губки, сетки, гидрогелевые повязки.
В группе исследования пациентам дополнительно, кроме консервативной терапии, было проведено в среднем 6–10 процедур обработки НТАП с применением установки «Плазморан» ежедневно или через день с экспозицией 30–60 секунд и расстоянием от струи плазмы до области обработки 10–15 см; пациенты находились на стационарном лечении в среднем 15 дней.
Результаты. Комплексная терапия ливедоидной васкулопатии с применением НТАП позволила добиться существенного улучшения качества жизни пациентов, снизить проявления ливедо и ускорить эпителизацию язвенных дефектов по сравнению с контрольной группой.
Заключение. На основе клинических данных, результатов повторного капилляроскопического исследования и повторного заполнения анкет можно сделать вывод, что комбинированная терапия ливедоидной васкулопатии с применением НТАП дает видимые положительные результаты при отсутствии у пациентов побочных эффектов и может быть внедрена в дерматологическую практику.

Актуальность
Ливедоидная васкулопатия (ЛВ) является редким, тяжелым хроническим заболеванием, связанным с генетически детерминированной тромбофилией и характеризующимся поражением кровеносных сосудов кожи на границе дермы и гиподермы [1].
Классическим проявлением болезни являются стойкие багрово-синюшные ветвистые пятна, образующие сеть на коже нижних конечностей, реже – на кистях, предплечьях, туловище и лице. Окраска пятен резко усиливается к вечеру, при переохлаждении, может изменяться с переменой положения тела. С течением времени интенсивность ливедо становится более выраженной, а на коже тыла стоп, лодыжек и нижней трети голени могут появляться рецидивирующие, болезненные язвочки, достаточно глубокие и длительно не заживающие, оставляющие после себя штампованные белесые рубцы с ободком гиперпигментации. Достаточно редко описывают образование болезненных узлов в подкожной клетчатке голеней. Пациенты испытывают тянущую боль в конечностях, пульсирующую боль в узлах и язвах, зябкость [1].
Отображаемая в настоящее время в литературе заболеваемость 1 на 100 тысяч населения в год на практике может быть выше ввиду малой осведомленности медиков о ЛВ. С этой проблемой чаще сталкиваются молодые женщины. Соотношение заболевших женщин и мужчин составляет примерно от 2,1 : 1 до 3 : 1.
Для этого заболевания характерно начало первых проявлений в возрасте 20–39 лет, а средний возраст пациентов с дебютом заболевания составляет 30 лет [2, 3], однако есть сообщения и о пациентах детского и подросткового возраста [3].
В связи с недостаточной информированностью врачебного сообщества от появления высыпаний до постановки диагноза проходит много времени. В исследованиях с крупными популяциями пациентов указано, что временной промежуток от момента дебюта заболевания до постановки верного диагноза достигает в среднем 6,65 года [4].
Особенности клинической картины и трудности диагностики отразились и в терминологии. Ливедоидная васкулопатия имела множество названий, отражающих понимание ее патогенеза. Впервые о ЛВ в 1929 г. упомянул Millian, используя термин atrophie blanche (белая атрофия). Далее в употреблении были такие названия, как «сетчатое ливедо с летними изъязвлениями» (Feldaker и соавт., 1955 г.), однако ЛВ может возникать круглогодично, часто имеет рецидивирующее течение, сопровождается болезненными пурпурными язвами с ретикулярным рисунком на нижних конечностях. С 60-х гг. XX в. использовали термины «ливедо-васкулит» и «сегментарный гиалинизирующий васкулит», а в 1984 г., после защиты О.Л. Ивановым докторской диссертации на тему «Ангииты кожи (классификация, патогенез, клиника, диагностика, лечение)», в отечественной практике закрепился термин «ливедо-ангиит». На данный момент наиболее используемым названием ЛВ является «ливедо-васкулит», а в Международной классификации болезней 10-го пересмотра данное заболевание кодируется как «васкулит с мраморной кожей» [4–6].
Большинство исследователей указывают генетически детерминированную тромбофилию как один из пусковых механизмов ЛВ. В основе ЛВ лежит гиалинизирующий процесс в стенках сосудов с образованием микротромбов, а явления васкулита, подтверждаемые гистологически, вторичны [3, 6].
Повышенное тромбообразование, возможно, является результатом эндотелиальной дисфункции в виде нарушения активации плазминогена, дисфункции тромбоцитов, а также повышенного образования или нарушения лизиса фибрина. В таком случае отложение фибрина и образование тромбов снижают диффузию кислорода в тканях, приводя к инфарктам кожи [7].
Кроме того, снижение уровня кислорода в тканях ведет также к замедлению заживления язв, возникающих при ЛВ [8]. Некоторые авторы также предполагают связь венозной гипертензии и манифестации ЛВ именно на нижних конечностях [2].
В литературе упоминается множество различных состояний, приводящих к гиперкоагуляции у пациентов с ЛВ. К таким состояниям относятся наследственные и приобретенные тромбофилии, например: мутация фактора V Лейдена, дефицит белков C и S, дефицит антитромбина III, мутация гена протромбина G20210A, промотора активатора ингибитора плазминогена-1 (PAI-1), генов рецептора липопротеина (а), гена метилентетрагидрофолата MTHFR, гомоцистеинемия, аутоиммунные заболевания (системная красная волчанка, антифосфолипидный синдром) и злокачественные новообразования [8, 9].
Различные мутации генов системы гемостаза приводят к гиперкоагуляции. Так, мутация фактора V Лейдена возникает в результате одноточечной мутации в месте инактивации активированного фактора V (FVa), что приводит к его устойчивости к действию активированного протеина С (APC) и к протромботическому состоянию. В свою очередь различные мутации гена протеина С (PROC gene) приводят к затруднению связывания АPC c FVa и нарушениям в антикоагулянтной системе крови и процессах фибринолиза. Протеин S, являясь кофактором APC, облегчает его связывание с FVa, что в случае дефицита протеина S также ведет к повышенному тромбообразованию [10]. Дефицит антитромбина III связан с повышенным образованием тромбина у носителей соответствующей мутации, а также со снижением проницаемости фибринового сгустка и увеличением времени его лизиса [11]. Мутация гена протромбина G20210A приводит к усилению экспрессии мРНК и синтеза протромбина, что ведет в некоторых случаях к состоянию гиперкоагуляции [12]. Ингибитор активатора плазминогена-1 (PAI-1) является основным физиологическим ингибитором активаторов плазминогена (PAs) и, следовательно, важным ингибитором системы плазминоген/плазмин. Будучи быстродействующим ингибитором PA тканевого типа (tPA), PAI-1 в первую очередь ослабляет фибринолиз. Была выявлена связь между PAI-1 и различными заболеваниями, включая сердечно-сосудистые заболевания, метаболические нарушения, старение, рак, фиброз тканей, воспаление и нейродегенеративные заболевания. В результате было разработано несколько ингибиторов PAI-1 для дальнейшего изучения роли PAI-1 в моделях заболеваний и изучения их потенциального применения в терапевтических целях [13]. Липопротеин (а) состоит из липопротеиноподобной частицы низкой плотности, связанной с аполипопротеином (а) и аполипопротеином B100. Следовательно, он имеет структурную гомологию с плазминогеном, что приводит к усилению тромбо- и атерогенных свойств [14]. Нарушенная активность MTHFR, а также мутации гена фермента цистатион-β-синтазы (CbS), участвующего в преобразовании метионина в цистеин, связаны с повышенным уровнем гомоцистеина, что может способствовать увеличению продукции активных форм кислорода, снижению уровня естественного вазодилататора NO и развитию оксидативного стресса, который также играет роль в патогенезе ЛВ. Кроме того, гомоцистеин активирует фактор Хагемана, способствуя процессу тромбообразования, обладает низкой растворимостью и может оседать в патологически измененной интиме сосуда, предрасполагая к образованию тромбов [15].
Среди заболеваний, при которых ливедо вторично, выделяют, например, антифосфолипидный синдром (АФС) и системную красную волчанку (СКВ). Оба состояния являются аутоиммунными и ассоциированы с повышенным тромбообразованием. В случае АФС в крови циркулируют антифосфолипидные антитела одного или сразу нескольких типов: волчаночный антикоагулянт, антитела к кардиолипину (IgG/IgM), анти-бета-2-гликопротеин I антитела (IgG/IgM). При СКВ главную роль играет волчаночный антикоагулянт [16].
Несмотря на то что множество протромботических факторов были определены как потенциальные триггеры ЛВ, результаты большинства исследований показали, что в среднем менее чем у половины пациентов удалось идентифицировать какой-либо из известных факторов [2].
В общем и целом на сегодняшний день этиопатогенетические механизмы формирования ЛВ мало изучены, однако их понимание будет способствовать определению места ЛВ среди других заболеваний кожи и оптимизации терапии.
Имеются данные о том, что помимо состояния гиперкоагуляции в патогенезе ЛВ присутствует и компонент воспаления, о чем свидетельствуют выявляемые у пациентов повышенные уровни ИЛ-2 и растворимого рецептора ИЛ-2, которые высвобождаются эндотелием при прогрессировании заболевания с последующим привлечением лейкоцитов [3]. С учетом того, что при ЛВ явления васкулита, хоть и являются вторичными, но все же присутствуют, актуальным становится поиск новых мишеней воздействия на патогенез. Так, например, в последние годы активно изучается роль компонента комплемента С5а (анафилатоксина). После связывания со своим рецептором С5а-компонент комплемента проявляет себя как медиатор воспаления, активатор нейтрофилов и хемоаттрактант, активирует эндотелиальные клетки и повышает проницаемость капилляров. На данный момент исследования, касающиеся С5а, посвящены в основном АНЦА-ассоциированным системным васкулитам и их лечению селективным ингибитором рецептора С5а Авакопаном [17].
Ввиду присутствия при ЛВ вторичного воспаления в стенках капилляров представляется логичным, что на патогенез ЛВ могут оказывать влияние любые факторы, связанные с наличием хронического воспаления в организме, измененными состояниями иммунитета (беременность и роды) в дополнение к факторам, повышающим свертываемость крови (прием комбинированных оральных контрацептивов).
Важно отметить, что после перенесенной коронавирусной инфекции (COVID-19) сообщалось о рецидивах и обострении ЛВ [18]. Несколько независимых авторов представили сообщения о пациентах с COVID-19 и проявлениями ЛВ, подтвержденной гистологически. Были выявлены идентичные особенности – окклюзионная маловоспалительная васкулопатия мелких сосудов кожи [3].
Хотя на данный момент существует множество подходов к лечению ЛВ, ни один из них не является абсолютно эффективным и оптимальным. Кроме того, ввиду сложности патогенеза ЛВ можно сделать вывод, что монотерапия ЛВ не всегда целесообразна.
Основными задачами терапии ЛВ является регресс ливедоидных пятен, уменьшение зябкости, парестезий, болезненности, а при наличии язвенных форм ЛВ – ускорение заживления язвенных дефектов, предотвращение рецидивов и уменьшение болевого синдрома.
Так как в качестве первоначального звена патогенеза на данный момент рассматривается образование микротромбов, то в первой линии терапии рекомендуется применение низкомолекулярных гепаринов (НМГ) или прямых оральных антикоагулянтов (ПОАК). На данный момент опубликовано несколько научных работ с относительно большой выборкой пациентов [19–21]. Кроме того, НМГ уже были использованы для лечения педиатрических пациентов с ЛВ [4]. При этом НМГ и ПОАК показывают свою эффективность не только в уменьшении кожных проявлений ЛВ, но и в снижении болевого синдрома.
Однако актуальной остается проблема вторичного васкулита, возникающего на фоне тромбообразования, и его роли в патогенезе ЛВ и формировании клинических проявлений.
Адекватная терапия боли имеет решающее значение в борьбе против ухудшения качества жизни. При отсутствии лабораторных изменений терапия нестероидными противовоспалительными средствами в сочетании с ангиопротекторами и дезагрегантами представляется достаточной [3].
С учетом наличия васкулита при ЛВ и потенциальной связи с аутоиммунными заболеваниями отмечают положительный терапевтический ответ на иммуносупрессивные средства, такие как преднизолон, азатиоприн, циклоспорин, колхицин, генно-инженерные биологические препараты (этанерцепт, ритуксимаб, тофацитиниб) и современные иммуноглобулины [2, 3].
В отечественной практике в качестве терапии успешно используется сочетание преднизолона и азатиоприна [22, 23]. Актуальная оценка всех составляющих патогенеза лежит в основе разработки адекватных протоколов комплексной терапии данного заболевания с применением консервативной терапии и современных физиотерапевтических методов.
Низкотемпературная аргоновая плазма
Низкотемпературная аргоновая плазма (НТАП) длительное время успешно применяется в хирургической практике при лечении открытых ран, в том числе послеоперационных, а также при терапии язвенных дефектов кожи различной этиологии ввиду своего активного антисептического, анестезирующего и регенерирующего действия. Потенциал применения НТАП достаточно высок, однако лежащие в основе ее действия механизмы остаются малоизученными.
В отечественных источниках представлены отчеты медицинских учреждений по оценке влияния НТАП на выживаемость микроорганизмов (in vitro), а также на пролиферативную активность фибробластов (in vitro). Из отчетов следует, что низкотемпературная аргоновая плазма оказывает выраженный антибактериальный и противогрибковый эффекты в культурах микроорганизмов. Стоит также отметить, что интенсивность указанных эффектов была тем выше, чем меньше было расстояние от формирующегося потока НТАП до обрабатываемой поверхности. В исследованиях же, касающихся пролиферации фибробластов in vitro в монослойной клеточной структуре, заметное усиление пролиферации клеток при минимальном повреждении клеточных мембран наблюдалось при обработке НТАП с расстояния 10–15 см при сопутствующем экранировании клеточной культуры коллагеновой повязкой (имитация раневой поверхности). Предполагается, что низкотемпературная плазма способствует повышению проницаемости клеточных мембран, что может стимулировать проникновение в клетку сигнальных молекул, активирующих ионов (в частности, ионов калия, кальция и магния) и, таким образом, запускать разные формы клеточной активности [24].
В исследовании X.M. Shi и соавт., проведенном на культуре мышиных фибробластов, было установлено, что обработка фибробластов низкотемпературной плазмой в течение 15 секунд приводит к значительному увеличению пролиферации клеток, секреции эпидермального фактора роста и трансформирующего фактора роста-βi, продукции внутриклеточных активных форм кислорода и процента клеток в S-фазе, экспрессии белка p65 и циклина D1, но и к снижению экспрессии белка ингибитора каппа-B. Эксперименты in vitro показали, что 30-секундная обработка плазмой увеличила количество фибробластов и их способность синтезировать коллаген, тогда как 50-секундная обработка привела к противоположным результатам [25].
Применение НТАП в рамках комплексного лечения ЛВ
Для исследования были отобраны пациенты с диагнозом ЛВ, установленным на основании данных анамнеза, клинической картины и гистологического исследования биоптатов кожи.
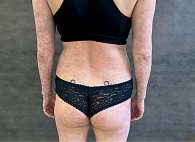
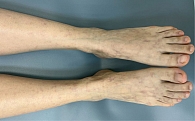
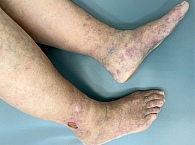
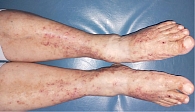
Под наблюдением находились 22 пациента женского и мужского пола (18 женщин и четверо мужчин) с диагнозом ливедоидной васкулопатии в возрасте от 34 до 78 лет. При поступлении в стационар кожный процесс у всех пациентов был локализован в области нижних конечностей и представлен пятнами синюшной окраски (рис. 1), различных очертаний и размеров, образующими петлистую сеть, или сочетанием синюшных пятен и мелких язвенных дефектов кожи в области лодыжек и тыла стоп, после заживления которых оставались белесоватые рубцы с зоной гиперпигментации вокруг. Субъективно пациентов беспокоили зябкость, тянущая боль в конечностях, пульсирующая боль в язвах.
Всем пациентам были проведены стандартные лабораторные исследования: общий анализ мочи, общий анализ крови, биохимический анализ крови, исследование свертываемости крови: наблюдалось повышение скорости оседания эритроцитов, снижение уровня гемоглобина, числа эритроцитов и тромбоцитоз, лейкоцитоз.
По результатам гистологического исследования – в сосочковом слое дермы слабовыраженный периваскулярный инфильтрат, утолщение сосудистой стенки и сужение просвета сосудов. Предполагается, что минимальный лейкоцитарный инфильтрат, встречающийся вокруг сосудов, возникает вторично в ответ на тромбоокклюзию. Также является важным то, что при ЛВ структура стенок сосудов в значительной степени сохраняется, хотя сегменты стенок сосудов, связанные с тромбозом, утолщены, с пролиферацией, пристеночным фибрином и субинтимальным гиалинозом. Присутствие иммуноглобулинов и компонентов комплемента также не является специфической чертой ЛВ [2, 3].
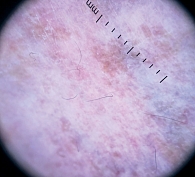
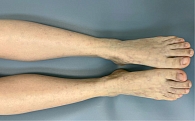
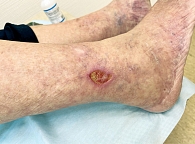
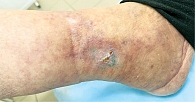
При дерматоскопии в области ливедо наблюдается дилатация и пролиферация капилляров в верхних слоях дермы. Пигментированный же рисунок вокруг рубцов связан с гиперпигментацией базального слоя эпидермиса или меланином меланофагов в дермальных сосочках (рис. 2, 3) [26].
Всем пациентам проведено лечение: системные глюкокортикостероиды (преднизолон в средних терапевтических дозах 3–40 мг в сутки с постепенным снижением в течение двух месяцев) в сочетании с корригирующей терапией, при упорном течении – азатиоприн (50 мг два раза в сутки в течение месяца), антикоагулянты (ривароксабан 10 мг в сутки), антиагреганты (дипиридамол 75 мг в сутки), вазодилатирующие препараты (пентоксифиллин), стимуляторы регенерации тканей (актовегин), венотоники (детралекс 1000 мг в сутки), витамины С и Р (аскорутин две таблетки три раза в день в течение месяца). Наружно при язвенных дефектах: антисептическая обработка раневой поверхности, эпителизирующие мази (офломелид, левосин), антибактериальные кремы для заживления (аргосульфан, дермазин), коллагеновые губки, сетки, мазевые повязки.
Перед началом обследования и лечения пациентами было подписано информированное согласие, а с целью дальнейшего объективного отслеживания динамики процесса были предложены для заполнения чек-листы DLQI и Pain Detect, а также проведено исследование микроциркуляции крови рядом с очагами поражения (в случае наличия язвенных дефектов на расстоянии 2 см от края язвы) или в области медиальной лодыжки (в случае наличия только ливедоидных пятен). Далее пациенты случайным образом были распределены в группу контроля и группу исследования. В группу исследования вошли 12 пациентов (девять женщин и трое мужчин), в группу контроля – 10 пациентов (девять женщин и один мужчина). Пациенты группы контроля получали только консервативное лечение, а пациентам группы исследования была дополнительно проведена обработка низкотемпературной аргоновой плазмой.
В среднем пациентам было проведено 6–10 процедур обработки НТАП с применением установки «Плазморан» ежедневно или через день с экспозицией 30–60 секунд и расстоянием от струи плазмы до области обработки 10–15 см; пациенты находились на стационарном лечении в среднем 15 дней.
Следует отметить, что каких-либо побочных явлений при применении НТАП выявлено не было. Назначенные процедуры пациенты переносили хорошо, дискомфорта и нежелательных явлений не отмечали.
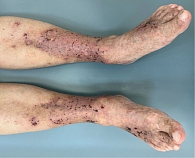
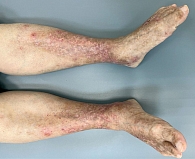
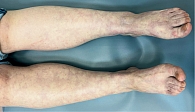
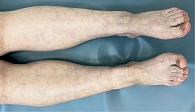
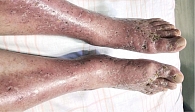
В обеих группах после проведенного лечения наблюдалась положительная динамика в виде исчезновения онемения и боли в нижних конечностях, активации заживления язвенных дефектов, уменьшения выраженности ливедо, но при присоединении к основной терапии процедур низкотемпературной аргоновой плазмы наблюдалось более выраженное улучшение со стороны кожного процесса у пациентов группы исследования по сравнению с группой контроля (рис. 4–14).
Для оценки болевого синдрома у пациентов с ЛВ в группе исследования до лечения использовали опросник Pain Detect, среднее значение составило 20 баллов, что по оценочной шкале соответствует высокой вероятности невропатического компонента боли. После проведенного комплексного лечения болевой синдром снизился в среднем до 14,5 балла (на 27,5%). В группе контроля данный показатель изменился с 21 балла в среднем до 16,8 балла (на 20%).
До лечения среднее значение DLQI составляло 17,3 балла, что отражало сильное негативное влияние заболевания на качество жизни больных. После лечения данный индекс уменьшился в 1,3 раза и составил 13,6 балла в группе исследования. В группе контроля среднее значение DLQI составляло 17,1 балла, после лечения индекс снизился в 1,2 раза и составил в среднем 14,1 балла.
Среднее значение показателя М, вычисленного с помощью установки ЛАКК-ОП (капилляроскоп) и отражающего средний поток в микроциркуляторном русле за определенный промежуток времени исследований или за выбранный временной интервал анализа до начала терапии в группе исследования, составил в среднем 40,83, а после лечения – 30,64 (снизился на 25%), что свидетельствует об уменьшении воспалительного компонента. В группе контроля данный показатель составил в среднем 39,8 до начала консервативной терапии и 34,56 (снизился на 13,17%) после проведения консервативной терапии.
Выводы
На основе клинических данных, результатов повторного капилляроскопического исследования и повторного заполнения анкет можно сделать следующие выводы:
- Комплексная терапия дерматозов с применением низкотемпературной аргоновой плазмы позволяет улучшить качество жизни, что подтверждается динамикой индекса DLQI.
- При выполнении процедур с применением установки «Плазморан» не было отмечено проявлений побочных эффектов.
- При добавлении к основной терапии процедур низкотемпературной аргоновой плазмы наблюдается более выраженный регресс высыпаний и улучшение общего состояния пациентов группы исследования по сравнению с группой контроля по данным субъективного опроса и объективных методов исследования.
- После 6–10 процедур с низкотемпературной аргоновой плазмой у пациентов наблюдался положительный клинический ответ в виде исчезновения онемения и боли в нижних конечностях, заживления язвенных дефектов, уменьшения выраженности ливедо.
- С учетом хронического течения ЛВ, зачастую торпидного к проводимой терапии, целесообразно назначение повторных курсов применения установки «Плазморан» в процессе динамического наблюдения за больными.
Согласие пациентов. От пациентов получено письменное добровольное информированное согласие на публикацию персональной медицинской информации в обезличенной форме для описания клинического случая и публикации фотоматериалов в данном журнале.
Финансирование. Авторы заявляют об отсутствии внешнего финансирования при проведении поисково-аналитической работы и подготовке рукописи.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
O.Yu. Olisova, PhD, Prof., Corresponding member of the RAS, O.V. Grabovskaya, PhD, Prof., L.N. Kayumova, PhD, A.V. Stepantsova
I.M. Sechenov First Moscow State Medical University
Contact person: Olga Yu. Olisova, olisovaolga@mail.ru
Effective treatment of livedoid vasculopathy is one of the most pressing and complex problems of dermatovenereology. To date, the etiopathogenetic mechanisms of the formation of livedoid vasculopathy have been poorly studied, but it is their establishment that underlies the selection of adequate methods of therapy for this disease. Determination of the pathogenesis and clear criteria for diagnosis will help differentiate livedoid vasculopathy from other similar diseases, determine its place among other skin diseases, reduce the time of detection of the disease and, in the long term, improve the quality of life of patients through the use of combined treatment methods.
Aim – to evaluate the effectiveness of treatment of livedoid vasculopathy using low-temperature argon plasma.
Material and methods. Treatment of livedoid vasculopathy was performed in 22 patients (18 women and 4 men) aged 34 to 78 years after preliminary confirmation of the diagnosis by the results of histological and dermatoscopic examinations. Before treatment, patients were randomly assigned to the control group and the study group. All patients underwent capillaroscopy to assess capillary perfusion in the affected area; patients completed the DLQI (Dermatology Life Quality Index) and Pain Detect questionnaires. Conservative treatment included: systemic glucocorticosteroids (prednisolone in average therapeutic doses of 30–40 mg per day with a gradual decrease over 2 months) in combination with corrective therapy, in case of persistent course – azathioprine (50 mg 2 times a day for a month), anticoagulants (rivaroxaban 10 mg per day), antiplatelet agents (dipyridamole 75 mg per day), vasodilators (pentoxifylline), tissue regeneration stimulants (actovegin), venotonics (detralex 1000 mg per day), vitamins C and P (ascorutin 2 tablets 3 times a day for a month). Externally for ulcerative defects: antiseptic treatment of the wound surface, epithelializing ointments (oflomelid, levosin), antibacterial creams for healing (argosulfan, dermazin), collagen sponges, meshes, hydrogel dressings.
In the study group, in addition to conservative therapy, patients were given an average of 6–10 low-temperature argon plasma (LTAP) treatment procedures using the Plasmoran device daily or every other day with an exposure of 30–60 seconds and a distance from the plasma jet to the treatment area of 10–15 cm; patients were hospitalized for an average of 15 days.
Results. Complex therapy of livedoid vasculopathy using low-temperature argon plasma made it possible to achieve a significant improvement in the quality of life of patients, reduce the manifestations of livedo and accelerate the epithelialization of ulcerative defects compared to the control group.
Conclusion. Based on clinical data, the results of repeated capillaroscopic examination and repeated completion of checklists, it can be concluded that combination therapy of livedoid vasculopathy using NTAP gives visible positive results in the absence of side effects in patients and can be introduced into dermatological practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.