Периметр виртуальной реальности и автоматизированный анализатор поля: новые возможности для диагностики нейроофтальмологических заболеваний
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Протестированы поля зрения с использованием технологий периметра виртуальной реальности (iVA) и стандартной автоматической периметрии (SAP). iVA представил стимулы в тех же 54 позициях, что и стандартный тест HFA 24-2 SITA, с помощью сверхпорогового алгоритма. Пациентов разделили на три группы. В первую группу вошли 20 пациентов с подтвержденным диагнозом «аденома гипофиза/рецидив аденомы гипофиза». Во вторую группу были включены пять пациентов, перенесших трансфеноидальную аденомэктомию. Третью (контрольную) группу составили пять здоровых пациентов без нейроофтальмологических и офтальмологических патологий. После сбора анамнеза и оценки остроты зрения пациенты проходили тесты на стандартном автоматическом периметре (ПЕРИКОМ) и iVA. После тестов проводился опрос удовлетворенности пациентов использованием iVA и периграфа ПЕРИКОМ.
Результаты. Результаты обоих тестов показали схожесть в определении аномальных точек. iVA продемонстрировал большую надежность (81,4%) по сравнению с периграфом ПЕРИКОМ (59,3%) (p = 0,009) среди нейроофтальмологических пациентов. iVA показал меньше ложноотрицательных и больше ложноположительных результатов (p < 0,001). Корреляция между iVA и периграфом ПЕРИКОМ составила 70%, а для гемианопсии – 87,5%. Опрос показал, что 93% пациентов предпочли iVA за простоту и удобство и 60% использовали бы его дома при наличии такой возможности.
Материал и методы. Протестированы поля зрения с использованием технологий периметра виртуальной реальности (iVA) и стандартной автоматической периметрии (SAP). iVA представил стимулы в тех же 54 позициях, что и стандартный тест HFA 24-2 SITA, с помощью сверхпорогового алгоритма. Пациентов разделили на три группы. В первую группу вошли 20 пациентов с подтвержденным диагнозом «аденома гипофиза/рецидив аденомы гипофиза». Во вторую группу были включены пять пациентов, перенесших трансфеноидальную аденомэктомию. Третью (контрольную) группу составили пять здоровых пациентов без нейроофтальмологических и офтальмологических патологий. После сбора анамнеза и оценки остроты зрения пациенты проходили тесты на стандартном автоматическом периметре (ПЕРИКОМ) и iVA. После тестов проводился опрос удовлетворенности пациентов использованием iVA и периграфа ПЕРИКОМ.
Результаты. Результаты обоих тестов показали схожесть в определении аномальных точек. iVA продемонстрировал большую надежность (81,4%) по сравнению с периграфом ПЕРИКОМ (59,3%) (p = 0,009) среди нейроофтальмологических пациентов. iVA показал меньше ложноотрицательных и больше ложноположительных результатов (p < 0,001). Корреляция между iVA и периграфом ПЕРИКОМ составила 70%, а для гемианопсии – 87,5%. Опрос показал, что 93% пациентов предпочли iVA за простоту и удобство и 60% использовали бы его дома при наличии такой возможности.










Актуальность
Комплексное нейроофтальмологическое обследование без оценки полей зрения считается неполным. Характер дефектов полей зрения помогает в топической диагностике очага поражения относительно зрительных путей, что способствует раннему выявлению заболевания и своевременному вмешательству, которое может спасти пациенту зрение и жизнь.
Исследование полей зрения имеет не только диагностическое значение. Оно проводится в целях мониторинга динамики заболевания (разрешения или рецидива) и планирования реабилитационных мероприятий [1, 2].
В настоящее время золотым стандартом измерения поля зрения является автоматизированная статическая периметрия с использованием анализатора поля зрения Humphrey (HFA, Carl Zeiss Meditec Inc, Калифорния, США), периграфа ПЕРИКОМ (Россия), Tomey AP 3000 (Япония). Однако автоматизированная статическая периметрия имеет ограничения. Проведение автоматизированной периметрической диагностики требует от пациентов хороших когнитивных функций и способности длительно сохранять определенную позу во время тестирования. Это может быть затруднительно для пациентов с неврологическими нарушениями. Как следствие – сомнительные результаты и малоинформативное тестирование. Кроме того, это дорогостоящее и трудоемкое исследование. Таким образом, автоматизированный статический периметр не может использоваться в условиях ограниченных ресурсов и пространства, а также в случае неврологических нарушений. Некачественное обследование может стать причиной повторных неоправданных исследований, в частности магнитно-резонансной томографии головного мозга, или невыполнения исследований в надлежащий срок. Эти факторы указывают на потребность в недорогом и удобном в использовании методе оценки полей зрения с точностью, приближенной к точности автоматических статических периметров [1, 2].
В настоящее время разработаны портативные устройства для скрининга полей зрения, хотя большинство из них по-прежнему требуют, чтобы пациенты принимали такое же положение для тестирования, как и при автоматизированной статической периметрии. Это может быть сложной задачей для пожилых пациентов, инвалидов или неподвижных больных. Устройства для скрининга полей зрения виртуальной реальности, фиксируемые на голове, потенциально могут быть доступными, удобными в использовании и портативными и расширить круг лиц, нуждающихся в тестировании полей зрения [3].
В настоящем исследовании оценивалась эффективность устройства iVA (Intelligent Vision Analyse) в качестве инструмента скрининга и диагностики нейроофтальмологических расстройств за счет измерения чувствительности, специфичности и корреляции алгоритма скрининга iVA по сравнению со стандартными автоматизированными анализаторами поля зрения (ПЕРИКОМ).
Цель – оценить эффективность использования анализатора полей зрения iVA – устройства для тестирования поля зрения виртуальной реальности в качестве возможной субъективной периметрии для скрининга и в конечном итоге мониторинга выявления нейроофтальмологических заболеваний в сравнении со стандартной автоматической периметрией.
Материал и методы
Выполнено тестирование полей зрения с использованием периметра виртуальной реальности и стандартной автоматической периметрии (SAP).
iVA представил стимулы в тех же 54 позициях, что и стандартный тест HFA 24-2 SITA с использованием сверхпорогового алгоритма, приближающегося к дефициту 18 дБ.
За три месяца было отобрано 30 пациентов в возрасте 45–55 лет. Среди них были пациенты, получавшие консультации в КДО Московского областного научно-исследовательского клинического института (МОНИКИ) им. М.Ф. Владимирского и/или находившиеся на лечении в нейрохирургическом и эндокринологическом отделениях МОНИКИ им. М.Ф. Владимирского с подтвержденным с помощью лабораторных и лучевых методов диагнозом аденомы гипофиза. Пациентов разделили на три группы. В первую группу вошли 20 пациентов с подтвержденным диагнозом «аденома гипофиза/рецидив аденомы гипофиза». Во вторую группу были включены пять пациентов, перенесших транссфеноидальную аденомэктомию. Третью (контрольную) группу представляли пять здоровых пациентов без нейроофтальмологических и офтальмологических патологий.
У каждого пациента после предварительного сбора анамнеза оценивали остроту зрения. Пациенты подписали информированное согласие на участие в исследовании и прохождение теста на стандартном автоматизированном анализаторе поля зрения (ПЕРИКОМ).
Тест на стандартном автоматизированном анализаторе поля зрения (ПЕРИКОМ) с использованием алгоритма SITA 24-2. Подготовка к исследованию включала просмотр обучающего видеоролика и дополнительный инструктаж, в ходе которого пациенты должны были сосредоточиться на центральной точке фиксации, отображенной в виде красной точки, и реагировать на появление внешних стимулов с помощью портативного кликера. Измерение на каждом глазу проводилось поочередно, при этом другой глаз закрывался окклюдером. Тесты на стандартном автоматизированном анализаторе поля зрения (ПЕРИКОМ) считались ненадежными, если частота ложноположительных (FP) или ложноотрицательных результатов (FN) превышала 33%. Испытуемым с ненадежным показателем предоставляли десятиминутный перерыв, а затем снова проводили тест. Если результат по-прежнему был ненадежным, испытуемый исключался из исследования [3].
Тестирование iVA. Периметр виртуальной реальности, устанавливаемый на голове, состоит из трех подсистем – гарнитуры виртуальной реальности, планшета и портативного кликера. Все три подсистемы соединены между собой через Bluetooth. Пользователь может надеть гарнитуру виртуальной реальности, а оператор – управлять тестом через приложение iVA на планшете. С помощью приложения оператор выбирает параметры, такие как поле зрения, стратегия тестирования, и глаз, подлежащий проверке, предварительно внеся данные пациента. Тест можно запустить, приостановить, возобновить и прервать в любое время [1, 4].
На основании введенных оператором параметров в гарнитуре виртуальной реальности запускается тест. Одновременно отображается стимул только для выбранного глаза. Поскольку экран дисплея для каждого глаза является независимым, накладывание повязки на глаза не требуется. Накладка на устройстве обеспечивает затемнение внутри гарнитуры виртуальной реальности, поэтому для проведения теста не нужна темная комната. Для коррекции аномалий рефракции предусмотрен набор линз, однако доступны только сферические линзы, а для цилиндрических линз используется сферический эквивалент. Экран гарнитуры виртуальной реальности откалиброван на полупрозрачный фон (оттенок белого), что обеспечивает яркость 10 кд/м2 (эквивалентно 31,5 апостиля). Белый стимул может быть представлен пользователю с различной интенсивностью. Тем не менее в исследовании мы использовали фиксированную сверхпороговую яркость стимулов, установленную на уровне 60 кд/м2, что приблизительно соответствует 18 дБ стимула HFA. Выполнен тест на превышение порогового значения 30-2. В начале теста пользователь может видеть точку фиксации в центре. Пользователю предлагается продолжать смотреть в центр и нажать кнопку ответа, увидев мигающую точку (стимул). Стимул подается в течение 200 мс, и пользователю предоставляется временной интервал 1300 мс для ответа. После этого подается следующий стимул, и тест продолжается. Перед началом теста устройство показывает десять точек рядом с потенциальным местоположением слепой зоны. В зависимости от ответа эта слепая зона отображается на карте. Во время теста на слепую зону проецируется до 3% стимулов, и, если пользователь все же нажимает на нее, это засчитывается как потеря фиксации. В дополнение к этому еще 3% стимулов во время теста отображаются с задержкой 1200 мс. Если пользователь продолжает нажимать, когда на экране не отображается ни один стимул, это засчитывается как ложноположительный ответ. Каждое положение стимула было представлено дважды во время теста. Ответ считался ложноотрицательным, если для какой-либо заданной точки пользователь нажал один раз и не нажал в другой раз [1, 4].
Оператор может отслеживать ход тестирования с помощью планшета, на котором графически представлены области, в которых отображается стимул, а параметры надежности, такие как потери фиксации и ложные срабатывания, обновляются в режиме реального времени. На основании данной информации оператор может ограничить доступ пользователя или прервать и перезапустить тестирование, если параметры надежности выходят за пределы допустимого. Результаты тестирования доступны и сохраняются в программном обеспечении смартфона, которое при необходимости можно экспортировать [1].
Пациентам был показан обучающий видеоролик по использованию iVA, а также проведен краткий демонстрационный тест. В исследование включались оба глаза в соответствии с критериями. Между тестированием двух глаз и тестированием двух полей зрения был установлен обязательный пятиминутный перерыв. Лицам с ненадежными полями зрения предоставляли короткий десятиминутный перерыв, после чего тестирование повторялось.
В ходе тестирования на ПЕРИКОМЕ с использованием алгоритма SITA 24-2 и тестирования iVA был проведен опрос: пациентов просили оценить простоту и комфортность использования iVA и ПЕРИКОМА и высказать мнение об использовании iVA в будущем.
Результаты
В исследование было включено 30 пациентов, которые прошли полное тестирование на стандартном автоматизированном анализаторе поля зрения (ПЕРИКОМ) с использованием алгоритма SITA 24-2 и тестирование iVA.
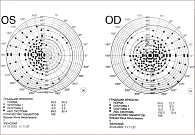
Результаты отчета iVA были сопоставлены с отчетами стандартного автоматизированного анализатора поля зрения (ПЕРИКОМ) для всех участников. В большинстве случаев количество аномальных точек в обоих тестах совпало. В ходе тестирования на iVA можно выявить изменения полей зрения от минимальных до грубых (рис. 1–11).
Обнаружено, что iVA имеет большую долю надежных полей (81,4%), чем ПЕРИКОМ (59,3%) (p = 0,009). У нейроофтальмологических пациентов было меньше ложноотрицательных результатов (p < 0,001) и больше ложноположительных при использовании iVA (p < 0,001) по сравнению с контрольной группой. У нейроофтальмологических пациентов частота потери фиксации была больше при тестировании с помощью iVA (p < 0,001), тогда как ложноотрицательных результатов было больше в случае применения ПЕРИКОМА (p < 0,001). При оценке структуры дефектов полей зрения установлено, что корреляция iVA и ПЕРИКОМА достигает почти 70%. Более того, в классических неврологических областях, таких как гемианопсия, корреляция составила 87,5% [4].
В результате опроса 93% пациентов предпочли тестирование с помощью iVA тестированию на ПЕРИКОМЕ, поскольку сочли, что iVA проще в использовании (p < 0,001) и удобнее (p < 0,001) ПЕРИКОМА. 60% заявили, что использовали бы iVA в домашних условиях при наличии такой возможности.
Обсуждение
В исследовании оценивали роль устройства iVA, использующего сверхпороговый стимул, в тестировании полей зрения у нейроофтальмологических пациентов. Выявлена хорошая корреляция между iVA и стандартными автоматизированными анализаторами поля зрения [1].
В последнее время возрос интерес к разработке периметров на основе виртуальной реальности, имеющих значительные преимущества перед другими анализаторами. Само устройство достаточно компактно – его можно носить с собой, в центры визуализации или использовать в домашних условиях. Постоянное электропитание и доступ к Интернету не требуются [1].
Потери фиксации и ложноотрицательные результаты чаще наблюдались при использовании iVA, а ложноположительные – при использовании стандартных автоматизированных анализаторов полей зрения. Мы обнаружили, что у нейроофтальмологических пациентов потери фиксации были выше при тестировании с помощью iVA, однако ложноотрицательных результатов было больше в случае применения стандартных автоматизированных анализаторов полей зрения. Кроме того, выявлены большие потери фиксации у нейроофтальмологических пациентов при тестировании с помощью iVA и стандартных автоматизированных анализаторов полей зрения по сравнению с контрольной группой. Скорее всего это следствие нарушения фиксации при нейроофтальмологической патологии. Потеря фиксации при использовании iVA может быть обусловлена недостаточным умением населения пользоваться новыми устройствами виртуальной реальности. Потеря фиксации может быть также связана с тем, что вся внешняя среда заблокирована, участники начинают искать свет. Проведение стандартного автоматизированного тестирования полей зрения занимает больше времени, что может привести к повышенной утомляемости пациента и увеличению частоты ложноотрицательных результатов. iVA выполняется намного быстрее, что может объяснять очень низкий уровень ложноотрицательных результатов [1].
Пациенты с нейрохирургическими расстройствами часто сталкиваются с трудностями при выполнении автоматизированной периметрии. Причин несколько: неспособность длительно удерживать осанку, снижение когнитивных функций, большая продолжительность выполнения данного теста, необходимость обращения в специализированное медицинское учреждение для проведения теста [1, 2]. Портативный периметр iVA, нивелирующий эти недостатки при достаточно хорошей корреляции, может быть полезным инструментом для оценки нейроофтальмологического статуса и мониторинга заболевания.
Текущая версия устройства может быть использована для экспресс-диагностики в качестве массового скрининга населения, однако при выявлении дефектов полей зрения необходимо впоследствии провести расширенную диагностику с использованием статических периметров, так как в сравнении с ними iVA имеет ряд существенных ограничений.
При исследовании с помощью iVA был протестирован только порог 18 дБ. Стимул был равномерным по всему полю зрения. Для более точной диагностики необходимо оценить полезность других уровней дБ для сверхпорогового скрининга в зависимости от конкретного местоположения. В усовершенствованных устройствах интенсивность стимула должна регулироваться из-за неоднородности чувствительности сетчатки по всему полю зрения и ее возрастных изменений. Эти изменения необходимо учитывать при разработке полного порогового алгоритма и создании нормативной базы данных. Виртуальная периметрия, позволяющая упростить скрининг исследования полей зрения в виде дистанционного тестирования во внестационарных условиях, делает возможным обследование пожилых пациентов, инвалидов и неподвижных больных [3].
Заключение
С помощью iVA (Intelligent Vision Analyse) можно проводить массовый скрининг пациентов для выявления любых возможных ограничений полей зрения. iVA рассматривается в качестве метода ранней диагностики нейроофтальмологической патологии, и не только.
Авторы выражают благодарность разработчику и руководителю проекта VR диагностики В.Я. Высочанскому.
I.A. Loskutov, PhD, I.Yu. Mezhevova, PhD, M.P. Agadzhanyan
M.F. Vladimirsky Moscow Regional Scientific Research Institute
Contact person: Marta P. Agadzhanyan, marta.agadzhanyan@mail.ru
The aim is to evaluate the effectiveness of using the iVA (Intelligent Vision Analysis) visual field analyzer, a device for testing the visual field of virtual reality, as a possible subjective perimetry for screening and eventually monitoring the detection of neuro–ophthalmic diseases in a comparative analysis of the results of standard automatic perimetry (SAP).
Material and methods. Visual fields have been tested using virtual reality perimeter (iVA) and standard automatic perimeter (SAP) technologies. iVA applied stimuli in the same 54 positions as the standard HFA 24-2 SITA test using an ultra-threshold algorithm. The patients were divided into three groups. The first group included 20 patients with a confirmed diagnosis of pituitary adenoma/recurrent pituitary adenoma. The second group included five patients who had undergone transfenoidal adenomectomy. The third (control) group consisted of five healthy patients without neuro-ophthalmological and ophthalmological pathologies. After collecting anamnesis and assessing visual acuity, patients underwent tests on the standard automatic perimeter (PERICOM) and iVA. After the tests, a survey of patient satisfaction with the use of iVA and PERICOM perigraphy was conducted.
Results. The results of both tests showed similarities in identifying abnormal points. iVA demonstrated greater reliability (81.4%) compared to the perigraph PERICOM (59.3%) (p = 0.009) among neuro-ophthalmological patients. iVA showed fewer false negatives and more false positives (p < 0.001). The correlation between iVA and perigraph PERICOM was 70%, and 87.5% for hemianopia. The survey showed that 93% of patients preferred iVA for its simplicity and convenience, and 60% would use it at home if there was such an opportunity.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.