Первый Российско-Азиатский уроандрологический конгресс Уроандрология: современный взгляд на известные проблемы
- Аннотация
- Статья
- Ссылки




Согласно наиболее распространенной во всем мире классификации простатита, разработанной Национальным институтом здоровья США в 1995 г., выделяют четыре категории заболевания:
- категория I. Острый бактериальный простатит;
- категория II. Хронический бактериальный простатит;
- категория III. Хронический абактериальный простатит/синдром хронической тазовой боли (IIIA – воспалительной природы, IIIB – невоспалительного характера);
- категория IV. Асимптоматический воспалительный простатит (гистологический простатит).
Данная классификация основывается на клинических признаках, наличии или отсутствии лейкоцитов и микроорганизмов в секрете простаты, эякуляте и моче. Как отметил Рефат Эльдарович АМДИЙ (д.м.н., Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова), взгляды европейской, американской и российской школ на хронический простатит отличаются.
Западные ученые считают, что хронический простатит – это прежде всего боль (по крайней мере на протяжении трех месяцев) в области малого таза/промежности, органах мочеполовой системы. При этом наличие обструктивной или ирритативной симптоматики, а также положительного результата бактериологического исследования необязательно. По мнению российских специалистов, простатит – это в первую очередь воспаление предстательной железы, в патогенезе которого ведущую роль играют венозный стаз и застой секрета в ацинусах, и во вторую – присоединение бактериальной инфекции на фоне нарушения микроциркуляции. Эта точка зрения подтверждается положительным эффектом назначения больным хроническим простатитом препаратов, улучшающих кровоток.
По представлениям российской урологической школы, хронический простатит сопровождают четыре основных симптома, которые могут сочетаться или проявляться изолированно. Это боль, нарушение мочеиспускания, нарушение половой функции и астеновегетативный синдром. Выделяют также фазы (активную, латентную, ремиссии) и стадии (альтерации, пролиферации, склероза) хронического простатита. Выбор тактики лечения зависит от преобладания какого-либо из указанных симптомов, а также фазы и стадии заболевания. Например, тактика лечения пациента с активной фазой хронического простатита, выраженным болевым синдромом и нарушением мочеиспускания и этого же пациента в стадии ремиссии заболевания будет отличаться.
Если говорить об этиологии заболевания, то при хроническом бактериальном простатите, который встречается в 10–20% случаев, возбудителем чаще всего является кишечная палочка (50–80%). Однако 80–90% пациентов страдают хроническим абактериальным простатитом, когда роста условно-патогенной флоры в секрете предстательной железы не наблюдается. В таких случаях при ПЦР-диагностике секрета, а все чаще и биоптата в ходе научных исследований обнаруживаются инфекции, передаваемые половым путем (ИППП), – в 70–88% случаев это хламидии, уреаплазмы и микоплазмы.
Для лечения хронического бактериального простатита Российское общество урологов препаратами выбора называет фторхинолоны, что полностью соответствует рекомендациям Европейской ассоциации урологов. Для лечения пациентов, у которых роста условно-патогенной микрофлоры в секрете предстательной железы не выявлено, но обнаружены возбудители ИППП, препаратами выбора являются джозамицин (Вильпрафен) и доксициклина моногидрат (Юнидокс Солютаб)1 (табл. 1). Выбор джозамицина и доксициклина для элиминации хламидий, уреаплазм и микоплазм основан на высокой чувствительности микробов к этим препаратам в отличие от азитромицина и кларитромицина. Кроме того, Вильпрафен и Юнидокс Солютаб создают высокие концентрации в простате и улучшают показатели фертильности. Говоря о доксициклине, нужно обратить внимание на его соль – гидрохлорид или моногидрат, поскольку их профиль безопасности существенно различается. Так, доксициклина гидрохлорид намного чаще вызывает развитие язвенных поражений желудочно-кишечного тракта и даже запрещен в некоторых странах. В свою очередь доксициклин в виде нейтральной соли моногидрата хорошо переносится и минимально раздражает желудочно-кишечный тракт.
Расстройства мочеиспускания при хроническом простатите могут быть обусловлены функциональной обструкцией шейки мочевого пузыря, псевдодиссинергией сфинктера, гиперактивностью мочевого пузыря, а также турбулентностью потока мочи и, как следствие, возникновением интрапростатических рефлюксов. При этом моча начинает попадать в протоки предстательной железы и вызывать химически индуцированное воспаление. В такой ситуации оправданно применение альфа-адреноблокаторов. Благодаря высокой плотности альфа-адренорецепторов в шейке мочевого пузыря альфа-адреноблокаторы нормализуют уродинамику нижних мочевых путей (уровень доказательности 1а)2, что подтверждено результатами рандомизированных исследований. По сравнению с плацебо у пациентов, длительно принимавших тамсулозин, статистически значимо уменьшались болевой синдром, дизурические явления и общий балл по шкале NIH-CPSI3.
Следует отметить: альфа-адреноблокаторы в качестве монотерапии эффективны, если длительность синдрома хронической тазовой боли составляет меньше одного года (степень рекомендаций А)2. Когда пациент страдает хроническим простатитом в течение 10–15 лет, целесообразно помимо альфа-адреноблокаторов назначить терапию антибиотиками. Было проведено двойное слепое рандомизированное исследование, где пациенты (n = 105) получали тамсулозин, левофлоксацин или их комбинацию. Уменьшение болевого синдрома и дизурии отмечалось во всех группах, однако при сочетанном использовании антибиотика и альфа-адреноблокатора эффективность лечения была существенно выше4. Таким образом, тамсулозин способствует устранению дизурии и болевого синдрома у пациентов с хроническим абактериальным простатитом. Эффективность препарата обусловлена его влиянием на патофизиологические механизмы развития хронического простатита. Комбинированное лечение имеет более выраженный эффект за счет синергизма действия препаратов.
Следует отметить: форма тамсулозина с контролируемым высвобождением (Омник Окас) характеризуется более редким развитием побочных эффектов по сравнению с традиционной формой капсул. Так, частота развития ортостатической гипотензии в случае применения Омника Окас снижается практически в два раза5.
У ряда пациентов жалобы сохраняются и после проведенной терапии антибиотиками, препаратами, улучшающими микроциркуляцию, и альфа-адреноблокаторами. Для точного выявления причин сохранения расстройств мочеиспускания и определения оптимальной тактики лечения больных хроническим абактериальным простатитом необходимо, по мнению Р.Э. Амдия, выполнять уродинамическое исследование. Так, проведенное на базе Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова уродинамическое исследование среди пациентов с сохраняющейся дизурией после лечения хронического абактериального простатита показало, что нарушение функции нижних мочевых путей у 40% связано с гиперактивностью мочевого пузыря в чистом виде или в сочетании с другими функциональными нарушениями нижних мочевых путей, а также инфравезикальной обструкцией. С учетом выявленных изменений была назначена терапия. При гиперактивном мочевом пузыре – М-холинолитики (Везикар) (эффективность терапии – 97,5%). При сочетании гиперактивного мочевого пузыря и инфравезикальной обструкции – альфа-адреноблокаторы (Омник Окас) и М-холинолитики (Везикар) (эффективность – 95%). При гиперактивном мочевом пузыре в сочетании со снижением сократительной способности детрузора – тибиальная стимуляция (эффективность – 87%). Учитывая высокую эффективность проведенной терапии, можно предположить, что у достаточно большого количества больных с нарушением функции нижних мочевых путей наблюдается гипердиагностика хронического простатита.
Таким образом, при хроническом абактериальном простатите можно рекомендовать комбинированное применение антибиотиков, активных в отношении внутриклеточных возбудителей, препаратов, улучшающих кровоток, и альфа-адреноблокаторов. Тем пациентам, у которых эта терапия оказалась неэффективной, показано проведение уродинамического исследования, в зависимости от результатов которого им назначаются М-холинолитики или комбинация М-холинолитиков и альфа-адреноблокаторов.
Современные рекомендации и стандарты лечения ИППП и урогенитальных инфекций в практике врача-уролога
Прежде чем охарактеризовать современные методы диагностики и лечения ИППП, профессор Евгений Владиславович СОКОЛОВСКИЙ (д.м.н., Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова) представил результаты небольшого исследования. В нем оценивалось качество оказания медицинской помощи дерматовенерологами, акушерами-гинекологами и урологами в российских городах. Анализировались истории болезни пациентов кожно-венерологических диспансеров, женских консультаций, поликлиник, стационаров. Во всех учреждениях декларировалась хорошо работающая система внутриведомственного контроля. В результате наименьшее количество ошибок было выявлено при ведении пациентов с гонококковой инфекцией, обследование и лечение при которой регламентируется приказом Минздрава России. Наибольшее число нарушений наблюдалось при ведении пациентов с другими ИППП, по которым общероссийские рекомендации еще не утверждены, – хламидийной, микоплазменной инфекциями, трихомониазом, генитальным герпесом и кандидозом. Ошибки этапа диагностики выражались в нарушении алгоритма обследования пациентов – топический диагноз не устанавливался дерматовенерологами в 65%, урологами в 81%, акушерами-гинекологами в 17% случаев, что повлияло на правильность установления диагноза основного заболевания и, как следствие, на объем и продолжительность лечения.
Ошибки на этапе лечения складывались из многократного превышения доз антибактериальных препаратов, как разовых, так и курсовых. При лечении неосложненной хламидийной инфекции в 44% случаев пациенты получили два и в 35% – три курса антибактериальной терапии. Назначение лечения при выявлении Mycoplasma hominis, Ureaplasma spp. проводилось без учета показаний к проведению такой терапии, определенных в российских клинических рекомендациях1, и также сопровождалось назначением повторных курсов антибактериальной терапии: два курса получили 36% пациентов и три курса – 26% пациентов. При лечении урогенитального кандидоза подавляющему большинству пациентов проводилась системная терапия (61%) или комбинированное лечение (33%). Топические препараты были назначены только в 6% случаев для лечения пациентов с диагнозом «баланопостит». Отмечено злоупотребление иммунотропными препаратами при всех нозологиях и назначение местной терапии без показаний.
Профессор Е.В. Соколовский выразил надежду, что с утверждением Минздравом России федеральных рекомендаций, в которых охвачены все практические вопросы ведения пациентов с ИППП, ошибок в диагностике и лечении станет меньше. Пока же докладчик представил вниманию участников симпозиума наиболее важные аспекты диагностики и лечения пациентов с самыми распространенными ИППП.
Mycoplasma genitalium – абсолютный патоген, способный вызывать уретрит у лиц обоего пола и, согласно ограниченным данным, цервицит у женщин. На сегодняшний день не подтверждена и не опровергнута связь между инфицированием Mycoplasma genitalium и неблагоприятными исходами беременности (спонтанный аборт, преждевременные роды, замедление внутриутробного роста, мертворождение).
Верификация диагноза заболеваний, вызванных Mycoplasma genitalium, осуществляется с помощью молекулярно-биологических методов, направленных на обнаружение специфических фрагментов ДНК и/или РНК Mycoplasma genitalium, с использованием тест-систем, разрешенных к медицинскому применению в Российской Федерации. Другие методы лабораторных исследований (прямая иммунофлюоресценция, иммуноферментный анализ для обнаружения антител к Mycoplasma genitalium, культуральный метод) недопустимо использовать для диагностики заболеваний, вызванных Mycoplasma genitalium. С целью оценки степени лейкоцитарной реакции и состояния микробиоценоза уретры, влагалища, цервикального канала проводится микроскопическое исследование клинического материала. С позиций доказательной медицины применение биологических, химических и алиментарных провокаций с целью повышения эффективности диагностики заболеваний, вызванных Mycoplasma genitalium, нецелесообразно.
Показания к обследованию на Mycoplasma genitalium включают:
- клинические и/или лабораторные признаки воспалительного процесса органов урогенитального тракта;
- прегравидарное обследование половых партнеров;
- обследование женщин во время беременности;
- предстоящие оперативные (инвазивные) манипуляции на органах малого таза;
- перинатальные потери и бесплодие в анамнезе;
- половой контакт с инфицированным партнером (в период до 60 дней);
- сексуальное насилие (в период до 60 дней).
Показанием к проведению лечения является выделение этого микроорганизма, причем необходимо одновременное лечение двух партнеров. При этом лечением ИППП должны заниматься дерматовенерологи с привлечением для консультации акушеров-гинекологов и урологов (при беременности, вовлечении в воспалительный процесс органов малого таза, с целью диагностики возможных осложнений со стороны репродуктивной системы, при длительном течении и неэффективности ранее проводимой терапии эпидидимита, эпидидимоорхита, простатита).
На сегодняшний день самые серьезные опасения вызывает проблема резистентности Mycoplasma genitalium к антибактериальным препаратам. Так, если в 1992 г. была показана высокая эффективность тетрациклинов и макролидов6, то уже в 2003 г. не отвечали на терапию доксициклином до 71% пациентов7. При этом сохранялась высокая эффективность терапии азитромицином в дозе 1 г однократно. Однако уже в 2006 г. появились работы о неудачах применения азитромицина при микоплазменных уретритах8. Данные in vitro также подтвердили снижение чувствительности к макролидам9. Это явилось следствием генетической мутации, индуцированной собственно применением азитромицина 1 г однократно. Было показано, что именно такой вариант назначения способствует появлению резистентных штаммов уже после первого применения.
В 2009 г. появилось сообщение российских ученых о связи высокой бактериальной нагрузки с неэффективностью антибактериальной терапии10. Затем эти работы получили развитие за рубежом. В них говорится о том, что лечение короткими курсами антибиотиков возможно лишь при низкой бактериальной нагрузке, а при высокой нагрузке такие курсы оказываются неэффективными и создают условия для селекции мутантных штаммов11. Однако определить величину бактериальной нагрузки в условиях практического здравоохранения почти невозможно.
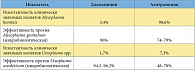
В 2014 г. появилась серьезная публикация, в которой был обоснован отказ от методики однократного назначения азитромицина в пользу более продолжительных курсов антибактериальной терапии12. Кроме того, во многих работах была продемонстрирована более высокая эффективность джозамицина по сравнению с азитромицином (табл. 2)13. Было показано, что джозамицин – единственный макролид для лечения урогенитальных инфекций с универсальной эффективностью как в отношении хламидий, так и всех клинически значимых видов микоплазм, который можно использовать в том числе у беременных и детей.
Установление излеченности заболеваний, вызванных Mycoplasma genitalium, на основании методов амплификации РНК (NASBA) проводится через 14 дней после окончания лечения, на основании методов амплификации ДНК (ПЦР, ПЦР в реальном времени) – не ранее чем через месяц после окончания лечения. При отрицательных результатах обследования пациенты дальнейшему наблюдению не подлежат.
Далее профессор Е.В. Соколовский рассмотрел вопросы лечения урогенитальных заболеваний, вызванных Ureaplasma spp. и Mycoplasma hominis. Это условно-патогенные микроорганизмы, реализация патогенных свойств которых происходит при определенных условиях. Уреаплазмы способны вызывать уретрит у мужчин (Ureaplasma urealyticum) и, вероятно, цервицит, цистит, воспалительные заболевания органов малого таза, а также осложнения течения беременности, послеродовые и послеабортные осложнения у женщин.
C момента идентификации двух разных биоваров Ureaplasma urealyticum (Ureaplasma parvum и Ureaplasma urealyticum) обнаружено, что Ureaplasma urealyticum достоверно чаще встречается при урогенитальных инфекциях с клиническими проявлениями, чем Ureaplasma parvum. При изучении влияния Mycoplasma hominis на состояние сперматогенеза (подвижность сперматозоидов, плотность спермы, морфология) у 234 пациентов установлено, что, несмотря на высокую (13,3%) частоту обнаружения этих микроорганизмов, они не оказывают отрицательного влияния на характеристики спермы, а следовательно, и на фертильность мужчин. В отношении Ureaplasma urealyticum существуют доказательства того, что этот возбудитель повышает риск развития мужского бесплодия, нарушая целостность мембраны сперматозоидов14. В то же время, согласно результатам других исследований, микроорганизмы Ureaplasma spp. и Mycoplasma hominis могут обнаруживаться в нижних отделах урогенитального тракта у 30–40% здоровых сексуально активных молодых людей15.
Показанием к обследованию на Ureaplasma spp. и Mycoplasma hominis является наличие клинико-лабораторных признаков воспалительного процесса в области урогенитального тракта при отсутствии патогенных возбудителей ИППП. При субклиническом процессе обследованию подлежат пациенты с диагнозом «бесплодие», пациентки, имеющие в анамнезе невынашивание беременности и перинатальные потери, доноры спермы.
Верификация диагноза заболеваний, вызванных Ureaplasma spp. и Mycoplasma hominis, базируется на результатах лабораторных исследований с помощью:
- микроскопического исследования клинического материала из уретры, влагалища и цервикального канала, которое проводится с целью оценки состояния эпителия уретры, влагалища, цервикального канала;
- степени лейкоцитарной реакции;
- исключения сопутствующих ИППП (гонококковая инфекция, урогенитальный трихомониаз);
- оценки состояния микробиоценоза влагалища;
- молекулярно-биологических методов, направленных на обнаружение специфических фрагментов ДНК и/или РНК Ureaplasma spp. и Mycoplasma hominis, с использованием тест-систем, разрешенных к медицинскому применению в России;
- культурального исследования.
Целесообразность применения методики количественного определения, как и клиническое значение полученных результатов, убедительно не доказаны.
Другие методы лабораторных исследований, в том числе прямую иммунофлюоресценцию, иммуноферментный анализ, использовать для диагностики заболеваний, вызванных Ureaplasma spp. и Mycoplasma hominis, недопустимо. С позиций доказательной медицины применение биологических, химических и алиментарных провокаций с целью повышения эффективности диагностики заболеваний, вызванных Ureaplasma spp. и Mycoplasma hominis, нецелесообразно.
Учитывая высокую распространенность микоплазм в нижних отделах мочеполовой системы у практически здоровых лиц репродуктивного возраста, а также неуточненность их истинного этиологического значения, проведение скринингового обследования на генитальные микоплазмы нецелесообразно.
Определение чувствительности к антибиотикам следует проводить только при неэффективности терапии и рецидивировании процесса.
Показанием к лечению при выявлении Mycoplasma hominis и Ureaplasma spp. является наличие клинико-лабораторных признаков инфекционно-воспалительного процесса, при котором не выявлены другие возбудители ИППП, в том числе Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis. При отсутствии клинических признаков воспалительного процесса – выявление Mycoplasma hominis и/или Ureaplasma spp. у доноров спермы, лиц с диагнозом «бесплодие» и женщин с невынашиванием беременности и перинатальными потерями в анамнезе. Половые партнеры лиц, инфицированных Mycoplasma hominis и/или Ureaplasma spp., подлежат лечению при наличии у них клинической симптоматики и лабораторных признаков воспалительного процесса мочеполовых органов (при исключении иной этиологии данного воспалительного процесса).
Наиболее эффективным препаратом для лечения инфекционных процессов, вызванных Mycoplasma hominis и/или Ureaplasma spp., как и в случае с Mycoplasma genitalium, является джозамицин. Контроль излеченности осуществляется аналогично описанному для Mycoplasma genitalium.
Симптомы нижних мочевых путей у мужчин. Роль уроселективности в выборе медикаментозной терапии
Известно, что все симптомы нижних мочевых путей (СНМП) подразделяются на симптомы накопления (поллакиурия, ургентность, никтурия, недержание мочи), симптомы опорожнения (слабая струя мочи, натуживание при мочеиспускании, прерывистость мочеиспускания, разбрызгивание струи мочи, отсроченное мочеиспускание) и постмикционные симптомы (ощущение неполного опорожнения мочевого пузыря). По данным Заиды Камалудиновны ГАДЖИЕВОЙ (д.м.н., Первый Московский государственный медицинский университет), у 49% мужчин встречается комбинация различных симптомов, а у 29% мужчин с доброкачественной гиперплазией предстательной железы СНМП отсутствуют.
В патогенезе расстройств мочеиспускания играют роль органический и динамический компоненты: инфравезикальная обструкция, ишемия детрузора, изменение его мышцы и нейрональные факторы (центральные и периферические). Провоцировать расстройства мочеиспускания могут возрастные, гормональные, воспалительные, наследственные, нейрогенные, анатомические факторы. По причине многофакторности с 2011 г. группа экспертов, которая формирует европейские клинические рекомендации, изменила их название на «Консервативное лечение ненейрогенных расстройств мочеиспускания у мужчин, включая инфравезикальную обструкцию»16. Это было сделано в связи с тем, что пациенты обращаются за медицинской помощью именно по поводу СНМП, а не доброкачественной гиперплазии предстательной железы.
Для лечения СНМП у мужчин применяют альфа-адреноблокаторы, ингибиторы 5-альфа-редуктазы, антимускариновые препараты, аналоги вазопрессина и ингибиторы фосфодиэстеразы 5-го типа. Выбирая тот или иной препарат, следует ориентироваться на необходимость достижения баланса между эффективностью и переносимостью средства с целью соблюдения терапевтического эффекта и возможности длительной терапии.
Препаратами первого ряда для лечения мужчин с СНМП являются альфа-адреноблокаторы. На сегодняшний день показано, что эти препараты снижают общий балл по шкале IPSS на 35–40% и повышают максимальную скорость потока мочи на 20–25% независимо от размеров предстательной железы. Причем эффект от их применения наступает достаточно быстро и сохраняется при длительном применении. Из побочных эффектов следует отметить возможность снижения артериального давления и ретроградную эякуляцию. Альфа-адреноблокаторы можно применять не только для устранения СНМП, но и для профилактики острой задержки мочеиспускания. Российские ученые установили: назначение альфа-адреноблокаторов пациентам, которым предстояло оперативное лечение по различным причинам (не только по урологическим), снижало риск данного осложнения. Так, у больных, получавших альфа-адреноблокаторы, острая задержка мочеиспускания в послеоперационном периоде развилась всего лишь в 2,3% случаев, у не получавших – в 17% случаев17.
При выборе того или иного альфа-адреноблокатора важную роль играет селективность препарата в отношении альфа-1А/альфа-1В-рецепторов, что обеспечивает наименьшее влияние на сердечно-сосудистую систему. На сегодняшний день самыми селективными в отношении альфа-1А-рецепторов являются тамсулозин и силодозин. Несмотря на то что сродство силодозина к альфа-1А-рецепторам превышает сродство к альфа-1В-рецепторам в 162 раза и выше сродства тамсулозина в восемь раз, достоверной разницы в их эффективности по параметрам шкалы IPSS выявлено не было18. Однако на фоне применения силодозина по сравнению с тамсулозином была зарегистрирована высокая частота развития побочных эффектов, и в первую очередь ретроградной эякуляции (12,5 и 1,1% соответственно)19.
Что касается пожилых пациентов с доброкачественной гиперплазией предстательной железы и артериальной гипертонией, то, казалась бы, привлекательная перспектива использовать один препарат (неселективный альфа-адреноблокатор) для лечения двух заболеваний одновременно себя не оправдала. В исследовании ALLHAT (Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) было показано, что подобный подход повышает риск сердечно-сосудистых осложнений – «комбинированного» кардиоваскулярного осложнения – на 25%, число случаев сердечной недостаточности – в два раза, относительный риск инсульта – на 20%, число случаев стенокардии – на 15%20. Следовательно, для таких пациентов необходимо сначала подобрать гипотензивную терапию, а затем использовать селективный альфа-адреноблокатор.
Ингибиторы 5-альфа-редуктазы показаны пациентам с размерами предстательной железы более 40 см³, уровнем простатического специфического антигена более 1,4 нг/мл, при высоком риске прогрессирования заболевания, для того чтобы избежать хирургического вмешательства и снизить риск острой задержки мочи. При этом следует помнить о том, что контроль за уровнем простатического специфического антигена должен осуществляться через шесть месяцев, поскольку ингибиторы 5-альфа-редуктазы снижают уровень простатического специфического антигена на 50%.
Согласно рекомендациям Европейской ассоциации урологов в случае преобладания у пациента симптомов опорожнения и отсутствия эффекта от монотерапии альфа-адреноблокаторами показана комбинированная терапия альфа-блокаторами и ингибиторами 5-альфа-редуктазы16. Если данная терапия оказывается также неэффективной, целесообразно проведение уродинамического исследования для подтверждения или исключения инфравезикальной обструкции.
Сочетание гиперактивного мочевого пузыря с инфравезикальной обструкцией встречается в 30–60% случаев, а у мужчин с инфравезикальной обструкцией, обусловленной доброкачественной гиперплазией предстательной железы, – до 80% случаев. Более того, до 38% мужчин в послеоперационном периоде продолжают предъявлять жалобы на ирритативную симптоматику, характерную для гиперактивного мочевого пузыря. Это подтверждают данные очень интересного исследования, в котором на протяжении 13 лет проводилось наблюдение за пациентами, оперированными по поводу инфравезикальной обструкции21. Через 13 лет симптомы гиперактивного мочевого пузыря возобновились у 64% больных.
«По нашим данным, – заметила З.К. Гаджиева, – гиперактивность мочевого пузыря выявлялась почти у 47% больных, оперированных по поводу инфравезикальной обструкции22. У 12,5% больных функциональный компонент инфравезикальной обструкции сохраняется в послеоперационном периоде, что заставляло продолжать терапию альфа-адреноблокаторами».
Согласно клиническим рекомендациям при наличии только симптомов наполнения показана монотерапия М-холиноблокаторами16. В случае преобладания симптомов наполнения рекомендовано комбинированное применение альфа-адреноблокаторов и М-холиноблокаторов под контролем остаточной мочи. Как и альфа-адреноблокаторы, М-холиноблокаторы различаются по степени селективности в отношении мочевого пузыря. На сегодняшний день самым селективным является солифенацин. Его селективность превосходит селективность оксибутинина в шесть раз, а толтеродина – в два с половиной раза23. В результате снижается риск развития побочных эффектов (в первую очередь сухости во рту) и появляется возможность для длительной терапии, что повышает эффективность лечения.
Кому показана комбинация «альфа-адреноблокатор и М-холинолитик»? Мужчинам с сочетанием инфравезикальной обструкции и персистирующими симптомами гиперактивности мочевого пузыря и низким риском возникновения острой задержки мочеиспускания. Сочетанное использование альфа-адреноблокатора и М-холиноблокатора в лечении больных с гиперактивным мочевым пузырем в сочетании с доброкачественной гиперплазией предстательной железы является более эффективным, поскольку направлено одновременно на детрузорную гиперактивность и динамический компонент инфравезикальной обструкции, которая в свою очередь может быть и причиной, и фактором поддержания гиперактивности мочевого пузыря. Комбинированная терапия «тамсулозин 0,4 мг + солифенацин 6 мг» показала значимо лучший результат лечения в сравнении с плацебо, была более эффективна в сравнении с селективным использованием тамсулозина 0,4 мг в отношении симптомов наполнения и качества жизни у мужчин с СНМП (симптомы наполнения + симптомы опорожнения)24.
В скором времени на российском рынке должен появиться комбинированный препарат, содержащий тамсулозин и солифенацин, что повысит комплаентность терапии. Кроме того, проходит клинические испытания препарат из группы бета-адреномиметиков (мирабегрон), который не влияет на парасимпатическую систему, а следовательно, и на сократительную способность мочевого пузыря, что снижает или полностью устраняет риск задержки мочеиспускания.
Одной из последних рекомендаций лечения пациентов с СНМП и эректильной дисфункцией является комбинированное применение ингибиторов фосфодиэстеразы 5-го типа и альфа-адреноблокаторов.
Новые данные о патогенезе СНМП, понимание многофакторности симптомов, появление на рынке новых препаратов и возможность сочетанного их применения привели к тому, что «бум малоинвазивных вмешательств», пришедшийся на 1990-е гг., постепенно сходит на нет. И, по данным З.К. Гаджиевой, частота трансуретральной резекции простаты снизилась за последние годы в два с половиной раза.
Заключение
В рамках симпозиума была представлена точка зрения отечественной урологической школы на проблему хронического простатита. Отмечалось, что для лечения хронического бактериального простатита препаратами выбора являются фторхинолоны. При хроническом абактериальном простатите применяются антибиотики, активные в отношении внутриклеточных инфекций, такие как джозамицин (Вильпрафен) и доксициклина моногидрат (Юнидокс Солютаб), препараты, улучшающие кровоток, и альфа-адреноблокаторы – тамсулозин с модифицированным высвобождением (Омник Окас). Тем пациентам, у которых эта терапия оказалась неэффективной, рекомендуется проведение уродинамического исследования, в зависимости от результатов которого им показаны М-холинолитики (солифенацин – Везикар) или комбинация М-холинолитиков и альфа-адреноблокаторов.
Препаратами для лечения СНМП являются альфа-адреноблокаторы, ингибиторы 5-альфа-редуктазы, антимускариновые препараты, аналоги вазопрессина и ингибиторы фосфодиэстеразы 5-го типа. Выбирая то или иное лекарственное средство, следует ориентироваться на необходимость достижения баланса между эффективностью и переносимостью. Так, при выборе альфа-адреноблокатора важную роль играет селективность препарата в отношении альфа-1А/альфа-1В-рецепторов. Наиболее уроселективными являются тамсулозин и силодозин, но при сходной клинической эффективности силодозин вызывает большее число нежелательных явлений. Как и альфа-адреноблокаторы, М-холиноблокаторы различаются по степени селективности в отношении мочевого пузыря. На сегодняшний день самым селективным является солифенацин (Везикар). Его применение снижает риск развития побочных эффектов (в первую очередь сухости во рту) и предоставляет возможность длительной терапии, что повышает эффективность лечения.
Подчеркивалась необходимость придерживаться клинических рекомендаций в отношении ведения пациентов с ИППП и урогенитальными инфекциями во избежание гипердиагностики и назначения неадекватного лечения. Так, международные и отечественные рекомендации отдают приоритет в терапии инфекций, вызванных Mycoplasma hominis и/или Ureaplasma spp., Mycoplasma genitalium, джозамицину (Вильпрафен) и доксициклина моногидрату (Юнидокс Солютаб).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


