Подногтевая меланома
- Аннотация
- Статья
- Ссылки
- English

Актуальность исследования
Подногтевая меланома (ПМ) – редкое заболевание, которое, по данным доступной нам литературы, практически не изучалось в России, а за рубежом представлено ограниченным числом публикаций [1–3]. Ежегодно в мире регистрируют около 2 млн больных онкологическими заболеваниями кожи. Среди этих заболеваний на долю меланомы приходится только 3–5%. Между тем именно эта опухоль характеризуется агрессивным течением и является главной причиной смерти больных онкологическими заболеваниями кожи [1, 3, 4]. Среднегодовой темп прироста заболеваемости населения меланомой в мире составляет около 5% и считается одним из самых высоких среди злокачественных новообразований всех локализаций, уступая только раку легкого [1]. В Российской Федерации заболеваемость меланомой кожи с 2000 по 2010 г. увеличилась с 3,18 до 3,95 случая на 100 тыс. населения. Среднегодовой темп прироста составил 1,99%, а общий прирост заболеваемости – 21,81% [1]. Примечательно, что показатели заболеваемости продолжают увеличиваться не только среди лиц европеоидной расы, но и среди лиц других рас [5–7].
Как известно, своевременная ранняя диагностика меланомы и ее адекватное лечение позволяют добиться стойкого излечения в 90% случаев [6, 8]. Несмотря на то что меланома кожи считается визуальной опухолью, более трети больных обращаются к онкологам на поздних стадиях заболевания [9, 10]. Разнообразие анатомических локализаций первичных заболеваний меланомой кожи, их клинико-морфологические и биологические особенности, агрессивность течения затрудняют морфологическую диагностику. Одним из клинико-морфологических типов заболевания является акрально-лентигинозная меланома (АЛМ), возникающая на коже пальцев, межпальцевых промежутков, подошв, ладоней и ногтевого ложа [9, 11]. Однако эти локализации могут быть представлены и другими морфологическими типами меланом [11]. Особое место в структуре АЛМ занимает подногтевая меланома (ПМ) [3, 11].
Диагноз ПМ на поздних стадиях сложностей не вызывает. Диагностика на ранних стадиях весьма затруднительна. В большинстве случаев ПМ требует дифференциации с грибковым поражением ногтевого ложа (онихомикозом), панарицием, подногтевой и подэпидермальной гематомой, бородавкой, кавернозной тромбированной гемангиомой, невусом [6, 8].
Специфика локализации опухолевого процесса и его скрытость на первой стадии затрудняют визуализацию новообразования самим пациентом. Поэтому диагноз ПМ зачастую устанавливают уже на этапе вертикального разрастания и начала распространения метастазов [9, 10].
Согласно данным литературы, ПМ – редкое онкологическое заболевание с неудовлетворительным прогнозом. Следует признать, что из-за незначительного количества пациентов и отсутствия данных рандомизированных исследований до сих пор отсутствуют стандарты диагностики, хирургического лечения и рекомендаций по лекарственному лечению такого агрессивно протекающего злокачественного новообразования. Сегодня для пациентов с начальной стадией ПМ золотым стандартом признано радикальное удаление первичной опухоли с биопсией сигнальных лимфатических узлов [10, 12]. На поздних стадиях заболевания радикальная операция существенно не улучшает показатели общей и безрецидивной заболеваемости. Прогноз главным образом зависит от ранней диагностики, а также радикальности хирургического лечения и своевременности лекарственной терапии. Требуют разработки комплексные методы лечения больных ПМ [13].
Таким образом, все аспекты, касающиеся как своевременной диагностики, так и клинического течения, прогноза и эффективности лечения ПМ, представляются актуальными для проведения комплексного исследования с целью оптимизации лечения больных ПМ.
Материал и методы исследования
В настоящем исследовании проанализирована база данных НИИ онкологии им. Н.Н. Петрова, включающая информацию о 445 больных меланомой кожи верхних и нижних конечностей, среди которых 40 пациентов с морфологически подтвержденным диагнозом «подногтевая меланома» радикально прооперированы. Изучен архивный материал лаборатории патологической анатомии НИИ онкологии им. Н.Н. Петрова. Отдаленные результаты лечения проанализированы с помощью множительных оценок Каплана – Мейера, позволяющих проводить актуриальный расчет выживаемости, то есть учитывать возможное дожитие больных, выбывших из-под наблюдения в течение контрольного пятилетнего срока. Сравнительный анализ отдаленных результатов лечения проведен с группой из 405 больных первичной меланомой кожи конечностей. Распределение больных по половозрастным и морфологическим характеристикам опухоли и стадии было идентичным.
Результаты и их обсуждение
Средний возраст больных на момент установления диагноза составил 56 лет (от 29 до 79 лет). В анализируемой группе больных насчитывалось 30 (75%) женщин и 10 (25%) мужчин, соотношение 3:1. При этом существенных возрастных различий между группами мужчин и женщин в целом не выявлено (р > 0,05). Большинство пациентов с ПМ (n = 19) были в возрасте старше 70 лет. По этнической принадлежности больные (100%) относились к европеоидной расе.
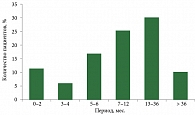
В 30% случаев пациенты обращались к врачу спустя 12 месяцев и более после появления первых симптомов заболевания (рис. 1).
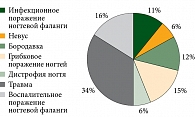
Причины несвоевременного установления диагноза были разными: ошибочный диагноз поражения ногтевой фаланги воспалительной природы (абсцесс, панариций), грибковое поражение ногтей (онихомикоз), дистрофия ногтей, невус, бородавки и, наконец, изменения ногтевой фаланги после травмы. У четырех пациентов имело место нерадикальное хирургическое удаление подногтевого образования. В то же время после обращения к врачам по поводу других заболеваний 16% пациентов были направлены в специализированное учреждение из-за подозрения на онкологический характер заболеваний (рис. 2).
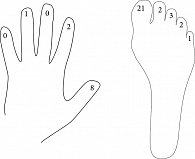
Первичная опухоль на пальцах ног локализовалась чаще (n = 29), чем на пальцах рук (n = 11). В большинстве случаев отмечалось поражение больших пальцев стоп и кистей (рис. 3).
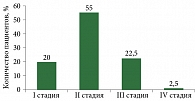
Распределение больных по стадиям, выполненное на основании последней версии издания руководства по стадированию злокачественных новообразований Объединенного американского комитета по раку (American Joint Committee on Cancer – AJCC, 2009, 7-е издание), представлено на рис. 4. Удельный вес больных II и III стадий достиг 55 (n = 22) и 22,5% (n = 9) соответственно, в то время как удельный вес больных I стадии составил 20 (n = 8) и IV стадии – 2,5% (n = 1). В десяти случаях выявлено метастатическое поражение пахово-бедренных лимфоузлов, в двух – внутрикожные метастазы в области межпальцевого промежутка на стопе.
Всем 40 больным проводилось хирургическое лечение первичной опухоли. Наиболее частым видом хирургической операции была ампутация на разном уровне фаланг пальцев (18 или 45%), а также экзартикуляция всего пальца в плюсне-(пястно)фаланговом суставе (13 или 32,5%). Значительно реже выполнялись экзартикуляция на уровне проксимальной и средней фаланг (7 или 17,5%) и плоскостная резекция плюсны (2 или 5%). Уровень ампутации пальца у 12 (30%) больных приходился на среднюю треть проксимальной фаланги, у шести (15%) – на среднюю треть средней фаланги.
При изучении влияния объема хирургической операции на отдаленные результаты лечения ПМ выяснилось, что более благоприятный прогноз имел место при выполнении ампутации на уровне средней трети средней фаланги пальца.
Сравнительный анализ результатов пятилетней выживаемости пациентов при выполнении ампутации на уровне средней трети средней фаланги пальца или экзартикуляции всего пальца в плюсне-(пястно)фаланговом суставе статистически достоверных различий не показал (52 (медиана 72 ± 20 месяца) против 29% (медиана 41 ± 4 месяца), р = 0,4). Это дает основание рекомендовать ампутацию на уровне средней трети средней фаланги пальца как операцию выбора при ПМ. Выполнение этой операции максимизирует функциональную способность конечности и тем самым улучшает качество жизни пациентов.
Во всех операциях после удаления первичной опухоли пластика раневого дефекта осуществлялась местными тканями. Десяти пациентам, у которых при первичной госпитализации выявлены регионарные метастазы в лимфоузлы, выполнена аксиллярная (2 или 20%), пахово-бедренная (5 или 50%) и подвздошно-пахово-бедренная лимфаденэктомия (3 или 30%). Профилактическая аксиллярная лимфаденэктомия проведена только у одного (2,5%) больного через две недели после радикального хирургического лечения ПМ. Однако гистологическое исследование не выявило метастатического поражения лимфоузлов. Адъювантная иммунная терапия назначалась только в случае метастатического поражения регионарных лимфоузлов по данным гистологического исследования операционного материала.
Гистологические типы ПМ были распределены следующим образом: 26 (65%) случаев – акрально-лентигинозная меланома, семь (17,5%) случаев – узловая меланома, пять (12,5%) случаев – лентиго-меланома, два (5%) случая – поверхностно-распространяющаяся меланома.
Толщина опухоли по Бреслоу варьировалась от 0,2 до 40 мм (в среднем 5,5 мм). При анализе распространения опухоли в интервале 1 мм наиболее часто встречалась толщина опухоли по Бреслоу от 1,01 до 2,00 мм (рис. 5).
Уровень инвазии опухоли по Кларку в большинстве случаев (55%) был IV. В шести случаях имело место поражение кости ногтевой фаланги, расцененное как V уровень инвазии опухоли (таблица).
У 21 (52,5%) больного наблюдался эпителиоидный клеточный тип опухоли, у 14 (35%) – смешанно-клеточный. Изъязвление эпидермиса зафиксировано у 27 (67,5%) больных. Отсутствие пигмента или наличие минимального количества в ПМ зарегистрировано в 17 (42,5%) и 14 (35%) случаях соответственно. Средняя митотическая активность составила 30 митозов на 3 мм². Лимфоидная инфильтрация по степени выраженности в опухоли распределилась в следующем порядке: выраженная – семь (17,5%) больных, умеренно выраженная – 14 (35%), слабо выраженная – 19 (47,5%) пациентов. Только в одном случае (2,5%) выявлена частичная спонтанная регрессия ПМ.
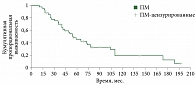
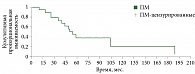
Показатель пятилетней общей выживаемости больных ПМ безотносительно стадии составил 47%. При этом десятилетний рубеж пережили 20% больных. Медиана общей выживаемости составила 55 ± 9,4 месяца (95%-ный доверительный интервал (ДИ) 36,4–73,5) (рис. 6).
Показатель пятилетней опухоль-специфической выживаемости (ОСВ) больных ПМ безотносительно стадии составил 37%. При этом десятилетний рубеж пережили 18% больных. Медиана ОСВ составила 50 ± 6,6 месяца (95% ДИ 36,8–63,1) (рис. 7).
Показатель пятилетней безрецидивной выживаемости больных ПМ безотносительно стадии составил 40%. Медиана безрецидивной выживаемости достигла 50 ± 8,1 месяца (95% ДИ 34,0–65,9) (рис. 8).
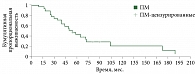
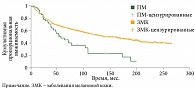
При изучении отдаленных результатов лечения ПМ проведен сравнительный анализ с группой из 405 больных меланомой кожи верхних и нижних конечностей. В группе сравнения показатель пятилетней общей выживаемости безотносительно стадии достиг 70%, при ПМ – 47% (p = 0,0001) (рис. 9).
Заключение
Большинство больных ПМ обращались к врачу через 12 месяцев и более после появления первых симптомов заболевания, то есть на поздней стадии заболевания. В большинстве случаев заболевание диагностировано на II и III стадиях. Более половины пациентов имели уровень инвазии по Кларку IV и V. Среднее значение толщины опухоли по Бреслоу составило 5,5 мм. Клинического обследования в сочетании с тонкоигольной аспирационной биопсией или трепан-биопсией обычно бывает достаточно для адекватной постановки диагноза. Дифференциальная диагностика ПМ осложняется клинической картиной, схожей в первую очередь с воспалительными заболеваниями и грибковыми поражениями ногтевой фаланги. Операцией выбора при локализованной ПМ является ампутация на уровне средней трети средней фаланги пальца. Выполнение этой операции максимизирует функциональную способность конечности и тем самым улучшает качество жизни пациента. У пациентов с ПМ имеет место худший прогноз заболевания по сравнению с больными меланомой кожи верхних и нижних конечностей (p = 0,0001).
M.Yu. Myasnyankin, G.I. Gafton, V.V. Anisimov, D.Ye. Matsko, A.O. Ivantsov, Yu.V. Semiletova, I.G. Gafton
N.N. Petrov Research Institute of Oncology, Saint-Petersburg
Contact person: Mikhail Yuryevich Myasnyankin, oncologmisha@gmail.com
In the current study, there were analyzed 445 patients with skin melanoma of the upper and lower limbs, who were treated during 1986–2015 at the N.N. Petrov Research Institute of Oncology. Among them, 40 patients after radical surgery were selected with morphologically confirmed diagnosis subungual melanoma (SM). Significant duration of anamnesis (mainly, one – three years), location of melanoma mainly on the fingers of lower limbs (75.5%), preferentially affecting nail bone of big toe (72.5%), acral-lentiginous type of melanoma (65%), Clark Level IV invasion (57.5%), and average Breslow thickness = 5.5 mm were the most important clinical and morphological features of SM. Relative percentage of patients with stage II and III SM was 55 (n = 22) and 22.5% (n = 9), respectively, whereas with stage I – 20 (n = 8) and IV – 2.5% (n = 1). Based on the data obtained it was concluded that operation of choice for patients with SM is amputation at the middle third of the middle phalanx. It turned out that therapeutic results were rather low: 5-year survival was – 47%, 10-year survival – 20%. Compared to patients with skin melanoma of the upper and lower limbs, patients with SM have the poorest prognosis (p = 0.0001).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.