Роль факторов иммуносупрессии в прогнозе эффективности клеточной иммунотерапии у пациентов с солидными опухолями
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить эффективность клеточной иммунотерапии аутологичными опухолевыми клетками, модифицированными геном tag7/PGRP-S (ГМВ), и активированными дендритными клетками (ДКВ) распространенных и метастатических форм меланомы, рака почки, саркомы мягких тканей, проанализировав продуцирование опухолевыми клетками иммуносупрессивных факторов.
Материал и методы. С 2001 по 2016 г. 204 пациента получали клеточную иммунотерапию, в частности 88 – ГМВ, 116 – ДКВ.
У 88 пациентов (меланома кожи (n = 71), рак почки (n = 6), саркома мягких тканей (n = 11)) с помощью иммуноферментного анализа в культурах опухолевых клеток определены концентрации иммуносупрессивных факторов, таких как MICA, TGF-β, интерлейкин 10 и VEGF. Средний возраст больных составил 51 год.
Для анализа различий по иммуносупрессивным факторам больных в зависимости от эффективности терапии классифицировали на пациентов с достаточным или недостаточным эффектом.
Результаты. Концентрация иммуносупрессивных факторов в супернатантах опухолевых клеток пациентов с недостаточным эффектом терапии была статистически значимо выше (р < 0,05). Точность прогнозирования достаточного эффекта лечения по уровням иммуносупрессивных факторов составила 74,4%. При этом наиболее значимым фактором был TGF-β1. При использовании многофакторной модели Кокса концентрации TGF-β1 и MICA оказались независимыми значимыми факторами прогноза общей выживаемости пациентов с меланомой кожи (р < 0,05). Концентрации VEGF были наиболее значимы при анализе времени до прогрессирования заболевания. С помощью ранговых корреляций Спирмена подтверждено наличие умеренной связи между иммуносупрессивными факторами (р < 0,05).
Выводы. Cодержание иммуносупрессивных факторов в супернатантах культур опухолевых клеток больных служит независимым фактором прогноза общей выживаемости и времени до прогрессирования. Полученные результаты обусловливают необходимость создания жестких критериев отбора пациентов для клеточной иммунотерапии с учетом биологических характеристик опухоли.
Цель исследования – оценить эффективность клеточной иммунотерапии аутологичными опухолевыми клетками, модифицированными геном tag7/PGRP-S (ГМВ), и активированными дендритными клетками (ДКВ) распространенных и метастатических форм меланомы, рака почки, саркомы мягких тканей, проанализировав продуцирование опухолевыми клетками иммуносупрессивных факторов.
Материал и методы. С 2001 по 2016 г. 204 пациента получали клеточную иммунотерапию, в частности 88 – ГМВ, 116 – ДКВ.
У 88 пациентов (меланома кожи (n = 71), рак почки (n = 6), саркома мягких тканей (n = 11)) с помощью иммуноферментного анализа в культурах опухолевых клеток определены концентрации иммуносупрессивных факторов, таких как MICA, TGF-β, интерлейкин 10 и VEGF. Средний возраст больных составил 51 год.
Для анализа различий по иммуносупрессивным факторам больных в зависимости от эффективности терапии классифицировали на пациентов с достаточным или недостаточным эффектом.
Результаты. Концентрация иммуносупрессивных факторов в супернатантах опухолевых клеток пациентов с недостаточным эффектом терапии была статистически значимо выше (р < 0,05). Точность прогнозирования достаточного эффекта лечения по уровням иммуносупрессивных факторов составила 74,4%. При этом наиболее значимым фактором был TGF-β1. При использовании многофакторной модели Кокса концентрации TGF-β1 и MICA оказались независимыми значимыми факторами прогноза общей выживаемости пациентов с меланомой кожи (р < 0,05). Концентрации VEGF были наиболее значимы при анализе времени до прогрессирования заболевания. С помощью ранговых корреляций Спирмена подтверждено наличие умеренной связи между иммуносупрессивными факторами (р < 0,05).
Выводы. Cодержание иммуносупрессивных факторов в супернатантах культур опухолевых клеток больных служит независимым фактором прогноза общей выживаемости и времени до прогрессирования. Полученные результаты обусловливают необходимость создания жестких критериев отбора пациентов для клеточной иммунотерапии с учетом биологических характеристик опухоли.




Введение
Изучение возможностей применения противоопухолевых клеточных вакцин началось задолго до появления таргетной терапии и терапии ингибиторами контрольных точек иммунной системы. Во многих исследованиях был получен отрицательный результат. В частности, в ряде клинических исследований фазы III не наблюдалось клинической эффективности клеточных вакцин разных типов [1–3]. В то же время ранее сообщалось об успешном применении аутологичной дендритноклеточной вакцины (ДКВ) при кастрационно-резистентном раке предстательной железы. Так, на фоне терапии увеличилась общая выживаемость пациентов с кастрационно-резистентной аденокарциномой предстательной железы. Полученные данные послужили основанием для одобрения экспертами Управления по контролю качества пищевых продуктов и лекарственных средств США указанной вакцины [4]. В настоящее время проходят клинические исследования фазы III ДКВ, зарегистрированной для лечения пациентов с глиобластомой [5, 6]. Именно поэтому разработка новых подходов к оценке клинической эффективности указанной вакцины весьма актуальна.
Установлено, что именно биологические особенности опухоли и ее микроокружения определяют гетерогенность иммунологического ответа на опухолевые антигены, неодинаковую чувствительность опухолевых клеток к действию клеток-киллеров, различия в интенсивности ингибирующего влияния опухоли на иммунокомпетентные клетки и, как следствие, разную чувствительность к иммуно-, химио- и лучевой терапии [7, 8]. Однако до сих пор нет ясного понимания механизма роста опухоли в аспекте взаимодействия с компонентами иммунной системы. Одним из таких механизмов считается продуцирование опухолевыми клетками факторов, которые высвобождаются в микроокружение опухоли и оказывают широкий спектр иммуносупрессивных эффектов. Речь, в частности, идет о лиганде активационного рецептора Т- и NK-клеток MICA, трансформирующем факторе роста β (TGF-β), интерлейкине (ИЛ) 10, сосудистом эндотелиальном факторе роста (VEGF) [9, 10]. Известно также, что баланс между иммуногенностью и иммуносупрессией – ключевой фактор иммунотерапевтического ответа [11].
Крайне важно до начала иммунотерапии выявить факторы, оказывающие иммуносупрессивный эффект, поскольку способность клеток опухоли к реализации разных молекулярных механизмов, ингибирующих или модифицирующих противоопухолевый иммунный ответ, может влиять на ее эффективность.
Для оптимизации эффективности клеточной иммунотерапии злокачественных новообразований необходимо учитывать и минимизировать потенциальное иммуносупрессорное действие самой опухоли.
Целью настоящего исследования стала оценка клинической эффективности клеточной иммунотерапии аутологичными опухолевыми клетками, модифицированными геном tag7/PGRP-S, и активированными дендритными клетками распространенных и метастатических форм меланомы кожи, рака почки, саркомы мягких тканей на основании анализа продуцирования опухолевыми клетками иммуносупрессивных факторов (MICA, TGF-β, ИЛ-10 и VEGF).
Материал и методы
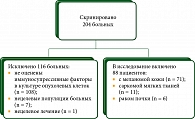
С 2001 по 2016 г. в Национальном медицинском исследовательском центре (НМИЦ) онкологии им. Н.Н. Петрова проводилось когортное исследование фаз I и II, в рамках которого были пролечены 204 пациента с местно-распространенными и диссеминированными формами меланомы кожи, рака почки, саркомы мягких тканей. Исследование осуществлялось при поддержке гранта правительства Москвы с участием Института биологии гена Российской академии наук.
После подписания информированного добровольного согласия на участие в исследовании 88 пациентов получали клеточную иммунотерапию на основе аутологичных опухолевых клеток, модифицированных геном tag7/PGRP-S (ГМВ), 116 больных – клеточную иммунотерапию аутологичными активированными дендритными клетками.
Технология приготовления препаратов для клеточной иммунотерапии и основные результаты исследований описаны в более ранних работах [12–16].
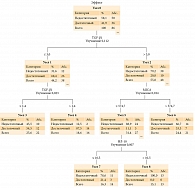
В исследовании допускалось участие пациентов из более ранних исследований при условии, что у них оценена продукция иммуносупрессивных факторов (рис. 1).
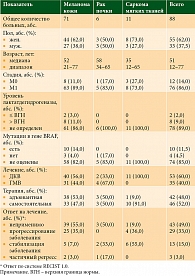
Всего в исследование было включено 88 пациентов (меланома кожи (n = 71), рак почки (n = 6), саркома мягких тканей (n = 11)). У всех больных была оценена продукция MICA, TGF-β1, ИЛ-10, VEGF в культурах аутологичных опухолевых клеток. Характеристика пациентов приведена в табл. 1. Средний возраст пациентов составил 51 (12–77) год. Большинство пациентов (76 (86%)) имели отдаленные метастазы. Риск прогрессирования характеризовался как высокий, что определялось критериями включения в основное исследование [14, 16, 17].
Культивирование опухолевых клеток. Материалом для приготовления клеточных культур служили фрагменты опухолевой ткани, полученные у пациентов хирургическим путем. После механической дезагрегации тканевых образцов в Medimashin (Dako Aglient, США) клеточную суспензию пропускали последовательно через систему фильтров Filcon 70 и 50 мкм (BD Biosciences, США), после чего помещали в питательную среду DMEM/F12 с 20%-ной сывороткой эмбрионов коров, глутамина (365 мг/л), инсулина (5 мкг/мл), трансферрина (5 мкг/мл), селена (5 нг/мл) (Invirtrogen, США), пенициллина (100 eд/мл), стрептомицина (100 мкг/мл) (Sigma, США) и непрерывно культивировали при 5%-ном CO2, 100%-ной влажности во флаконах по методу Freshney с собственными модификациями [18, 19]. После образования монослоя клетки пересевали с использованием раствора, состоящего из равных долей 0,25%-ного трипсина и 0,02%-ной этилендиаминтетрауксусной кислоты («БиолоТ», Россия).
Опухолевые клетки культивировали непрерывно, не менее десяти пассажей.
Лабораторные исследования. Факторы иммуносупрессии определяли в надосадочной жидкости (супернатантах) культур опухолевых клеток на ранних пассажах (≤ 10). Их концентрацию измеряли методом иммуноферментного анализа в «сэндвич»-варианте (ELISA) c использованием наборов DuoSet ELISA (R@D Systems, США) – для лиганда активационного рецептора цитотоксических Т- и NK-клеток MICA, наборов Bender MedSystems (Германия) – для TGF-β1, ИЛ-10, VЕGF.
Для определения оптической плотности использовали микропланшетный ридер Thermo Scientic Multiscan EX (Thermo LabSystems Inc., США) с блоком считывания и обработки информации при длине волны 450 нм.
Оценка клинической эффективности клеточной иммунотерапии. Общую выживаемость (ОВ) оценивали от начала лечения до смерти больного от любой причины, время до прогрессирования (ВДП) – как время от начала лечения до появления признаков прогрессирования процесса. Смерть больного не от злокачественной опухоли не расценивали как прогрессирование процесса. Медиана времени наблюдения за пациентами составила 22 месяца. По ОВ были цензурированы 33,0%, по ВДП – 22,7%.
Для анализа различий в изучаемых иммуносупрессивных факторах больные были классифицированы как имеющие достаточный эффект (ДЭ) или недостаточный эффект (НДЭ) терапии. Под достаточным эффектом лечения понимали отсутствие прогрессирования заболевания в течение шести месяцев при проведении самостоятельной (паллиативной) терапии и 12 месяцев при проведении адъювантной иммунотерапии.
Статистическую обработку данных осуществляли с использованием программного обеспечения SPSS (версия 23.0, IBM SPSS Statistics). Для их анализа использовали методы описательной статистики, для оценки ОВ – метод Каплана – Майера с Log-rank-тестом и метод пропорциональных рисков Кокса. При построении деревьев решений применяли метод CRT.
Результаты
На основании полученных ранее экспериментальных данных [20] нами была выдвинута гипотеза о том, что метаболические свойства клеток злокачественных новообразований, позволяющие создавать микроокружение, которое в дальнейшем будет способствовать диссеминации опухоли в организме, являются универсальным механизмом, существенно ограничивающим клиническую эффективность клеточной иммунотерапии.
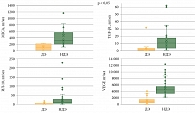
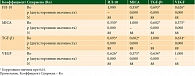
Культивируемые опухолевые клетки демонстрировали широкую вариабельность в отношении продуцирования иммуносупрессивных факторов. Однако концентрация всех исследуемых факторов в супернатантах малигнизированных клеток пациентов с НДЭ была статистически значимо выше, чем у больных с ДЭ (р < 0,05) (рис. 2, табл. 2).
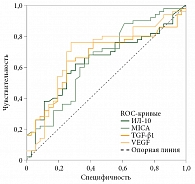
При оценке клинической эффективности специфической клеточной иммунотерапии была изучена прогностическая роль каждого иммуносупрессивного фактора. На рисунке 3 представлена точность прогнозирования достаточности эффекта при использовании каждого из факторов. Площадь под кривой ошибок (Receiver Operating Characteristic Area Under the Curve, ROC AUC) для ИЛ-10 составила 64,3%, для MICA – 65,5%, TGF-β1 – 69,5%, VEGF – 66,4%.
Для определения возможности прогнозирования достаточности эффекта нами был использован метод построения дерева принятия решений. В модель были включены такие параметры, как тип заболевания (меланома кожи, рак почки, саркома мягких тканей), метод лечения, наличие отдаленных метастазов, уровни иммуносупрессивных факторов. Полученное дерево решений представлено на рис. 4.
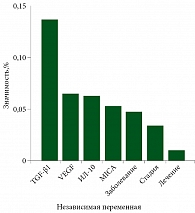
Точность прогнозирования с использованием подобного подхода превышала точность прогнозирования по отдельным факторам и, по данным кросс-проверки, составила 74,4% (чувствительность – 76,0%, специфичность – 72,2%). Наиболее значимым фактором при таком подходе оказался TGF-β1. При его концентрации 1,4–3 нг/мл имел место благоприятный прогноз. Пороговое значение для MICA составило 574,7 пг/мл, для ИЛ-10 – 10,5 пг/мл. Клинические параметры не имели решающего значения в модели. Значимость оцененных в модели факторов представлена на рис. 5.
Для валидации полученных данных больных с высокой вероятностью НДЭ относили к группе высокого риска, остальных пациентов – к группе низкого риска.
Для определения прогностической роли иммуносупрессивных факторов были построены многофакторные модели Кокса, оценивающие ОВ и ВДП больных меланомой как наибольшей из групп. Во всех случаях использовали метод условного включения. В качестве факторов в модель были включены вид терапии (ДКВ или ГМВ), стадия заболевания, паллиативный или адъювантный характер лечения, концентрации иммуносупрессивных факторов в супернатантах культур опухолевых клеток. Результаты анализа представлены в табл. 3.
Уровни TGF-β1 и MICA оказались независимыми значимыми факторами прогноза ОВ пациентов с меланомой кожи. Так, увеличение уровня MICA на единицу повышало риск смерти на 0,04%. С учетом высокого разброса значений данного фактора в нашем исследовании (минимальное – 7,5 пг/мл, максимальное – 5870,0 пг/мл) значимость его влияния на продолжительность жизни может быть велика. При диапазоне TGF-β1 0,125–62,150 нг/мл увеличение его концентрации на единицу ассоциировалось с повышением риска смерти на 3,4%. Это свидетельствует о более сильном влиянии TGF-β1 на ОВ по сравнению с MICA. При анализе ВДП установлено, что уровни MICA и TGF-β1 не добавляли информации в модель ОВ, тогда как уровень VEGF был значимым. Каждая дополнительная единица VEGF повышала риск прогрессирования на 0,03%. В нашем исследовании высокие уровни VEGF – от 12,59 до 12 389,50 пг/мл свидетельствовали о значительном вкладе данного показателя в прогностическую модель. ИЛ-10 не добавлял дополнительной прогностической информации ни в одну модель прогнозирования (p > 0,1) (табл. 3).
Связь между факторами оценивалась с использованием ранговых корреляций Спирмена. Все иммуносупрессивные факторы были значимо связаны между собой, при этом уровень корреляций был средним (табл. 4).
Необходимо отметить, что при включении факторов в многофакторные модели выживаемости не наблюдалось высоких корреляций их регрессионных остатков, что не нарушает предположений модели. Тем не менее подобные взаимосвязи позволяют упростить оценку риска с использованием проанализированных факторов и требуют комплексного подхода к их оценке.
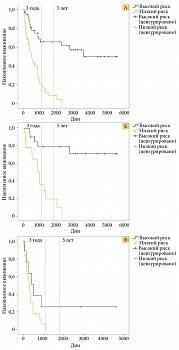
Мы применили полученный результат оценки рисков прогрессирования на основании количественного содержания иммуносупрессивных факторов в однофакторном и многофакторном анализе. При однофакторном анализе уровень риска определял ОВ как в общей популяции, так и у получавших адъювантную терапию по поводу меланомы (рис. 6, табл. 5). Мощность нашего исследования оказалась недостаточной для получения статистически значимых различий по ОВ у больных меланомой на самостоятельном лечении (р = 0,101) (рис. 6, табл. 5). Никто из больных с высоким риском не пережил три года.
При построении аналогичных предыдущим моделей Кокса для прогнозирования ОВ и ВДП у пациентов с меланомой кожи риск, основанный на количественном содержании иммуносупрессивных факторов в супернатантах культур опухолевых клеток, служил независимым фактором прогноза. У больных из группы низкого риска относительный риск (ОР) смерти составил 0,227, прогрессирования – 0,239 (табл. 6).
Обсуждение
Ускользание опухолевых клеток от воздействия иммунной системы (immune escape) – хорошо известный феномен, который лежит в основе резистентности к иммунотерапии и реализуется посредством многочисленных механизмов, в том числе малоизученных на сегодняшний день [8].
Согласно результатам нашего исследования, факторы, которые ассоциируются с иммуносупрессией и продуцируются клетками злокачественных новообразований, могут быть использованы в качестве биомаркеров на системном и локальном уровнях (в периферической крови пациентов и/или непосредственно в опухолевом очаге).
Технологические особенности метода приготовления клеточных противоопухолевых вакцин на основе собственных опухолевых клеток пациентов или аутологичных клеток иммунной системы позволили использовать новый источник биомаркеров – культуру малигнизированных клеток, которая подвергается трансфекции интересующими генами или применяется как источник антигенов для нагрузки и активации дендритных клеток.
В иммунологически толерантном микроокружении опухоли может быть реализовано множество механизмов резистентности к терапии за счет повышения концентрации разнообразных биологически активных молекул локально в опухолевом очаге или системно в кровотоке.
Мы проанализировали секрецию MICA, TGF-β1, ИЛ-10 и VEGF, характеризующихся плейотропными эффектами в организме и различными механизмами действия. Данные факторы при высоких концентрациях способны блокировать специфическую активность антигенпрезентирующих клеток и цитотоксических Т-лимфоцитов. Можно предположить как минимум три сценария действия иммуносупрессивных факторов в аспекте клеточной иммунотерапии:
- ухудшение презентации антигена в месте инъекции клеточного противоопухолевого препарата, когда активная секреция факторов вакцинными клетками препятствует эффективной индукции иммунного ответа;
- высокая концентрация в опухолевом очаге иммуносупрессивных факторов, которые препятствуют действию активированных иммунных клеток;
- системная иммуносупрессия, вызванная этими факторами.
Мы не обнаружили явных клинических признаков иммуносупрессии у включенных в исследование пациентов. Тем не менее анализ клинической эффективности клеточной иммунотерапии показал зависимость ОВ и ВДП от концентраций иммуносупрессивных факторов в межклеточном окружении малигнизированных культур in vitro, что можно экстраполировать на ситуацию in vivo. Иммуносупрессивное воздействие изученных факторов носит универсальный характер и не зависит от типа не только противоопухолевой вакцины (ГМВ или ДКВ), но и злокачественного новообразования. В исследованиях, проведенных в НМИЦ онкологии им. Н.Н. Петрова, продемонстрировано, что концентрация иммуносупрессивных факторов, секретируемых клетками меланомы, ассоциирована с блокадой подвижности дендритных клеток, оцениваемой по скорости прохождения и длине траектории в модельной системе in vitro [21]. Кроме того, при моделировании in vitro иммунных синапсов обнаружено, что индекс жизнеспособности клеток саркомы мягких тканей и меланомы при взаимодействии с активированными цитотоксическими Т-лимфоцитами коррелирует с концентрациями MICA, TGF-β1, ИЛ-10, VEGF и в модельной системе.
Таким образом, экспериментальные данные убедительно демонстрируют важность этих критериев для изучения и объясняют значение выявленного феномена.
В наше исследование были включены пациенты с более тяжелым прогнозом, чем в средней популяции больных меланомой, описанной ранее [22]. Об этом свидетельствуют более низкие показатели выживаемости больных из групп как низкого, так и высокого риска. Важно подчеркнуть, что наши результаты сопоставимы с результатами применения анти-PD-1-терапии, которая считается наиболее эффективной в условиях реальной клинической практики [23, 24]. При анализе адъювантной терапии эффективность вакцин в группе низкого риска существенно превосходила эффективность терапии анти-PD-1-препаратами в условиях реальной клинической практики [24]. Так, в нашем исследовании медиана ВДП составила 65,9 месяца, в исследовании Р. Koelblinger и cоавт. – 16,7 месяца [22]. При сопоставлении результатов применения анти-PD-1-препаратов с результатами самостоятельного лечения в группе низкого риска разница практически отсутствовала. Так, в нашем исследовании ВДП составила 4,7 месяца, в исследовании A. Arheden и соавт. – 5,7 месяца [23]. Однако она существенно уступала по показателям ОВ – 16,5 и 27,9 месяца. Причиной такого расхождения данных может быть отсутствие доступа к современным методам терапии, продлевающим жизнь, у большинства больных, включенных в исследование, в момент его проведения. Поэтому полученные нами результаты могут рассматриваться как чистый эффект, то есть без смещения от последующего эффективного лечения.
Как известно, различные методы иммунотерапии по-разному воздействуют на ключевые иммунопатогенетические синдромы, сопровождающие рост злокачественной опухоли [25–27].
Выводы
Полученные в нашем исследовании результаты демонстрируют важность создания жестких критериев отбора пациентов для клеточной иммунотерапии с учетом биологических характеристик злокачественных опухолей. Уникальным источником для этого могут стать культуры аутологичных опухолевых клеток.
В нашем исследовании продемонстрирована высокая предиктивная и прогностическая ценность продуцирования опухолевыми клетками иммуносупрессивных факторов у больных, получающих клеточную иммунотерапию.
Представленная информация может быть использована при планировании дальнейших исследований клеточных методов иммунотерапии, направленных на оптимизацию презентации опухоль-ассоциированных антигенов клеткам иммунной системы.
A.B. Danilova, PhD, A.V. Novik, PhD, T.L. Nekhaeva, PhD, I.A. Baldueva, PhD
N.N. Petrov National Medical Research Centre of Oncology, St. Petersburg
St. Petersburg State Pediatric Medical University
Contact person: Aleksey V. Novik, anovik@list.ru
Production of different factors with wide immunosuppressive properties by tumor cells is one of the mechanisms that support tumor growth. We think that immunosuppressive action of tumor cells should be taken into account for cellular antitumor therapy optimization.
Aim of the study – to evaluate the effectiveness of cellular immunotherapy factors (ISF) for response prediction in patients receiving tag7/PGRP-S gene modified tumor cells (GMV) or autologous dendritic cells vaccine (DCV) for melanoma (Mel), kidney cancer (RCC) and soft tissue sarcoma (STS).
Material and methods. We have treated 204 patients with cellular therapy since 2001 till 2016 (88 – GMV, 1 16 – DCV). ISF (MICA, TGF-β, IL-10 и VEGF) were measured in tumor tissue cultures of 88 patients (71 – Mel, 6 – RCC, 11 – STS). Median age of patients was 51 year. Patient were divided as having insufficient response (IR) or sufficient response (SR) for the analysis purpose.
Results. ISF concentration in cultures of patients with IR was higher than in patients with SR (р < 0.05). SR could be predicted correctly in 74.4% using ISF. The most important factor was TGF-β1. In the Cox model TGF-β1 and MICA levels were significant predictors of overall survival for Mel patients (р < 0.05). VEGF was the most important factor for time to progression prognosis. Spirman correlations showed moderate significant correlation between ISF (р < 0.05).
Conclusions. ISF concentration in cell cultures obtained from the patients with Mel, RCC or STS is important independent predictive factor for time to progression and overall survival. Our data supports rigid selection criteria based on biological properties of tumor cells for patients receiving cellular therapy for solid tumors.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


