Роль клинико-нейровизуальных параметров в формировании когнитивной дисфункции у пациентов с мальформацией Киари 1-го типа
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить особенности когнитивного статуса пациентов с МК1 и проанализировать их взаимосвязь с основными клинико-нейровизуальными параметрами.
Материал и методы. Основная группа была сформирована из 105 взрослых пациентов с МК1 – 74 мужчин (70,5%) и 31 женщины (29,5%) в возрасте 25,73 ± 7,04 года. Контрольную группу составили 50 пациентов без признаков МК1 и иной органической патологии головного мозга, а также без признаков когнитивных расстройств известной этиологии – 31 мужчина (62%) и 19 женщин (38%) в возрасте 26,36 ± 5,00 года. Группы были однородны по половому составу, возрасту и уровню образования. Нейровизуальная верификация МК1 проводилась с использованием магнитно-резонансной томографии головного мозга (1,5 Т). Проведено клинико-неврологическое обследование, для анализа характеристик болевого синдрома использовались опросник SF-MPQ-2-RU и визуальная аналоговая шкала, для оценки параметров аффективных нарушений – опросники HADS и DASS-21. Комплексное нейропсихологическое тестирование выполнялось с помощью MMSE, MoCA и теста прокладывания пути (ТМТ А и В).
Результаты. Нарушения памяти и трудности с концентрацией внимания отмечали 20% пациентов с МК1. Субъективные признаки когнитивной дисфункции в основной группе объективно подтверждены результатами комплексного нейропсихологического тестирования по сравнению с группой контроля (p < 0,05).
Анализ взаимоотношений когнитивного фенотипа и клинического профиля пациентов с МК1 позволил установить связь когнитивной дисфункции с наличием и тяжестью неврологического дефицита, а также ассоциацию когнитивного дефицита с характерной для МК1 головной болью. Отмечалось негативное влияние цефалгического синдрома на когнитивное функционирование у пациентов с МК1. Выявлена связь когнитивной дисфункции со степенью выраженности аффективных расстройств.
Результаты изучения взаимосвязи когнитивных показателей и основных нейровизуальных параметров задней черепной ямки (ЗЧЯ) и краниовертебрального перехода свидетельствуют о значимой ассоциации тесной ЗЧЯ и высокой степени эктопии миндалин мозжечка с когнитивной дисфункцией у пациентов с МК1.
Выводы. Полученные результаты указывают на неоднозначность механизмов, лежащих в основе когнитивной дисфункции у пациентов с МК1. Очевидны самостоятельная роль патофизиологии МК1 и негативное влияние дополнительных факторов, таких как болевой синдром и расстройства эмоциональной сферы.
Цель – изучить особенности когнитивного статуса пациентов с МК1 и проанализировать их взаимосвязь с основными клинико-нейровизуальными параметрами.
Материал и методы. Основная группа была сформирована из 105 взрослых пациентов с МК1 – 74 мужчин (70,5%) и 31 женщины (29,5%) в возрасте 25,73 ± 7,04 года. Контрольную группу составили 50 пациентов без признаков МК1 и иной органической патологии головного мозга, а также без признаков когнитивных расстройств известной этиологии – 31 мужчина (62%) и 19 женщин (38%) в возрасте 26,36 ± 5,00 года. Группы были однородны по половому составу, возрасту и уровню образования. Нейровизуальная верификация МК1 проводилась с использованием магнитно-резонансной томографии головного мозга (1,5 Т). Проведено клинико-неврологическое обследование, для анализа характеристик болевого синдрома использовались опросник SF-MPQ-2-RU и визуальная аналоговая шкала, для оценки параметров аффективных нарушений – опросники HADS и DASS-21. Комплексное нейропсихологическое тестирование выполнялось с помощью MMSE, MoCA и теста прокладывания пути (ТМТ А и В).
Результаты. Нарушения памяти и трудности с концентрацией внимания отмечали 20% пациентов с МК1. Субъективные признаки когнитивной дисфункции в основной группе объективно подтверждены результатами комплексного нейропсихологического тестирования по сравнению с группой контроля (p < 0,05).
Анализ взаимоотношений когнитивного фенотипа и клинического профиля пациентов с МК1 позволил установить связь когнитивной дисфункции с наличием и тяжестью неврологического дефицита, а также ассоциацию когнитивного дефицита с характерной для МК1 головной болью. Отмечалось негативное влияние цефалгического синдрома на когнитивное функционирование у пациентов с МК1. Выявлена связь когнитивной дисфункции со степенью выраженности аффективных расстройств.
Результаты изучения взаимосвязи когнитивных показателей и основных нейровизуальных параметров задней черепной ямки (ЗЧЯ) и краниовертебрального перехода свидетельствуют о значимой ассоциации тесной ЗЧЯ и высокой степени эктопии миндалин мозжечка с когнитивной дисфункцией у пациентов с МК1.
Выводы. Полученные результаты указывают на неоднозначность механизмов, лежащих в основе когнитивной дисфункции у пациентов с МК1. Очевидны самостоятельная роль патофизиологии МК1 и негативное влияние дополнительных факторов, таких как болевой синдром и расстройства эмоциональной сферы.



Мальформация Киари 1-го типа (МК1), будучи наиболее распространенным типом спектра мальформаций Киари, радиологически определяется каудальной дислокацией одной или двух миндалин мозжечка более чем на 5 мм ниже уровня большого затылочного отверстия (БЗО) или дислокацией двух миндалин мозжечка на 3 мм и более относительно уровня БЗО [1, 2]. Распространенность клинической асимптомности опущения миндалин мозжечка, по разным данным, составляет от 2 до 68% [1, 3–5]. Эти данные не позволяют считать достаточным для постановки диагноза МК1 использование исключительно нейровизуального критерия и указывают на важность клинической картины мальформации [1, 6, 7].
Симптомокомплекс МК1 представляет собой совокупность проявлений дисфункции мозжечка, ствола мозга, спинальных нарушений и расстройств ликвородинамики, обусловленных основными патофизиологическими механизмами МК1 [1, 8, 9]. Вклад той или иной группы расстройств определяет индивидуальный профиль каждого пациента с МК1, однако причинами диагностических ошибок часто становятся неспецифичность клинической картины МК1 и преобладание субъективных расстройств над объективными неврологическими проявлениями [1, 10, 11].
Обсуждение когнитивной дисфункции у пациентов с МК1 в качестве нового компонента клинической картины вызвало широкий интерес среди исследователей в последние годы [12–20]. Установленный фенотип когнитивных расстройств является дискуссионным. Учитывая небольшое число исследований когнитивного функционирования у пациентов с МК1, необходимо отметить, что нередко исследования базировались на смешанных возрастных группах или смешанных когортах пациентов с МК1 в до- и послеоперационном периоде.
В генезе когнитивного дефицита у пациентов с МК1 отводится самостоятельная роль патофизиологии мальформации [12, 13, 20], а также влиянию дополнительных факторов – болевого синдрома и расстройств эмоциональной сферы [15–18]. Тем не менее, несмотря на значительный прогресс в изучении особенностей когнитивного статуса у пациентов с МК1, накопленные на сегодняшний день результаты носят ограниченный характер и не могут быть интерпретированы однозначно.
Полностью не изученной остается роль степени эктопии миндалин мозжечка и других характеристик задней черепной ямки (ЗЧЯ) и краниовертебрального перехода, а также роль наличия и выраженности неврологических проявлений мальформации в генезе когнитивного дефицита у пациентов с МК1.
Изучение особенностей когнитивного статуса пациентов с МК1 и их взаимосвязи с основными клинико-нейровизуальными параметрами является важным этапом в формировании качественно новых представлений о спектре клинических проявлений МК1 и патофизиологии их формирования в каждом конкретном случае.
Цель исследования – изучить особенности когнитивного статуса пациентов с МК1 и проанализировать их взаимосвязь с основными клинико-нейровизуальными параметрами.
Материал и методы
На основании клинико-неврологического обследования пациентов с МК1, верифицированной данными магнитно-резонансной томографии (МРТ), была сформирована основная группа из 105 взрослых пациентов со специфичными для МК1 жалобами. В нее вошли 74 мужчины (70,5%) и 31 женщина (29,5%), средний возраст – 25,73 ± 7,04 года. Контрольную группу составили 50 пациентов без признаков МК1 и иной органической патологии головного мозга, а также без признаков когнитивных расстройств известной этиологии – 31 мужчина (62%) и 19 женщин (38%), средний возраст – 26,36 ± 5,00 года.
Группы были однородны по половому составу, возрасту и уровню образования.
С целью нейровизуальной верификации МК1 всем участникам исследования проводилась МРТ головного мозга на МР-томографах GE Signa и Toshiba Excelart Vantage с индукцией магнитного поля 1,5 Т с последующим анализом стандартных Т1- и Т2-последовательностей в срединно-сагиттальной плоскости. Анализ клинического профиля заключался в сборе жалоб и анамнестических сведений, а также проведении подробного неврологического осмотра каждого пациента. Комплексное нейропсихологическое тестирование с целью формирования представлений о когнитивном статусе исследуемых выполнялось с использованием краткой шкалы оценки психического статуса (Mini-Mental State Examination, MMSE), Монреальской шкалы оценки когнитивных функций (Montreal Cognitive Assessment, MoCA), а также теста прокладывания пути (Trail Making Test, TMT, субтесты A и В). Для анализа болевого синдрома использовались опросник SF-MPQ-2-RU и визуальная аналоговая шкала (ВАШ). Аффективные нарушения оценивали на основании госпитальной шкалы тревоги и депрессии (Hospital Anxiety and Depression Scale, HADS) и шкалы депрессии, тревоги и стресса (Depression Anxiety and Stress Scale 21, DASS-21).
Статистический анализ данных проводили на базе IBM SPSS Statistics 28.0 с использованием непараметрического критерия Манна – Уитни, t-критерия Стьюдента для количественных данных, критерия хи-квадрат для анализа частот. Оценка силы и направления связи между количественными признаками осуществлялась с помощью коэффициента корреляции Спирмена. Критическим уровнем значимости считалось значение p < 0,05.
Результаты
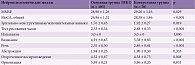
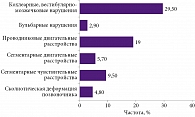
Анализ субъективных симптомов, описываемых пациентами с МК1, показал преобладание жалоб на головную боль (87,6%), боль в области шеи (27,6%), ощущение головокружения (24,8%), слабость и утомляемость (23,8%), нарушение памяти и трудности с концентрацией внимания (20%), а также неустойчивость и шаткость при ходьбе (16,2%) (рис. 1).
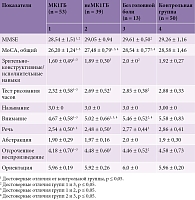
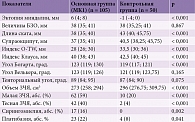
Субъективные когнитивные нарушения, описываемые пациентами с МК1 в 20% случаев, объективно подтверждены результатами нейропсихологического тестирования по сравнению со здоровыми респондентами. Минимальный достоверный когнитивный дефицит, по данным MMSE, – 28,90 ± 1,26 в группе пациентов с МК1 и 29,26 ± 1,16 в группе контроля (p = 0,029). Значимое когнитивное снижение установлено по результатам оценки теста MoCA – 26,96 ± 1,32 балла в группе пациентов с МК1 против 28,58 ± 1,46 балла в группе контроля (p < 0,001). В структуре общего когнитивного дефицита отмечалась вовлеченность доменов исполнительного функционирования, зрительно-пространственных навыков, внимания, отсроченного воспроизведения и речи (табл. 1).
Дефицит в области исполнительного функционирования, зрительно-пространственных навыков и внимания у пациентов с МК1 подтвержден результатами оценки ТМТ (табл. 2).
Данные о преобладании жалоб на головную боль среди основных субъективных симптомов у пациентов с МК1 согласуются с данными литературы, имеющимися на сегодняшний день [15, 21, 22].
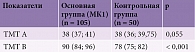
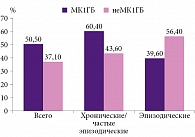
Согласно Международной классификации головных болей 3-го пересмотра (ICHD-3) [23], исходя из критериев МК1-ассоциированной головной боли, в 50,5% случаев (53 пациента с МК1) выявлены характерные для МК1 головные боли (МК1ГБ). Хронический (и частый эпизодический – свыше десяти дней в месяц) характер МК1ГБ имел место в 60,4% случаев, эпизодический – в 39,6%. Все головные боли, не соответствовавшие критериям МК1ГБ у пациентов с МК1, выделены как неМК1ГБ (37,1%). Хронический (и частый эпизодический – более десяти дней в месяц) характер неМК1ГБ был представлен в 43,6% случаев, эпизодический характер – в 56,4% (рис. 2).
Как показала оценка влияния болевого синдрома на когнитивный статус пациентов с МК1, у всех пациентов с МК1, предъявлявших жалобы на головную боль, были достоверно более низкие когнитивные показатели по сравнению с пациентами с МК1 без головной боли. Наиболее выраженный когнитивный дефицит, по данным MMSE, MoCA, субтестов А и В ТМТ, зафиксирован в подгруппе пациентов с МК1-ассоциированными головными болями (МК1ГБ). Анализ результатов оценки вовлеченности когнитивных доменов в структуре общего когнитивного дефицита у пациентов с неМК1ГБ по сравнению с пациентами с МК1, не предъявлявшими жалоб на головную боль, позволил выявить достоверное снижение преимущественно в домене внимания, без значимого дефицита в остальных доменах, по данным MoCA (табл. 3).
Сравнение показателей когнитивного функционирования по MMSE и МоСА у пациентов с МК1 без головной боли и показателей пациентов контрольной группы не выявило достоверных различий, однако анализ результатов субтеста В ТМТ показал у всех пациентов с МК1 независимо от наличия и типа головной боли достоверное когнитивное снижение (табл. 4).
Среди субъективных симптомов, характерных для МК1, наряду с головной болью и болью в области шеи отмечалась распространенность жалоб вестибулярно-мозжечкового спектра. Так, эпизоды головокружения системного и несистемного характера описывали 26 (24,8%) пациентов с МК1, ощущение шаткости, неустойчивости при ходьбе – 17 (16,2%).
Оценка неврологического статуса показала диссоциацию между распространенностью характерных субъективных симптомов (100%) и частотой представленности объективных неврологических проявлений у пациентов с МК1 (35,2%).
Наиболее распространенными были кохлеарные, вестибулярно-мозжечковые нарушения – 29,5% от общего числа пациентов с МК1. В 21,9% случаев наблюдалась патология в координаторных пробах, у 19% пациентов с МК1 отмечалась неустойчивость в пробе Ромберга. Нистагм преимущественно горизонтального, а также смешанного характера зафиксирован у 11 (10,5%) пациентов с МК1. Походка с широкой базой опоры наблюдалась в 7,6% случаев, снижение слуха – у 3 (2,9%) пациентов с МК1 (рис. 3).
Оценка корреляционных взаимоотношений когнитивных показателей и объективных неврологических проявлений у пациентов с МК1 показала наличие связи когнитивной дисфункции с неврологическим дефицитом и его тяжестью (табл. 5).
Анализ результатов опросников HADS и DASS-21 позволил выявить большую представленность эмоциональных расстройств в группе пациентов с МК1 по сравнению с контрольной группой. Нормальные показатели, согласно референсам опросников, имели 37% пациентов с МК1 и 66% пациентов контрольной группы.
Признаки когнитивного снижения выявлены как у пациентов с аффективными расстройствами выраженной степени, так и у пациентов с МК1, не имевших расстройств эмоциональной сферы.
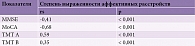
Установлены корреляционные отношения между степенью выраженности расстройств эмоциональной сферы и основными когнитивными показателями – умеренная связь с суммарным баллом MMSE (rs = -0,41, p < 0,001) и временем, затрачиваемым на выполнение субтеста В TMT (rs = 0,35, p < 0,001), заметная связь с суммарным баллом MoCA (rs = -0,68, p < 0,001) и временем на выполнение субтеста A теста TMT (rs = 0,59, p < 0,001) (табл. 6).
Результаты сравнения МР-морфометрических показателей в основной и контрольной группах показали уменьшение линейных и увеличение угловых показателей у пациентов с МК1. Кроме того, 59% пациентов с МК1 имели так называемую малую ЗЧЯ с укороченными линейными размерами ската и/или чешуи затылочной кости и/или малым объемом ЗЧЯ. В свою очередь у 40% пациентов с МК1 отмечалась тесная ЗЧЯ с отсутствием большой цистерны на сагиттальных МР-изображениях [24]. У 22% пациентов с МК1 выявлена платибазия, всего 16% пациентов с МК1 имели сирингомиелию на шейном уровне (табл. 7).
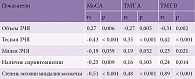
При оценке корреляционных взаимоотношений когнитивных и нейровизуальных показателей установлена умеренная связь между суммарным баллом MoCA и тесной ЗЧЯ (rs = -0,43, p < 0,001), между временем на выполнение ТМТ А и степенью эктопии миндалин мозжечка (rs = 0,48, p < 0,001), между временем на выполнение ТМТ В и тесной ЗЧЯ (rs = 0,42, p < 0,001), заметная связь между суммарным баллом MoCA и степенью эктопии миндалин мозжечка (rs = -0,51, p < 0,001), а также высокая связь между временем на выполнение ТМТ В и степенью эктопии миндалин мозжечка (rs = 0,89, p < 0,001) (табл. 8).
Полученные сведения о корреляционных взаимоотношениях позволяют сделать вывод о возможно значимой ассоциации тесной ЗЧЯ и высокой степени эктопии миндалин мозжечка с когнитивной дисфункцией у пациентов с МК1.
Обсуждение
Нарушения памяти и трудности с концентрацией внимания отмечали 20% пациентов с МК1, что позволяет рассматривать когнитивные расстройства как один из распространенных субъективных симптомов МК1.
Признаки когнитивной дисфункции, описываемые пациентами, объективно подтверждены результатами комплексного нейропсихологического тестирования по сравнению с группой здоровых респондентов. По данным MMSE, MoCA, TMT А и ТМТ В, выявлено общее когнитивное снижение, а также вовлеченность доменов исполнительного функционирования, зрительно-пространственных навыков, внимания, отсроченного воспроизведения и речи.
Установленное когнитивное снижение в доменах исполнительного функционирования, зрительно-пространственных навыков, внимания, отсроченного воспроизведения и речи подтверждает немногочисленные сведения о специфичной вовлеченности доменов в структуре общей когнитивной дисфункции у пациентов с МК1 [12–19, 25]. Однако подобные результаты впервые были получены на основании изучения большой однородной группы пациентов с МК1 молодого и среднего возраста.
Негативное влияние нарушенной анатомии структур заднего мозга, в частности мозжечка, на сеть его многочисленных регуляторных связей с различными кортикальными областями обсуждается исследователями в качестве основной теории развития когнитивного дефицита у пациентов с МК1 и, вероятно, наилучшим образом объясняет специфику когнитивной дисфункции [12, 13, 20].
Впервые проведенный анализ взаимоотношений когнитивного фенотипа и объективных неврологических проявлений у пациентов с МК1 позволил установить связь когнитивной дисфункции не только с наличием неврологического дефицита, но и его тяжестью. Подобная связь свидетельствует о комплексности невролого-нейропсихологических проявлений при МК1.
Преобладание мозжечковых расстройств в симптомокомплексе МК1 наряду с установленной взаимосвязью неврологического дефицита и когнитивных нарушений у данных пациентов согласуется с результатами исследований, в которых участвовали пациенты с наследственными мозжечковыми атаксиями [26, 27]. Корреляция моторных и немоторных расстройств у пациентов с наследственной патологией мозжечка, согласно данным работ, подчеркивает вероятную роль мозжечковой дисрегуляции в патофизиологии широкого круга основных клинических проявлений МК1.
Результаты, касающиеся роли болевого синдрома в формировании когнитивной дисфункции у пациентов с МК1, свидетельствуют как о негативном влиянии длительно существующего цефалгического синдрома, так и о связи когнитивной дисфункции у пациентов с МК1 с характерной для МК1 головной болью, обусловленной патологией ликвородинамики [22]. Такая ассоциация указывает на вероятную общность патогенетических механизмов специфической головной боли и когнитивной дисфункции при МК1. Патология ликвородинамики, лежащая в основе МК1-ассоциированных головных болей, может усиливать влияние компрессионных и тракционных механизмов, оказывающих непосредственное негативное воздействие на структуры заднего мозга, в частности на многочисленные регуляторные связи мозжечка с различными церебральными областями. Подобные условия, вероятно, затрудняют полноценное участие мозжечка в процессах высшей когнитивной модуляции [28], что вносит весомый вклад в развитие когнитивного дефицита у пациентов с МК1.
Выявленная связь когнитивной дисфункции со степенью выраженности аффективных расстройств говорит об очевидном влиянии эмоциональных нарушений на когнитивное функционирование у пациентов с МК1.
Ряд публикаций указывает на достоверную ассоциацию когнитивных нарушений и расстройств тревожно-депрессивного спектра [29, 30]. Кроме того, расстройства эмоциональной сферы рассматриваются в качестве неотъемлемой составляющей мозжечкового когнитивно-аффективного синдрома, описанного у пациентов с поражениями мозжечка при различных патологических состояниях [28].
Полученные данные не исключают непосредственного негативного влияния аффективных расстройств на структуру когнитивных процессов, равно как и сочетания когнитивных нарушений и расстройств эмоционального спектра в контексте специфической картины мозжечковой дисрегуляции у пациентов с МК1.
Между тем оснований для объяснения когнитивной дисфункции у пациентов с МК1 исключительно влиянием эмоциональных расстройств или болевого синдрома не получено, поскольку признаки когнитивного снижения демонстрировали все пациенты с МК1 независимо от наличия головной боли и расстройств эмоциональной сферы.
Анализ взаимоотношений основных нейровизуальных параметров и показателей нейропсихологического тестирования пациентов с МК1 позволяет сделать вывод о значимой ассоциации тесной ЗЧЯ и высокой степени эктопии миндалин мозжечка с когнитивной дисфункцией у пациентов с МК1. Вероятно, высокая степень эктопии миндалин мозжечка, свидетельствуя о более выраженной деформации структур заднего мозга, обусловливает значимую дисфункцию церебеллярных сетей. В свою очередь «теснота» задней черепной ямки, определяя патологию ликвородинамики, может иметь сродство с МК1-ассоциированными головными болями, замыкая патологический круг формирования когнитивного дефицита у пациентов с МК1.
Заключение
Результаты проведенного исследования свидетельствуют о неоднозначности механизмов, лежащих в основе когнитивной дисфункции у пациентов с МК1. Очевидны самостоятельная роль патофизиологии МК1 и негативное влияние дополнительных факторов, таких как болевой синдром и расстройства эмоциональной сферы.
На сегодняшний день не представляется возможным с точностью оценить вклад каждого фактора в развитие специфического когнитивного дефицита у пациентов с МК1, но настоящее исследование может послужить значимым вектором для дальнейшего изучения данной проблемы.
Источник финансирования.
Исследование не имело спонсорской поддержки.
Конфликт интересов.
Авторы заявляют об отсутствии конфликта интересов.
R.G. Kokurkina, Ye.G. Mendelevich, PhD, Prof.
Kazan State Medical University
Contact person: Radmila G. Kokurkina, rada_nell@mail.ru
In recent years, a wide interest among researchers has been aroused by the study of cognitive dysfunction in patients with Chiari malformation of the type 1 (CM1), however, the results accumulated to date are limited and cannot be interpreted unambiguously.
Objective. To study the features of the cognitive status of patients with CMI and to analyze their relationship with the main clinical and neuroimaging parameters.
Material and methods. The main group consisted of 105 adult patients with CM1 – 74 men (70.5%) and 31 women (29.5%) aged 25.73 ± 7.04 years. The control group consisted of 50 patients without signs of CM1 and other organic brain pathology, as well as without signs of cognitive disorders of known etiology, which included 31 men (62%) and 19 women (38%) aged 26.36 ± 5.00 years. The groups were homogeneous in terms of gender, age and level of education. Neuroimaging verification of CM1 was performed using magnetic resonance imaging of the brain (1.5 T). Clinical and neurological examination was carried out, the SF-MPQ-2-RU questionnaire and the VAS scale were used to analyze the characteristics of the pain syndrome, the HADS and DASS-21 questionnaires were used to assess the parameters of affective disorders. Comprehensive neuropsychological testing was carried out using MMSE, MoCA and the Trail Making Test (TMT A and B).
Results. Memory disorders and difficulties with concentration were noted by 20% of patients with CM1. Subjective signs of cognitive dysfunction were objectively confirmed by the results of complex neuropsychological testing in comparison with the control group (p < 0.05).
The analysis of the relationship between the cognitive phenotype and the clinical profile of patients with CM1 made it possible to establish the relationship of cognitive dysfunction with the presence and severity of neurological deficits, as well as the association of cognitive deficits with a headache characteristic of CM1 (CM1HA). The negative effect of cephalgic syndrome on cognitive functioning in patients with CM1 was noted. The relationship of cognitive dysfunction with the degree of severity of affective disorders was revealed.
The results of the study of the relationship between cognitive indicators and the main neuroimaging parameters of the posterior cranial fossa and craniovertebral junction indicate a significant association of close PCF and a high degree of ectopia of the cerebellar tonsils with cognitive dysfunction in patients with CM1.
Conclusions. The results of the study indicate the ambiguity of the mechanisms underlying cognitive dysfunction in patients with CM1. Both the independent role of the pathophysiology of CM1 and the negative influence of additional factors, such as pain syndrome and emotional disorders, are obvious.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.