Саркопения при жировой болезни печени: клинический случай
- Аннотация
- Статья
- Ссылки
- English
Также подчеркивается роль миостатина и других миокинов, дефицита витамина D в регуляции мышечной массы, адипогенеза и процессов миогенеза. Обсуждается связь дислипидемии с повреждением мышц и важность физической активности для предотвращения потери мышечной массы.
В заключении делается вывод о необходимости ранней диагностики саркопении и комплексного подхода к ее лечению, включая изменение образа жизни, физические упражнения и фармакологические вмешательства.
Также подчеркивается роль миостатина и других миокинов, дефицита витамина D в регуляции мышечной массы, адипогенеза и процессов миогенеза. Обсуждается связь дислипидемии с повреждением мышц и важность физической активности для предотвращения потери мышечной массы.
В заключении делается вывод о необходимости ранней диагностики саркопении и комплексного подхода к ее лечению, включая изменение образа жизни, физические упражнения и фармакологические вмешательства.

Введение
Саркопения (миопения) вследствие потери массы, силы и функции скелетных мышц является значимым клиническим проявлением при хронических заболеваниях печени (ХЗП) у пациентов с метаболическими нарушениями и, как правило, выявляется лишь при прогрессировании болезни [1]. Саркопения была включена в Международную классификацию болезней десятого пересмотра с 2016 г. [2]. Однако вопрос, является ли саркопения заболеванием или осложнением ХЗП, остается дискутабельным.
Общая распространенность саркопении варьирует от 10 до 27%, причем среди мужчин этот показатель выше. По данным систематического обзора, распространенность саркопении была выше в европейских исследованиях с использованием критериев EWGSOP (12%), в то время как, по данным AWGS, FNIH и EWGSOP, среди пациентов, проживающих в Азии и Океании, зарегистрирована самая низкая общая распространенность саркопении (3%) [3]. Вместе с тем данные о распространенности саркопении в других регионах, в частности в Африке, ограничены. Так, среди 16% населения мира, проживающего в Африке, отсутствует полноценное питание и медицинская помощь [4], в связи с чем необходимы дальнейшие исследования для оценки бремени болезней, включая саркопению, в этом регионе [5].
Исследование S. Papadopoulou и соавт. по изучению распространенности саркопении во всем мире проводили в различных условия проживания населения – в обществе, домах престарелых и стационарах. Анализ 41 исследования показал, что находящиеся в домах престарелых и госпитализированные пациенты были более склонны к саркопении. Распространенность саркопении составила 11 и 9% у мужчин и женщин, проживающих по месту жительства; 51 и 31% – у мужчин и женщин, находящихся в домах престарелых; 23 и 24% – у госпитализированных мужчин и женщин соответственно.
В настоящее время саркопению классифицируют по этиологии на первичную, обусловленную старением, и вторичную, связанную с различными хроническими заболеваниями. Вторичная саркопения развивается на фоне хронических заболеваний, низкой физической активности и нарушения питания [1]. Также выделяют острую саркопению, развившуюся менее чем за шесть месяцев, и хроническую, которая возникает и прогрессирует в течение длительного времени.
Ранее диагноз саркопении ставили при наличии основного критерия – низкой мышечной массы [6], однако по мере изучения данной проблемы, мышечная функция (сила или производительность) стала признаваться как более надежный критерий данного заболевания [1]. В соответствии с этими признаками выделяют три стадии патологии:
- I – пресаркопения, характеризуется снижением мышечной силы без снижения ее массы и функции;
- II – саркопения, характеризуется снижением скелетной мышечной силы, ее массы или функции;
- III – тяжелая саркопения, характеризуется снижением всех трех параметров – массы, силы и функции мышц.
Саркопения (миопения) нередко сочетается с нарушениями состава тела – сниженной костной массой (саркоостеопороз или остеосаркопения), повышенной жировой массой (саркопеническое ожирение) или характеризуется комбинацией этих изменений (остеосаркопеническое ожирение), что позволяет выделить фенотипические варианты этой патологии.
Нами представлено описание фенотипа остеосаркопенического ожирения, который характеризуется сочетанием сниженной мышечной массы и МПКТ с ожирением.
В качестве иллюстрации представлено клиническое наблюдение пациентки З., 68 лет, которая была проинформирована о целях исследования и предоставила письменное согласие на участие в исследовании и публикацию данных анонимно. Протокол обследования и используемые опросники были утверждены локальным этическим комитетом Российского национального исследовательского медицинского университета им. Н.И. Пирогова (протокол № 235 от 18.12.2023).
Клиническое наблюдение
Пациентка госпитализирована в гастроэнтерологическое отделение с жалобами на желтушность кожи, склер, выраженную общую слабость, отеки ног.
Считает себя больной в течение трех лет. Диагноз цирроза печени установлен в ноябре 2022 г.; периодически самостоятельно принимала гепатотропные препараты; у врача не наблюдалась. Длительно злоупотребляла крепкими алкогольными напитками, в настоящее время прием спиртосодержащих напитков отрицает. По данным теста AUDIT (Alcohol Use Disorders Identification Test) для выявления лиц с чрезмерным, вредным и опасным характером потребления алкоголя, получено 7 баллов (норма (N) < 7) [7]. В анамнезе более 10 лет: сахарный диабет второго типа (СД 2). Постоянно принимает метформин 500 мг. Артериальное давление не контролирует. Пенсионерка, имеет среднее медицинское образование, работала акушеркой.
При осмотре: индекс массы тела – 37,18 кг/м2 (ожирение второй степени). Обхват талии – 136 см, обхват бедер – 100 см. Состояние средней степени тяжести. Периферические отеки на голенях и стопах. Живот увеличен из-за асцита и подкожно-жировой клетчатки. На коже груди, щек имеются единичные телеангиоэктазии, пальмарная эритема. По органам дыхания и сердечно-сосудистой системы – без патологических изменений. Частота дыхательных движений – 20 в минуту. Артериальное давление – 120 и 70 мм рт. ст. Частота сердечных сокращений – 76 в минуту. Печень увеличена, размеры по Курлову – 12–9–8 см. Селезенка не пальпируется. Мочеиспускание свободное. Симптом поколачивания отрицательный с обеих сторон.
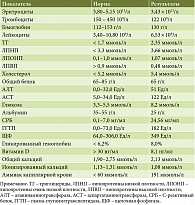
При лабораторном обследовании в общем анализе крови выявлена тромбоцитопения легкой степени тяжести (122 × 109/л). В биохимическом анализе крови отмечен минимальный цитолиз и холестаз, дислипидемия, снижение протромбина до 52% (N > 70%). Уровень витамина D составил 8,1 нг/мл, ионизированного кальция – 1,08 ммоль/л, общего кальция – 2,13 ммоль/л (табл. 1).
Ультразвуковое исследование брюшной полости: гепатоспленомегалия, дилатация селезеночной вены, свободная жидкость в брюшной полости. Компьютерная томография органов грудной клетки: инфильтративные воспалительные изменения в легких не выявлены. По данным эзофагогастродуоденоскопии обнаружены варикозно-расширенные вены пищевода (ВРВП) до 5 мм. Портальная гастродуоденопатия.
С учетом жалоб на слабость и повышенную утомляемость пациентке было предложено пройти опрос с использованием опросника SARC-F и шкалы FSS (Fatigue Severity Scale), по результатам которого была заподозрена саркопения, после чего диагноз был подтвержден результатами обследований, проведенных по определенному алгоритму [1].
Первым этапом для определения мышечной силы была выполнена кистевая динамометрия с максимальным результатом – 2 кг (N > 16), что позволило установить пресаркопению.
Следующим этапом выполнен биоимпедансный анализ состава тела (БИАСТ) для определения мышечной массы, оценки аппендикулярной скелетно-мышечной массы (АСММ) и индекса аппендикулярной скелетно-мышечной массы (ИАСММ). По данным БИАСТ, активное сопротивление составило 200 Ом, реактивное сопротивление – 92 Ом. Для расчета АСММ и ИАСММ нами была использована формула Sergi [8]. Установлено снижение мышечной массы (АСММ = 11,5 кг, ИАСММ = 5,4 кг/м2 (N > 5,5 кг/м2).
Далее пациентке была предложена батарея тестов SPPB (The Short Physical Performance Battery) для оценки мышечной функции. Зарегистрировано снижение мышечной функции – 2 балла (N > 7). Данные опросников и тестов представлены в табл. 2.
По результатам проведенного обследования был установлен диагноз тяжелой саркопении. С учетом возраста пациентки и наличия цирроза печени саркопения носит смешанный характер.
С целью диагностики печеночной энцефалопатии выполнен тест связи чисел, по результатам которого установлена печеночная энцефалопатия стадии II – 130 с (N < 40 с). Уровень аммиака капиллярной крови определяли путем одноволновой рефлексионной фотометрии с помощью портативного анализатора Pocket Chem: зарегистрирована гипераммониемия (см. табл. 1).
Для оценки состояния минеральной плотности костной ткани (МПКТ) проведена денситометрия; отмечено снижение МПКТ в области шейки левой бедренной кости до уровня остеопении (T-критерий = -2,0; BMD (bone mineral density) = 0,755 г/см2).
На основании жалоб пациентки, данных физикального осмотра, лабораторно-инструментального обследования выставлен диагноз: «цирроз печени смешанной этиологии (метаболически ассоциированная алкогольная болезнь печени (МетАБП)), класс С по Чайлд-Пью (10 баллов), MELD (Model for End-Stage Liver Disease) 23 балла. Портальная гипертензия: ВРВП второй степени, портальная гастродуоденопатия, спленомегалия, дилатация селезеночной вены, отечно-асцитический синдром. Печеночно-клеточная недостаточность: энцефалопатия смешанного генеза стадии II, коагулопатия, тромбоцитопения легкой степени тяжести, гипоальбуминемия. Тяжелая саркопения; остеопения; CД 2, целевой уровень гликированного гемоглобина – до 7,5%. Ожирение второй степени. Дислипидемия тип 2b по Фредриксону.
Обсуждение
За последние годы были определены возможные патогенетические механизмы, связывающие саркопению с жировой болезнью печени, а именно резистентность к инсулину, включая хроническое воспаление, гипераммониемию, дефицит питания, отсутствие физической активности, влияние миостатина и адипонектина, дефицит витамина D и другие [9].
У пациентки при определении аммиака капиллярной крови зарегистрирована гипераммониемия, которая является одним из значимых звеньев патогенеза саркопении. При неалкогольной жировой болезни печени (НАЖБП) уже на стадии стеатоза наблюдается диагностически значимая гипераммониемия [10]. Снижение активности ферментов уреазного цикла и последующая гипераммониемия при неалкогольном стеатогепатите могут способствовать развитию фиброза печени [11]. Аммиак индуцирует образование активных форм кислорода и пролиферацию звездчатых клеток, а также уменьшает активность эндотелиальной NO-синтетазы. Это приводит к прогрессированию фиброгенеза, нарушению внутрипеченочной гемодинамики и формированию портальной гипертензии [12], что является основанием для определения уровня аммиака в качестве важного маркера течения НАЖБП [13]. У пациентов с прогрессирующими ХЗП изменяется механизм обезвреживания аммиака: при снижении активности ферментов орнитинового цикла и глутаминсинтетазной реакции в печени, а также наличии портосистемных шунтов основную роль в детоксикации аммиака временно выполняют скелетные мышцы [9, 14].
Мышечная ткань является гормонально активной и регулирует рост мышечной массы и адипогенез. Миостатин, член семейства трансформирующего фактора роста бета (TGF-β), экспрессируется преимущественно в скелетных мышцах и является ингибитором роста миоцитов при гипераммонемии, индуцируя аутофагию и повреждение белковых структур [15–17].
Выявленная дислипидемия у пациентки может быть связана с повреждением мышц из-за повышенного синтеза свободных жирных кислот гипертрофированными адипоцитами, так как липиды имеют тенденцию накапливаться внутри мышечных клеток и между ними [18]. Это приводит к нарушению функции митохондрий (β-окисления жирных кислот) образованию активных форм кислорода, развитию резистентности к инсулину, липотоксичности и повышенному высвобождению провоспалительных цитокинов [19], в результате чего развивается хроническое воспаление, характеризующееся повышением уровня СРБ, что коррелирует с увеличением жировой массы и уменьшением тощей массы [20].
Кроме того, у пациентки отмечено снижение МПК, что также тесно связано с саркопенией и ожирением. Установлено, что уменьшение тощей (обезжиренной) массы тела ассоциировано со снижением МПК и более высоким риском переломов [20]. По данным исследований, костно-мышечное взаимодействие регулируется биологически активными веществами, синтезируемыми костной и мышечной тканью [21, 22]. К ним относятся витамин D, гормон роста, инсулиноподобный фактор роста, тестостерон, а также эстрогены, глюкокортикоиды, гормоны щитовидной железы, инсулин, лептин и адипонектин.
Напротив, H. Kumagai и соавт. показали, что блокирование миостатина значительно увеличивает мышечную массу, улучшает чувствительность к инсулину и защищает от стеатоза печени [23]. Таким образом, миостатин, инсулинорезистентность и фиброгенез печени взаимосвязаны [24]. Вместе с тем ирисин – миокин, индуцируемый физической нагрузкой, обратно связан со степенью жировой инфильтрации печени у пациентов с ожирением [25]. Определение миокинов может выступать в качестве предикторов саркопении на ранних этапах ее развития.
В нашем наблюдении у пациентки установлено выраженное снижение уровня витамина D. Известно, что он играет важную роль в миогенезе, пролиферации и росте клеток скелетных мышц [26, 27], оказывая свое влияние через ядерный рецептор витамина D (VDR), который экспрессируется в печени и скелетных мышцах [28]. Снижение экспрессии VDR в результате дефицита витамина D и старения способствует развитию саркопении. Исследования M. Visser и соавт. показали, что при саркопении наблюдается значительное уменьшение уровня витамина D (более 6,50 нг/мл) [29]. Однако профилактический прием витамина D увеличивает экспрессию VDR в скелетных мышцах, что может замедлять развитие саркопении [30]. Дефицит витамина D усиливает инсулинорезистентность (ИР) вследствие нарушенной регуляции рецепторов генов ИР в печени, а также воспаление и окислительный стресс. Эти патогенетические механизмы играют значимую роль в развитии саркопении и прогрессировании НАЖБП, сопровождающихся апоптозом гепатоцитов и фиброзом печени [31, 32].
Недостаток физической активности также приводит к потере мышечной массы и снижению расхода энергии, что способствует ожирению и стеатозу печени [33, 34]. И саркопения, и НАЖБП прогрессируют на фоне хронического воспаления, окислительного стресса и ИР.
В соответствии с новой классификацией ЖБП, принятой в 2023 г., введен термин МетАБП для пациентов с наличием кардиометаболических рисков и повышенным потреблением алкоголя в анамнезе [35]. В представленном клиническом наблюдении у пациентки имеются четыре из пяти кардиометаболических рисков, а также прием спиртосодержащих напитков в гепатотоксичных дозах (AUDIT – 7 баллов) в анамнезе, что позволяет установить диагноз МетАБП.
По сравнению с НАЖБП, МетАБП связана с более высоким риском выраженного фиброза, смертности, связанной с сердечно-сосудистыми заболеваниями, но при этом МетАБП характеризуется менее выраженным стеатозом [36, 37]. А сочетание саркопении и остеопороза способствует увеличению риска переломов и преждевременной смерти пациентов [38]. Также J. Moon и соавт. показали, что сочетание НАЖБП и саркопении повышают риск смертности в два раза [39].
В исследовании T. Suzuki и соавт. [40] показано, что начало употребления алкоголя связано со снижением уровня ЛПНП и повышением ЛПВП, в то время как прекращение употребления алкоголя продемонстрировало противоположную связь (увеличение уровня ЛПНП и снижение ЛПВП).
Хотя механизмы, с помощью которых алкоголь влияет на уровень липидов, остаются неясными, употребление алкоголя в небольших количествах может оказывать потенциально благоприятное воздействие на липидный профиль [41]. Следует помнить, что решение о его употреблении должно приниматься индивидуально с учетом общих рисков для здоровья и, кроме того, после прекращения употребления алкоголя необходимо тщательно контролировать уровень липидов, чтобы снизить потенциальные риски сердечно-сосудистых заболеваний.
Заключение
Ранняя диагностика саркопении имеет важное значение, необходима визуализация, динамометрия и тестирование физической работоспособности для оценки ее составляющих: мышечной массы, мышечной силы и мышечной функции соответственно. Кроме того, целесообразно проведение обследования пациентов с целью определения фенотипа саркопении, так как это позволит комплексно воздействовать на различные звенья патогенеза данного состояния.
С учетом тесной взаимосвязи между ожирением и НАЖБП ограничение энергетической ценности в сочетании с физическими упражнениями – эффективная стратегия для прерывания «порочного круга» саркопении и НАЖБП [10].
Рекомендуемая тактика ведения саркопении является мультимодальной. Основной стратегией профилактики и лечения саркопении является изменение образа жизни, воздействие на такие факторы, как нарушение питания, гипераммониемия, резистентность к инсулину и дислипидемия.
При остеосаркопеническом ожирении целесообразно применение диетических стратегий, направленных на увеличение потребления белка, снижение общей энергетической ценности рациона, правильного соотношения макронутриентов.
Тренировки с включением силовых нагрузок улучшают физическую силу и мышечную массу благодаря увеличению размера мышечных волокон второго типа и привлечению мышц-сателлитов. Аэробные упражнения ремоделируют миофибриллы и улучшают кардиореспираторную функцию [42]. Во время физических упражнений снижается синтез провоспалительных цитокинов, а выработка противовоспалительных цитокинов, синтез мышечного белка, восстановление и поглощение глюкозы увеличиваются. Таким образом, физическая активность снижает риск прогрессирования саркопении [43].
В доклинических исследованиях изучаются новые фармакологические средства (например, ингибиторы миостатина, тестостероновые добавки и терапия, снижающая уровень аммиака), однако в настоящее время не существует одобренных фармакологических вмешательств для лечения саркопении.
I.G. Adamova, B.M. Taraki, A.G. Adamova, I.G. Fedorov, PhD, O.O. Manuilova, PhD, I.G. Pshennikova, L.Yu. Ilchenko, PhD, Prof., I.G. Nikitin, PhD, Prof.
Pirogov Russian National Research Medical University, Moscow
Dagestan State Medical University, Makhachkala
V.M. Buyanov City Clinical Hospital, Moscow
Contact person: Imara G. Adamova, miss.imara@mail.ru
The article discusses the osteosarcopenic obesity phenotype which is manifested by the decreased muscle mass and strength combined with the decreased bone mineral density in an obese patient. The authors also discuss pathogenetic mechanisms linking sarcopenia with non-alcoholic fatty liver disease, including insulin resistance, obesity, chronic inflammation, and hyperammonemia. The role of myostatin and other myokines, vitamin D deficiency in the regulation of muscle mass, adipogenesis and myogenesis are discussed as well. The relationship of dyslipidemia with muscle damage and the importance of physical activity to prevent muscle loss are underlined too. In the conclusion, the article highlights the importance of early sarcopenia diagnostics and of a comprehensive approach to its treatment, including lifestyle changes, physical training, and pharmacological interventions.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.