Сухость влагалища: молекулярно-биологические и сексологические аспекты
- Аннотация
- Статья
- Ссылки
- English
Стенки влагалища в физиологическом состоянии покрыты тонким слоем слизи [1]. При сексуальном возбуждении в гениталиях происходит нейрососудистая реакция, проявляющаяся увеличением клиторального и вагинального кровотока, вазоконгестией, генитальным нагрубанием и любрикацией в виде 3–5 мл влагалищного транссудата [2].
Сухость влагалища – состояние слизистой оболочки влагалища, при котором снижается способность к нормальному выделению естественного секрета, что сопровождается дискомфортом, болью при половом контакте, зудом и жжением в области вульвы, склонностью к образованию микротрещин и легкой кровоточивости [3, 4].
Среди наиболее распространенных причин вагинальной сухости – гормональный дисбаланс в пре- и постменопаузе, состояние после овариэктомии и других оперативных вмешательств на органах мочеполовой системы, дерматологические заболевания, инфекции мочевых путей или влагалища, иммунные расстройства, радиационная терапия, химиотерапия, прием некоторых медикаментов, в том числе антиэстрогенных препаратов и антидепрессантов, использование гигиенических средств [5–10].
Строение стенки влагалища
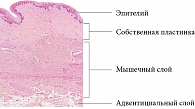
Стенка влагалища имеет толщину 3–4 мм, структурно состоит из трех слоев: слизистой оболочки (представлена эпителиальным слоем и собственной пластинкой, содержащей кровеносные сосуды), мышечного и адвентициального слоев [1]. Слизистая оболочка влагалища почти на всем протяжении плотно сращена с мышечной, имеет поперечные складки, которые обеспечивают значительную растяжимость. Между слизистой и мышечной оболочками в области поперечных складок залегает тонкая губчатая оболочка (рис. 1).
Эпителий слизистой оболочки влагалища – некератизированный многослойный плоский, лишенный желез. Состоит из базального, промежуточного и поверхностного слоев, непрерывно обновляющихся вследствие процессов пролиферации, дифференцировки и созревания, которые регулируются эстрогенами [11, 12].
Обычно вагинальный эпителий увлажнен жидкостью, происходящей из субэпителиальной области стенки влагалища, содержащей плотную сеть капилляров [13]. Основной источник вагинальной жидкости – плазма, которая активно трансфундирует из капилляров [14].
Влагалищный секрет представляет собой сложную биологическую жидкость, состоящую из воды, электролитов, низкомолекулярных органических соединений (глюкозы, липидов и аминокислот), некоторых белков, ферментов, а также клеток (эпителиальных клеток, лейкоцитов и лимфоцитов) [15].
Механизмы секреции вагинальной жидкости
Аквапорины
Существуют два маршрута транспортировки секрета в эпителии влагалища: трансклеточный и парацеллюлярный [16–18].
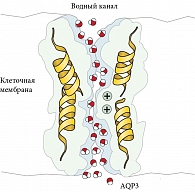
Трансклеточный транспорт жидкости из капилляров во влагалище осуществляется через аквапорины (AQP) (рис. 2) [19]. Аквапорины принадлежат к семейству гидрофобных интегральных мембранных белков, которое включает в себя более 450 белков микроорганизмов, растений и животных [20]. В настоящее время известно 13 человеческих аквапоринов. Одни функционируют как водопроводящие каналы (например, AQP1, AQP2, AQP4, AQP5 и AQP8). Другие, называемые акваглицеропоринами, проницаемы не только для воды, но и для малых нейтральных растворенных веществ, таких как глицерин, оксид углерода, мочевина (например, AQP3, AQP7, AQP9 и AQP10) [20]. Аквапорины находятся во многих тканях, участвуют в трансэпителиальном транспорте жидкости, концентрации мочи, выделении жидкости из желез и т.д. [21, 22]. Хотя аквапорины облегчают трансмембранное проникновение воды и малых нейтральных растворенных веществ, они исключают проведение протонов, обеспечивая быструю диффузию воды по осмотическому градиенту без рассеивания электрохимических потенциалов [23].
S.O. Kim и соавт. с помощью вестерн-блоттинга и иммуногистохимии изучали локализацию и экспрессию аквапоринов в вагинальной ткани у женщин в пременопаузе [17]. Исследование показало, что они распределены неравномерно: в капиллярах и венулах влагалища в основном обнаружены AQP1, в цитоплазме эпителия – AQP2. AQP3 был главным образом связан с клеточной мембраной эпителия влагалища, а AQP5 и AQP6 были выражены в цитоплазме всего вагинального эпителия. Не были обнаружены AQP4, AQP7, AQP8 и AQP9. Таким образом, по мнению авторов, аквапорины 1, 2, 3, 5 и 6 могут играть важную роль в процессе вагинальной любрикации.
Известно, что ретиноевая кислота – активный регулятор секреции жидкостей тела человека. Природный метаболит ретинола полностью трансретиноевая кислота (All-Trans Retinoic Acid – ATRA) – важный медиатор биологических процессов в организме (дифференцировки, пролиферации, апоптоза, эмбриогенеза, репродукции), а также иммуноопосредованных противовоспалительных эффектов [24]. ATRA – мощный стимулятор пролиферации кератиноцитов в коже, участвует в дифференцировке и пролиферации вагинального эпителия [25].
H.S. Lee и соавт. изучили влияние ATRA на экспрессию AQP3 в эпителиальных клетках влагалища человека. Они обнаружили, что ATRA увеличивает экспрессию белка и уровни мРНК AQP3 дозозависимым образом. Кроме того, ATRA увеличивает экспрессию белка ATRA-рецептора-альфа [26].
Практически во всех живых клетках, кроме аквапоринов, находятся и хлоридные каналы, играющие важную роль в клеточной пролиферации, миграции и апоптозе [27]. Было выявлено, что акваглицеропорин AQP3 и хлоридные каналы 3 могут образовывать комплексы для регулирования объема клеток [28].
H. Zhang и соавт. исследовали роль AQP3 в их гетерокомплексах. Было установлено, что глицерин поступал в клетки через AQP3 и индуцировал два разных тока ионов хлора: через трансклеточные, зависимые от набухания, и независимые от клеточной поверхности пути. Авторы пришли к выводу, что взаимодействие между AQP3 и хлоридными каналами 3 играет важную роль в регуляции объема клеток и что AQP3 может быть модулятором, который открывает регулируемые по объему хлоридные каналы [29].
T. Kunovac Kallak, используя масс-спектрометрию, радиоиммунологический анализ, иммуногистохимию, технологию ДНК микрочипов, количественную ПЦР в реальном времени, показала, что эстрадиол повышает экспрессию AQP3, в то время как анастрозол, ингибитор ароматазы, ее уменьшает, что свидетельствует об эстрогенной регуляции AQP3 в вагинальном эпителии [30].
Плотные контакты
Внеклеточная проницаемость эпителия также является ключевым фактором любрикации влагалища. Парацеллюлярный перенос жидкости регулируется сопротивлением эпителиальных плотных контактов и эпителиального поперечного межклеточного пространства посредством взаимодействия внеклеточных петель трансцеллюлярных белков [31].
Плотные контакты состоят из сети трансмембранных белков, таких как окклюдин, клаудины и молекулы адгезии [32]. Эти контакты связаны с цитоскелетом белками zonula occludens (ZO), которые служат для них регуляторными белками [33]. Плотные контакты закрывают пространство между соседними эпителиальными клетками и препятствуют свободному движению молекул через парацеллюлярное пространство [34].
Входы плотного соединения имеют относительно высокое сопротивление, которое определяется степенью окклюзии межклеточного пространства посредством взаимодействия внеклеточных петель трансцеллюлярных белков плотного соединения [35]. Трансмембранные белки ограничивают парацеллюлярную диффузию молекул через эпителиальный слой [32].
В работе H. Schlüter и соавт. было продемонстрировано, что белки плотных контактов (окклюдин, клаудин и ZO-1) экспрессируются в более базальных слоях эпителия, где образуют особые соединительные структуры клеток [36]. В апикальных слоях вагинального эпителия плотные контакты не обнаружены. Они локализовались в базальном и промежуточном слоях эпителия [33].
В регуляции проницаемости эпителия влагалища важную роль играют эстрогены. В эксперименте с использованием нормальных человеческих эпителиальных вагинально-эктоцервикальных клеток у женщин в пре- и постменопаузе было показано, что общая проницаемость эпителия снижается после менопаузы и приводит к уменьшению транссудации плазмы и снижению содержания вагинального секрета [35]. Эстрогены контролируют трансфузию жидкости, уменьшая сопротивление капилляров, вследствие чего увеличивается кровоток и гидростатический градиент.
Железы преддверия влагалища
Наряду с клеточными и внеклеточными механизмами в увлажнении слизистой участвуют большие и малые железы преддверия влагалища.
Парные бартолиновы железы (бульбовагинальные, большие вестибулярные железы) гомологичны бульбоуретральным железам у мужчин, имеют гороховидную форму, до 0,5 см в диаметре, расположены в толще больших половых губ у их основания. Они примыкают к заднему концу луковицы преддверия влагалища – разделенного на две части венозного сплетения [1].
Бартолинова железа имеет трубчато-альвеолярное строение. Выводной проток бартолиновой железы длиной 1,5–2,5 см открывается на внутренней поверхности малой половой губы, на границе средней и задней ее трети. При сексуальном возбуждении бартолиновы железы выделяют прозрачный вязкий, содержащий муцин и полисахариды секрет, поддерживающий увлажненность слизистой оболочки входа во влагалище. Функция бартолиновых желез регулируется эстрогенами, поэтому они наиболее активны в репродуктивном периоде [37].
Малые вестибулярные железы преддверия влагалища (железы Скина, парауретральные железы) значительно варьируются в размерах, гомологичны предстательной железе мужской репродуктивной системы, расположены в передней стенке влагалища вокруг нижнего конца уретры [38–40]. Выводные протоки желез Скина открываются слева и справа от отверстия уретры. Они окружены кавернозной тканью, представляющей собой часть клитора, простирающейся во влагалище и наполняемой кровью во время полового возбуждения. Считается, что секрет, который вырабатывают железы Скина, обладает антимикробными свойствами и служит для защиты мочевыводящих путей от инфекций.
Железы Скина производят простатический специфический антиген и простатические кислые фосфатазы, идентичные продуцируемым предстательной железой у мужчин. В их секрете также обнаружены человеческий мочевой белок 1 (P1) и фермент фосфодиэстераза пятого типа в более низких концентрациях, чем у мужчин [41, 42].
Железы Скина связывают со спорным в настоящее время феноменом «женской эякуляции» [43]. Было продемонстрировано, что при интенсивной вагинальной стимуляции, приводящей к ярко выраженному оргазму, из этих желез может секретироваться большое количество жидкости («струйный оргазм») [44]. Активно ведется дискуссия по поводу характера выделений: есть мнение о том, что это вещество – моча, а само явление не что иное как непроизвольная потеря мочи при оргазме.
G.L. Gravina и соавт. обнаружили прямую и значимую корреляцию между толщиной уретровагинального пространства и вагинальным оргазмом и предложили ультразвуковое исследование как инструмент для изучения анатомической изменчивости клитороуретровагинального комплекса, также известного как G-пятно, связывая ее со способностью женщин испытывать вагинально активированный оргазм [45]. В связи с несовершенством использовавшихся технических средств их выводы подвергли критике С. Battaglia и соавт. [39]. Они провели двухмерное, трехмерное ультразвуковое исследование и цветное допплеровское сканирование клитороуретровагинального пространства во время ранней фолликулярной фазы менструального цикла у женщин с наличием и отсутствием вагинального оргазма. Авторы показали, что в уретровагинальном пространстве находится железистая ткань, его объем коррелирует со временем последнего полового акта и уровнем тестостерона в сыворотке крови.
Эстроген и его рецепторы
Хорошо известно разнообразное воздействие эстрогенов на урогенитальную ткань у женщин (созревание клеток, поддержание низкого уровня вагинального рН, любрикация, вагинальный кровоток). Эстроген влияет на поддержание плотности гладких мышц стенки влагалища, морфологию кровеносных сосудов и плотность нервных окончаний в эпителии слизистой [46].
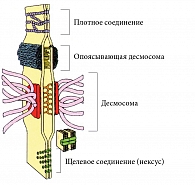
Для защиты от патогенных агентов кроме низкого рН необходимы и другие механизмы барьерной функции эпителия влагалища, например межклеточная адгезия. Элементы межклеточного соединения (десмосомы, соединения сцепления и плотные соединения) преобладают в базальном и промежуточном слоях эпителия, их количество уменьшается в поверхностном эпителиальном слое (рис. 3) [47].
Основной механизм эстрогенного контроля эпителиального транспорта – модуляция проницаемости эпителия за счет регулирования сопротивления межклеточных плотных соединений и бокового межклеточного пространства. Эстроген уменьшает сопротивление плотных контактов, вызывая деградацию внеклеточных петель белка окклюдина [48].
K.J. Oh и соавт. изучили влияние эстрогена на локализацию плотных контактов и модуляцию экспрессии ZO-1, окклюдина и клаудина 1 в эпителии влагалища крысы иммуногистохимическим методом и вестерн-блоттингом [49]. 45 самок были разделены на три группы: первой (контрольной) группе была проведена ложная операция, второй – двусторонняя овариэктомия, третьей – двусторонняя овариэктомия с дальнейшим ежедневным подкожным введением 17-бета-эстрадиола (50 мкг/кг/сут). Исследование показало диффузную экспрессию ZO-1 во всех группах, причем наибольшая интенсивность выявлена в поверхностном эпителии в контрольной группе. Окклюдин был локализован в промежуточном и базальном эпителии, а клаудин 1 был наиболее интенсивным в поверхностном слое вагинального эпителия в контрольной группе. Экспрессия ZO-1, окклюдина и клаудина 1 значительно уменьшилась после овариэктомии и была восстановлена до уровня контроля после замещения эстрогена. Таким образом, депривация эстрогена приводила к существенному снижению регуляции экспрессии плотных контактов, а замещение эстрогена у крыс с удаленными яичниками – к активизации белков плотного соединения до контрольного уровня, что убедительно демонстрирует важную роль эстрогена в модуляции экспрессии плотного соединения.
Синтез половых стероидов контролируется несколькими ферментами, катализирующими синтез андрогенов (17-альфа-гидроксилаз цитохрома P450) и эстрогенов (ароматаза цитохрома Р450). В ряде исследований обнаружена экспрессия ферментов стероидогенеза в вагинальной ткани, что предполагает локальный синтез половых стероидов [50]. A.C. Dos Santos и соавт. с помощью иммуногистохимического анализа и вестерн-блоттинга на животной модели установили, что экспрессия половых стероидогенных ферментов в эпителии влагалища изменяется в зависимости от стадии эстрального цикла. При этом изменяется как уровень клеток, проявляющих экспрессию, так и их типы. Таким образом, по мнению авторов, изменения в пролиферации вагинальных эпителиальных клеток и дифференциация слизистой оболочки могут зависеть от местного синтеза стероидов, а также от циркулирующих андрогенов и эстрогенов [50].
Эффекты эстрогенов и других половых стероидов опосредуются рецепторами, которые относятся к ядерному суперсемейству. Оно включает 18 рецепторов, разделенных на два класса. Рецепторы эстрогена альфа и бета, рецепторы прогестерона А и Б, рецептор андрогена А относятся к классу I рецепторов ядерного ядра [51]. Эти рецепторы – индуцибельные транскрипционные факторы. Когда половые стероиды диффундируют через клеточную мембрану и соединяются с рецепторами, происходит выделение тепловой энергии и образование шоковых белков, которые генерируют сигнал транслокации ядра, помогая гормон-рецепторному комплексу транслоцироваться в ядро. Стероидный гормон-рецепторный комплекс вместе с коактиваторами и/или супрессорами действуют на ДНК, влияя на транскрипцию мРНК, определяя последующую экспрессию гена и клеточный ответ [52].
Стероидные гормоны взаимодействуют и с неядерными рецепторами, такими как G-белок рецептора эстрогена, который локализуется в эндоплазматическом ретикулуме, и мембранный компонент прогестеронового рецептора 1. Они частично отвечают за быстрое негеномное действие эстрадиола и прогестерона, внося вклад в комплексные эффекты стероидных гормонов на ткани-мишени [53].
Толщина промежуточного и поверхностного слоев эпителия зависит от процессов пролиферации. Высокий уровень пролиферации, который отражает высокая экспрессия маркера Ki 67, совпадает с высоким уровнем эстрогена в сыворотке крови [54].
Тканеспецифические эффекты селективных модуляторов эстрогеновых рецепторов: влияние на состояние влагалища
Тамоксифен, селективный модулятор рецептора эстрогена, обладающий эстрогенной и антиэстрогенной активностью, широко используется в качестве адъювантной терапии у больных раком молочной железы. Лечение тамоксифеном ассоциируется с сексуальными побочными эффектами, такими как увеличение вагинальной сухости, боль и дискомфорт во время сексуальной активности.
N.N. Kim и соавт. изучали влияние тамоксифена на физиологию влагалища [55]. Самок крыс подвергали мнимой хирургии или двусторонней овариэктомии. Через две недели оперированным крысам имплантировали подкожно осмотические инфузионные насосы, содержащие носитель (контроль) или тамоксифен (150 мкг/сут). Еще через две недели измерялись вагинальные реакции притока крови при стимуляции тазового нерва с помощью лазерной допплеровской флоуметрии, вагинальные ткани собирали для гистологического и биохимического анализа. При введении тамоксифена в плазме крови концентрации эстрадиола не изменялись по сравнению с контрольной группой, в то время как у овариэктомированных крыс уровень эстрадиола в плазме уменьшался на 60%. Введение тамоксифена вызывало существенное уменьшение среднего веса матки, но не изменяло среднего веса влагалища. Вагинальный кровоток у животных, получавших тамоксифен, был значительно ниже. У них, подобно овариэктомированным животным, было увеличено связывание рецепторов эстрогена и снижена активность фермента аргиназы. Однако в отличие от животных в группе контроля и животных с удаленными яичниками их вагинальный эпителий больше производил соединений, богатых углеводами (муцин, гликоген).
A.R. Nery-Aguiar и соавт. выявили увеличение экспрессии белка Ki-67 и пролиферации клеток слизистой оболочки влагалища у кастрированных крыс на фоне введения тамоксифена, что подтверждает его частично эстрогенное действие [54].
Оспемифен, как и тамоксифен, – селективный модулятор рецептора эстрогена. В настоящее время он одобрен для лечения диспареунии, связанной с вульвовагинальной атрофией в постменопаузе [56]. Влияние оспемифена на массу и толщину вагинального эпителия оценивалось на животной модели менопаузы [57]. Крысы получали перорально оспемифен в количестве 10, 30 или 100 мг/кг в течение двух – четырех недель. Все дозы оспемифена как через четыре, так и через две недели привели к значительному увеличению массы тела и толщины вагинального эпителия у крыс основной группы. Результаты в группе оспемифена существенно не отличались от результатов в группе сравнения (введение этинилэстрадиола), что указывает на то, что оспемифен – полноценный агонист эстрогена.
Любриканты как местные средства при сухости влагалища
При вульвовагинальной атрофии, генитоуринарном синдроме и других состояниях, ассоциированных с сухостью влагалища, назначается эффективная стандартная терапия – вагинальное введение эстрогена. Женщинам, желающим избежать гормональной терапии, показаны такие увлажняющие средства, как любриканты [58]. Они обеспечивают временное облегчение при сухости влагалища и диспареунии и не имеют долгосрочных терапевтических эффектов, однако они безопасны, эффективны, доступны и легки в применении [59]. В исследовании 2013 г. (2451 женщина в возрасте от 18 до 68 лет) девять из десяти респонденток предпочитали применять любриканты для устранения сухости во время половых контактов [60]. Любриканты на водной основе – самые универсальные из всех типов увлажняющих вагинальных средств, поскольку безопасны, в том числе при использовании барьерных контрацептивных средств (презервативы, диафрагмы) [61].
Заключение
Сухость влагалища – распространенное патологическое состояние его слизистой, связанное с гормональным дисбалансом, возрастом, дерматологическими заболеваниями, радиационной и химиотерапией, приемом антиэстрогенных препаратов и др. Увлажненность влагалища обусловлена эстрогензависимыми трансклеточными и внеклеточными механизмами транспортировки секрета в эпителии влагалища. При сексуальной стимуляции наряду с этими механизмами адекватная любрикация обеспечивается активацией функции бартолиновых желез и желез Скина. Таким образом, физиологическое состояние влагалища поддерживается прежде всего наличием эстрогенов, оказывающих разнообразное биологическое воздействие на урогенитальную ткань.
Селективные модуляторы эстрогеновых рецепторов как агонисты эстрогена оказывают пролиферирующее действие на эпителий влагалища, препятствуя развитию атрофии и сухости. Стандартная эффективная терапия состояний, ассоциированных с сухостью влагалища, подразумевает интравагинальное введение эстрогена. Женщинам, желающим избежать гормональной терапии, можно рекомендовать использовать такие увлажняющие средства, как любриканты.
N.N. Stenyaeva, A.M. Krasny, V.Yu. Grigoryev
National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov, Moscow
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Contact person: Natalya Nikolayevna Stenyaeva, nataliasten@mail.ru
Complaints related to vaginal dryness (discomfort, itching and burning sensation in the vulva, dyspareunia) are widespread in women of the reproductive and postmenopausal age. The purpose of this review is to give a detailed description of the mechanisms of vaginal moisturizing, estrogenic control of aqueous epithelial transport. The article deals with molecular transcellular and paracellular mechanisms of secretion of vaginal fluids, the role of the vestibular glands in the moistening of the genital tract during sexual stimulation and the tissue-specific effects of selective estrogen receptor modulators on the vagina.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.