количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
XIX ежегодный конгресс «Гепатология сегодня». Тройная терапия хронического гепатита С с боцепревиром: от общих принципов к конкретному пациенту
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №2 (28)
- Аннотация
- Статья
- Ссылки
Хронический гепатит С (ХГC) – заболевание, в основе которого лежит инфицирование и поражение печени вирусом гепатита C, что морфологически проявляется воспалительными, некротическими и фибротическими изменениями ткани печени различной степени тяжести. ХГC опасен тем, что может привести к развитию цирроза печени и гепатоцеллюлярной карциноме. Актуальность проблемы лечения заболевания связана с его высокой распространенностью. Сегодня терапия ХГC переходит на новый уровень: в практику внедряются препараты, обладающие прямым противовирусным действием. Как показали результаты клинических исследований, включение в схему противовирусной терапии ингибиторов протеаз, таких как боцепревир и телапревир, позволяет значительно увеличить частоту достижения устойчивого вирусологического ответа как у первичных больных ХГС, так и у больных, не ответивших ранее на стандартную двойную терапию. Принципам тройной терапии ХГC с использованием препарата боцепревир был посвящен симпозиум, прошедший в рамках XIX ежегодного конгресса «Гепатология сегодня» (Москва, 26 марта 2014 г.) и организованный при поддержке компании MSD.

Профессор П.П. Огурцов
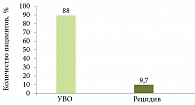
Рис. 1. Влияние БВО на сокращение сроков лечения до 24 недель при низкой виремии
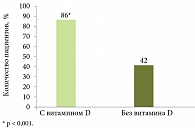
Рис. 2. Удвоение частоты УВО у пациентов, получавших витамин D

Рис. 3. Обобщенные результаты клинических исследований III фазы боцепревира и телапревира в лечении пациентов с ХГC, ранее не получавших ПВТ
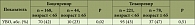
Таблица. Эффективность тройной терапии ингибиторами протеаз первого поколения (результаты исследования CUPIC)

К.м.н. Э.З. Бурневич
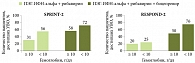
Рис. 4. Анемия как положительный прогностический фактор ответа на тройную ПВТ с использованием боцепревира у больных ХГC

Рис. 5. Применение эритропоэтина-альфа при двойной ПВТ не влияет на частоту достижения УВО

Рис. 6. Влияние различных вариантов лечения анемии при тройной ПВТ с боцепревиром на частоту достижения УВО
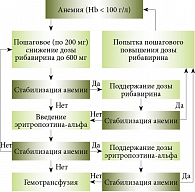
Рис. 7. Алгоритм коррекции анемии при тройной ПВТ ХГС с боцепревиром
От клинических исследований к практике: алгоритмы лечения хронического гепатита C с боцепревиром
Выступление руководителя Центра изучения печени медицинского факультета Российского университета дружбы народов (РУДН), д.м.н., профессора, заведующего кафедрой госпитальной терапии Павла Петровича ОГУРЦОВА было посвящено проблемам лечения больных хроническим гепатитом C (ХГC).
По словам докладчика, несмотря на появление новых препаратов прямого действия – ингибиторов протеаз и полимераз, «золотым стандартом» лечения ХГC в нашей стране остается комбинированная противовирусная терапия пегилированным интерфероном (ПЭГ-ИФН) и рибавирином. К сожалению, новые препараты не сразу становятся доступными во всех регионах России.
Быстрый вирусологический ответ (БВО) имеет большое прогностическое значение и подразумевает отрицательный тест на РНК вируса гепатита С (ВГC) в крови после четырехнедельной терапии. Достижение БВО служит предиктором наступления устойчивого вирусологического ответа (УВО) независимо от генотипа вируса и способов лечения. УВО считается надежным критерием элиминации вируса из организма.
Динамику наступления УВО при различных схемах лечения ХГC и уровнях вирусологического ответа изучали в ряде исследований. Так, в исследовании PREDICT пациенты с генотипом 1 вируса ХГC с вирусной нагрузкой < 600 000 МЕ/мл получали ПЭГ-ИФН-альфа-1b в дозе 1,5 мкг/кг/нед и рибавирин в течение 24 недель. Согласно полученным данным благоприятные результаты лечения (УВО наблюдался у 88% пациентов) при наличии БВО служат основанием для сокращения длительности терапии в случае низкой виремии (рис. 1)1.
Профессор П.П. Огурцов подчеркнул важность вводного периода (lead-in) в схеме лечения больных ХГC. Введение этого периода позволяет не только достичь стабильного состояния больного, но и определить оптимальную тактику последующей терапии. Достижение БВО в течение вводной фазы (четыре недели двойной стандартной терапии) – лучший способ выбрать двойную терапию как достоверно эффективную и избежать тройной терапии ХГC. Согласно последним данным у больных с генотипом 1 вируса ХГC (ХГC-1) БВО определяется в 25–35% случаев в целом, а у больных с ХГC-1 и низким уровнем вирусологического ответа (< 600 000 МЕ/мл) – в 49%. Причем в последнем случае при коротком 24-недельном курсе терапии УВО достигают 89% пациентов2.
Отрицательными некорригируемыми факторами, снижающими вероятность достижения УВО при терапии у пациентов с ХГC, являются высокий уровень вирусной нагрузки (> 600 000 МЕ/мл), возраст старше 40 лет, мужской пол, 1-й и 4-й генотипы ВГC, фиброз 3–4-й стадии (F3–F4), Т-аллель по нуклеотидной последовательности rs12979860 гена интерлейкина (ИЛ) 28. Корригируемые факторы – избыточная масса тела, приверженность лечению, синдром перегрузки железом.
Профессор П.П. Огурцов заметил, что на сегодняшний день недостаточно изучено влияние инсулинорезистентности и дефицита витамина D на снижение вероятности УВО у больных ХГC. Для оценки инсулинорезистентности используют гомеостатическую модель – индекс HOMA-IR (Homeostasis model assessment of insulin resistance), рассчитываемый следующим образом: инсулин мкМЕ/мл × глюкоза ммоль/л : 22,5. О наличии инсулинорезистентности говорят при индексе HOMA-IR ≥ 2. Повышение HOMA-IR ассоциируется с худшим ответом на терапию. Именно поэтому коррекция инсулинорезистентности рассматривается как одна из новых целей терапии гепатита С. Доказано, что увеличению частоты УВО при ХГC-1 и инсулинорезистентности способствует комбинация метформина, ПЭГ-ИФН-альфа-2а и рибавирина3.
Инсулинорезистентность нередко имеет место при ХГC-1. В исследовании, проведенном в Центре изучения печени медицинского факультета РУДН, участвовали 211 больных ХГC всех генотипов в московской популяции: 106 (51%) пациентов с инсулинорезистентностью, 105 (49%) пациентов без нее. В ходе исследования оценивали эффективность противовирусной терапии (ПВТ) ПЭГ-ИФН-альфа-2b и рибавирином у пациентов с ХГC-1 и инсулинорезистентностью, получавших и не получавших метформин. Эффект в группе коррекции метформином достигался в 64% случаев против 42% у больных, не получавших его (р = 0,005). Коррекция инсулинорезистентности метформином оправданна, начиная со значений HOMA-IR 2, при любом генотипе и значительно улучшает результаты ПВТ ПЭГ-ИФН-альфа-2b и рибавирином, особенно у пациентов с низкой и нормальной массой тела. Доказано, что метформин в качестве третьего компонента ПВТ (ПЭГ-ИФН-альфа-2b и рибавирин) эффективен и безопасен4.
Далее профессор П.П. Огурцов коснулся взаимосвязи дефицита витамина D и исхода ПВТ у первичных больных ХГC-1. Так, отмечена четырехнедельная динамика восстановления нормального уровня витамина D в ходе терапии ПЭГ-ИФН-альфа-2b и рибавирином с дополнительным приемом витамина D3 (2000 МЕ/д). Частота УВО возрастала в два раза в группе больных, применявших витамин D (рис. 2)5.
Нормальный уровень витамина D является независимым позитивным предиктором БВО (64%) и УВО (76%) при ПВТ ХГC6. Витамин D3 повышает чувствительность ВГC-инфицированных гепатоцитов к терапии ПЭГ-ИФН-альфа и рибавирином за счет экспрессии ИФН-стимулирующих генов и снижения продукции ИФН-гамма-индуцируемого белка-10 мононуклеарными клетками периферической крови7.
Максимизация эффективности терапии ПЭГ-ИФН-альфа и наличие вводного периода позволяют выделять кандидатов для тройной терапии ХГC с применением ингибиторов протеаз. Считается, что ингибиторы протеаз уничтожают вирус, препятствуя расщеплению вирусного белка на структурные компоненты.
Два препарата – боцепревир и телапревир, ингибиторы NS3/4A протеазы ВГC, одобрены FDA (Food and Drug Administration – Управление по контролю за пищевыми продуктами и лекарственными препаратами США) и EMA (European Medicines Agency – Европейское медицинское агентство) в середине 2011 г. для лечения пациентов с ХГC-1. Назначение боцепревира или телапревира в комбинации с ПЭГ-ИФН и рибавирином стало новым стандартом терапии ХГC-1. На текущий момент завершено несколько исследований, посвященных изучению тройных схем ПВТ с применением боцепревира и телапревира (рис. 3).
В рандомизированном двойном слепом плацебоконтролируемом исследовании III фазы ADVANCE участвовало 1088 пациентов с ХГC-1, ранее не получавших лечения8. Цель исследования заключалась в сравнении результатов тройной терапии с результатами стандартной терапии, а также в оценке эффективности двух режимов с различной длительностью приема телапревира (8 и 12 недель) в комбинации с ПЭГ-ИФН-альфа-2а и рибавирином. Как показали результаты, больные, получавшие комбинированное лечение телапревиром, ПЭГ-ИФН-альфа и рибавирином в течение 12 недель с последующим продолжением терапии ПЭГ-ИФН-альфа и рибавирином, значительно чаще достигали УВО (75%), чем те, кто получал стандартный курс лечения (44%).
Изучению эффективности и безопасности тройной схемы лечения с включением телапревира у пациентов с ХГC-1, ранее не получавших ПВТ, посвящено мультицентровое рандомизированное исследование ILLUMINATE. Его основной целью было доказать сопоставимую эффективность 24- и 48-недельного курса ПВТ, включавшей телапревир, у пациентов, у которых достигнут расширенный вирусологический ответ с неопределяемым уровнем ВГC в сыворотке крови на 4-й и 12-й неделе лечения. В ходе исследования установлено, что в общей сложности УВО был достигнут в 72% случаев. У 65% больных наблюдался расширенный вирусологический ответ.
В исследовании SPRINT-2 была показана эффективность тройной терапии с применением боцепревира (1097 пациентов с ХГC-1, ранее не получавших ПВТ)9. Все больные в течение вводного периода получали ПЭГ-ИФН-альфа-2b и рибавирин. Продолжительность терапии определялась типом реакции на лечение. После вводной фазы больных разделили на три группы. Пациенты первой (контрольной) группы продолжали принимать два препарата и плацебо (без боцепревира). Больные второй группы получали тройную терапию. Протокол лечения общей длительностью 48 недель включал четыре недели вводного двойного стандартного лечения, за которым следовала тройная терапия с добавлением боцепревира. Больные третьей группы получали тройную терапию, длительность которой модифицировалась вирусологическим ответом (терапия по ответу). Так, при неопределяемой в крови РНК ВГC на восьмой неделе лечения боцепревир назначали на 24 недели, то есть общая длительность терапии составляла 28 недель. При отсутствии раннего ответа на восьмой неделе длительность лечения с боцепревиром составляла 24 недели (28 недель терапии, включая четырехнедельный вводный период), после чего назначали 20-недельный курс стандартной двойной ПВТ. Согласно результатам исследования через 24 недели после завершения лечения УВО был достигнут в 66% случаев в группе фиксированной тройной терапии и в 63% случаев в группе тройной терапии по ответу. В группе контроля УВО был достигнут только у 38% больных. Таким образом, добавление в схему лечения ХГC-1 боцепревира способствовало увеличению доли пациентов, достигших УВО, в два раза. Назначение боцепревира позволило сократить сроки терапии в случае достижения раннего вирусологического ответа на восьмой неделе терапии.
Результаты масштабных исследований свидетельствуют о высокой эффективности тройной терапевтической схемы у пациентов с ХГC-1, что открывает новые перспективы в лечении больных данной группы.
Следует отметить, что боцепревир и телапревир эффективны только у больных, инфицированных ХГC-1, не показаны пациентам с другими генотипами и применяются только в комбинации с ПЭГ-ИФН и рибавирином в виде тройной ПВТ. Длительность лечения тремя препаратами (от 24 до 44 недель) зависит от результатов исследования РНК ВГC при проведении терапии. Тройная терапия ХГC целесообразна при частичном или нулевом ответе на предшествующую терапию, повторном лечении, отсутствии генотипа СС по нуклеотидной последовательности rs12979860ИЛ-28В, высокой вирусной нагрузке, а также показана пациентам старше 40–50 лет, с выраженным фиброзом и циррозом печени (F3–F4).
Докладчик подробно остановился на лечении пациентов с выраженным фиброзом и циррозом печени. В США и странах Европы цирроз печени в исходе ХГC занимает первое место среди показаний к трансплантации печени.
Больным с F3–F4 показано безотлагательное противовирусное лечение, поскольку уровень смертности у них достигает высоких значений. У пациентов с циррозом печени наблюдается низкая эффективность двойной терапии, поэтому применение у них новых комбинированных схем ПВТ вполне обоснованно. Результаты применения тройной ПВТ у пациентов с компенсированным циррозом печени при ХГC-1 показали увеличение числа случаев достижения УВО при первичном лечении.
Профессор П.П. Огурцов привел данные известного масштабного французского исследования CUPIC, посвященного изучению эффективности тройной терапии ингибиторами протеаз первого поколения у больных ХГC-1 и компенсированным циррозом печени, не ответивших на предшествующую терапию10 (таблица).
Отличительной чертой данного исследования стало отсутствие контрольной группы, поскольку при естественном течении компенсированного цирроза печени на фоне ХГC смертность достигает 6,2–11% в год11, при тромбоцитопении (< 150 000/мм3) и ХГC – 4% в год12, при гипоальбуминемии (< 35 г/л) – 13% за 90 дней.
Как показали результаты исследования, боцепревир по характеристикам безопасности имеет ряд преимуществ перед другим ингибитором протеаз – телапревиром.
На фоне лечения боцепревиром у больных реже развивались побочные эффекты ПВТ.
Кроме того, в исследовании CUPIC изучали соотношение наступления УВО на 12-й неделе терапии и риска серьезных осложнений (госпитализации, смерти, декомпенсации) у 674 пациентов с циррозом печени при терапии с включением ингибиторов протеаз в зависимости от гематологических показателей. Из 37 больных с уровнями альбумина < 35 г/л, тромбоцитов ≤ 100 000/мм3 в крови осложнения отмечены у 19 (51%), УВО был достигнут у 10 (27%) больных. При уровне тромбоцитов > 100 000/мм3 из 31 больного у пяти (16%) наблюдались осложнения, УВО – у девяти (29%). При значениях альбумина ≥ 35 г/л, тромбоцитов > 100 000/мм3 у 306 пациентов осложнения отмечены лишь у 19 (6%), УВО достигли 168 (55%) пациентов. По словам докладчика, прирост уровня риска осложнений наблюдается при декомпенсации состояния пациентов с циррозом печени, связанной с тромбоцитопенией и гипоальбуминемией.
В американском исследовании действия тройной терапии – ПЭГ-ИФН, рибавирина, боцепревира или телапревира при декомпенсированном циррозе печени (балл по шкале Чайлда – Пью (Child–Pugh) (СР) ≥ 6–11, тяжесть по шкале MELD (Model for End-stage Liver Disease – модель для терминальных стадий заболеваний печени) 6–20) участвовали 106 пациентов с циррозом печени и ХГC-1.
Контрольную группу составили 45 пациентов с компенсированным циррозом печени (СР = 5), основную – 61 больной циррозом печени в стадии декомпенсации (СР ≥ 6–11, MELD 6–20). Всем пациентам проводили тройную терапию (ПЭГ-ИФН, рибавирин, боцепревир или телапревир). По сравнению с контрольной группой у больных с СР ≥ 6 зафиксировано более частое снижение доз ПЭГ-ИФН (48 и 94% соответственно), выполнение трансфузий (17 и 21% соответственно). В основной группе отмечены более низкая частота достижения УВО, высокая частота прекращения лечения – 33% (15% из-за побочных эффектов, 18% из-за отсутствия ответа), декомпенсация (повышение по MELD ≥ 2) в 50% случаев против 15% в группе контроля13. У больных основной группы был выявлен значимый предиктор декомпенсации – высокий уровень билирубина в сыворотке крови (> 18). Таким образом, пациентам с циррозом печени в стадии декомпенсации не показано назначение ингибиторов протеаз. Исключение – пациенты, ожидающие трансплантации печени, поскольку достижение БВО и раннего вирусологического ответа перед операцией (4–12 недель) снижает риск возвратного вирусного гепатита C. Тройная ПВТ показана всем больным с компенсированным циррозом печени независимо от достижения УВО, поскольку позволяет снизить скорость прогрессирования заболевания и уровень виремии. Однако больные с сочетанием тромбоцитопении (≤ 100 000/мм3) и гипоальбуминемии (< 35 г/л) не должны получать тройную терапию.
Контрольную группу составили 45 пациентов с компенсированным циррозом печени (СР = 5), основную – 61 больной циррозом печени в стадии декомпенсации (СР ≥ 6–11, MELD 6–20). Всем пациентам проводили тройную терапию (ПЭГ-ИФН, рибавирин, боцепревир или телапревир). По сравнению с контрольной группой у больных с СР ≥ 6 зафиксировано более частое снижение доз ПЭГ-ИФН (48 и 94% соответственно), выполнение трансфузий (17 и 21% соответственно). В основной группе отмечены более низкая частота достижения УВО, высокая частота прекращения лечения – 33% (15% из-за побочных эффектов, 18% из-за отсутствия ответа), декомпенсация (повышение по MELD ≥ 2) в 50% случаев против 15% в группе контроля13. У больных основной группы был выявлен значимый предиктор декомпенсации – высокий уровень билирубина в сыворотке крови (> 18). Таким образом, пациентам с циррозом печени в стадии декомпенсации не показано назначение ингибиторов протеаз. Исключение – пациенты, ожидающие трансплантации печени, поскольку достижение БВО и раннего вирусологического ответа перед операцией (4–12 недель) снижает риск возвратного вирусного гепатита C. Тройная ПВТ показана всем больным с компенсированным циррозом печени независимо от достижения УВО, поскольку позволяет снизить скорость прогрессирования заболевания и уровень виремии. Однако больные с сочетанием тромбоцитопении (≤ 100 000/мм3) и гипоальбуминемии (< 35 г/л) не должны получать тройную терапию.
Завершая выступление, профессор П.П. Огурцов подчеркнул, что главная цель терапии – излечение пациента. Достижение этой цели напрямую зависит от эффективности комбинированной ПВТ. В каждом конкретном случае необходимо определять адекватные дозы препаратов и оптимальную продолжительность терапии. Время – невозобновляемый ресурс, поэтому необходимо своевременно применять индивидуализированную тактику лечения пациентов с ХГC, особенно при фиброзе и циррозе печени, чтобы спасти им жизнь.
Персонифицированный подход к профилактике и лечению нежелательных явлений при противовирусной терапии хронического гепатита C с боцепревиром
Важным аспектом ПВТ ХГC является не только эффективность, но и безопасность лекарственных препаратов. Этому аспекту современной ПВТ ХГС был посвящен доклад к.м.н. Эдуарда Збигневича БУРНЕВИЧА (Первый Московский государственный медицинский университет им. И.М. Сеченова).
До 1995 г. в клинической практике применялись только препараты «короткоживущего» ИФН-альфа, которые обеспечивали низкую частоту достижения УВО. После клинической апробации стали широко использовать комбинацию ИФН-альфа и рибавирина, что обеспечивало элиминацию ВГC у 38–43% больных ХГС. Действовавший в течение последнего десятилетия стандарт лечения больных ХГС при инфицировании ВГС 1-го генотипа – комбинация ПЭГ-ИФН-альфа и рибавирина позволял рассчитывать на излечение примерно половины больных. После начала применения препаратов с прямым противовирусным действием – ингибиторов протеазы, в частности боцепревира, вместе с ПЭГ-ИФН-альфа и рибавирином частота достижения УВО превысила 70%, у некоторых категорий больных – 90%14–20.
Результаты клинических исследований и опыт применения боцепревира в составе ПВТ в клинических исследованиях и реальной клинической практике показали значительное повышение эффективности лечения. Однако особую актуальность приобретают вопросы безопасности. Основные нежелательные явления (НЯ) при ПВТ ХГC – ИФН-индуцированные эффекты, в частности общая слабость, головная боль, лихорадка, снижение массы тела, анорексия, алопеция, артралгии, депрессия21.
Результаты исследований SPRINT-2 (ПЭГ-ИФН-альфа, рибавирин и боцепревир у первичных больных ХГС) и RESPOND-2 (ПЭГ-ИФН-альфа, рибавирин и боцепревир в качестве повторной терапии) в целом продемонстрировали удовлетворительную переносимость тройной терапии c использованием боцепревира, однако наблюдалась повышенная частота таких НЯ, как анемия и нарушение вкусовых ощущений. Докладчик подробно остановился на таком важном НЯ, как анемия.
Развитие анемии существенно сказывается на качестве жизни больных и на их приверженности лечению, приводит к нарастанию астенического синдрома, снижению когнитивной функции. Анемия обусловлена индуцированным рибавирином гемолизом и супрессией костномозгового кроветворения ПЭГ-ИФН-альфа и боцепревиром: в исследовании RESPOND-2 в группах боцепревира частота анемии с уровнем гемоглобина (Hb) 85–100 г/л составила 45–41%, с уровнем Hb < 85 г/л – 5–9%22.
В продолжающемся в настоящее время исследовании CUPIC также изучается безопасность применения, в частности, боцепревира в комбинации с ПЭГ-ИФН-альфа и рибавирином в программе раннего доступа во Франции к ингибиторам протеазы первого поколения у больных циррозом печени в исходе ХГC с неэффективной стандартной ПВТ. Согласно промежуточным данным при применении боцепревира анемия 2-й степени (Hb 80–100 г/л) имела место в 22,6% случаев, 3–4-й степени (Hb < 80 г/л) – в 10,1%, частота использования эритропоэтина-альфа составила 66%, гемотрансфузий – 10,7%. Таким образом, анемия при применении боцепревира в составе тройной ПВТ ХГС развивается примерно у половины больных, однако частота тяжелой анемии относительно невелика. Объединенный анализ результатов исследований SPRINT-1, SPRINT-2 и RESPOND-2 демонстрирует, что добавление боцепревира к ПЭГ-ИФН-альфа и рибавирину приводит к дополнительному (по сравнению с двойной терапией) снижению уровня Hb в среднем на 10 г/л, что делает целесообразным критическое отношение к стартовому уровню Hb.
Хотя ПВТ с использованием боцепревира снижает уровень Hb у больных ХГC, анемия является положительным прогностическим фактором ответа на лечение. Так, при ПВТ ПЭГ-ИФН-альфа, рибавирином и боцепревиром в исследованиях SPRINT-2 и RESPOND-2 показано, что при снижении уровня Hb < 100 г/л возрастает частота достижения УВО (72 и 76% соответственно). В то же время частота УВО у больных без анемии достигает только 58 и 50% соответственно (рис. 4). Положительное прогностическое значение анемии было показано еще при двойной ПВТ ХГС в комбинации ПЭГ-ИФН-альфа и рибавирина – исследование IDEAL (рис. 5). В этом же исследовании впервые у большой когорты больных было показано, что назначение эритропоэтина-альфа для коррекции анемии не повышает частоту УВО23.
При тройной ПВТ с боцепревиром применение эритропоэтина-альфа оказалось равнозначным по частоте УВО с другими методами коррекции анемии как у первичных больных ХГС (исследование SPRINT-2), так и при повторном лечении (исследование RESPOND-2) (рис. 6).
Для решения вопроса о наиболее эффективном и безопасном методе коррекции анемии при тройной ПВТ с боцепревиром F. Poordad и соавт. провели дополнительное исследование. В исследовании изучали два подхода к лечению анемии – пошаговое снижение дозы рибавирина и применение эритропоэтина-альфа. Оказалось, что частота УВО не зависит от метода лечения анемии (71 и 71% соответственно). Таким образом, для коррекции клинически значимой анемии (Hb < 100 г/л) можно использовать оба метода. Однако, по мнению докладчика, применение эритропоэтина-альфа неоправданно в силу высокой стоимости и НЯ. Снижение дозы рибавирина представляет собой наиболее безопасную, экономически выгодную стратегию лечения анемии у больных ХГC, получающих тройную ПВТ с боцепревиром. Докладчик предложил алгоритм коррекции анемии (рис. 7).
В заключение Э.З. Бурневич обобщил тактику ведения анемии при тройной терапии с боцепревиром у больных ХГC, инфицированных ВГC 1-го генотипа.
Во-первых, требуется критическое отношение к стартовому уровню гемоглобина.
Во-вторых, во время ПВТ необходим тщательный мониторинг уровня гемоглобина для максимально ранней диагностики анемии.
В-третьих, развитие анемии – благоприятный прогностический признак достижения УВО.
В-четвертых, наиболее оправданной стратегией лечения анемии является пошаговое снижение дозы рибавирина.
Заключение
Новым этапом в лечении больных ХГC, инфицированных ВГС 1-го генотипа, является внедрение в клиническую практику в комбинации с ПЭГ-ИФН-альфа и рибавирином новых препаратов – ингибиторов вирусной протеазы – боцепревира и телапревира. Эти препараты обладают специфическим действием на ВГС и обеспечивают высокоэффективную терапию ХГC, способствуя значимому повышению частоты развития УВО как у первичных больных ХГС, так и у пациентов, не ответивших на предыдущую двойную терапию.
В ряде крупномасштабных клинических исследований доказана высокая эффективность боцепревира в комбинации с ПЭГ-ИФН-альфа и рибавирином на основании достижения УВО у большинства больных ХГС. Введение в схему ПВТ боцепревира и персонифицированный подход как к ПВТ, так и к профилактике и коррекции НЯ во время лечения способствуют улучшению качества и продолжительности жизни больных ХГC.
1. Craxi A., Koutsounas S., Ogurtsov P. et al. Peginterferon alfa-2b plus weight-based ribavirin for 24 weeks in patients with chronic hepatitis C virus genotype 1 with low viral load who achieve rapid viral response // J. Viral. Hepat. 2012. Vol. 19. № 2. P. e120–e125.
2. Pearlman B., Ehleben C., Saifee S. Treatment extension to 72 weeks of peginterferon and ribavirin in hepatitis C genotype 1-infected slow responders // Hepatology. 2007. Vol. 46. P. 1688–1694.
3. Yu J.W., Sun L.J., Zhao Y.H. et al. The effect of metformin on the efficacy of antiviral therapy in patients with genotype 1 chronic hepatitis C and insulin resistance // Int. J. Infect. Dis. 2012. Vol. 16. № 6. P. e436–e441.
4. Хафисова О.О., Поликарпова Т.С., Мазурчик Н.В., Огурцов П.П. Влияние метформина на формирование устойчивого вирусологического ответа при проведении комбинированной противовирусной терапии хронического гепатита с Пег-ИФальфа-2b и рибавирином у пациентов с исходной инсулинорезистентностью // Вестник РУДН. Медицина. 2011. № 2.
5. Abu-Mouch S., Fireman Z., Jarchovsky J. et al. Vitamin D supplementation improves sustained virologic response in chronic hepatitis C (genotype 1)-naive patients // World J. Gastroenterol. 2011. Vol. 17. № 47. Р. 5184–5190.
6. Petta S., Ferraro D., Cammà C. et al. Vitamin D levels and IL28B polymorphisms are related to rapid virological response to standard of care in genotype 1 chronic hepatitis C // Antivir. Ther. 2012. Vol. 17. № 5. P. 823–831.
7. Kondo Y., Shimosegawa T. Direct effects of hepatitis C virus on the lymphoid cells // World J. Gastroenterol. 2013. Vol. 19. № 44. P. 7889–7895.
8. Jacobson I., McHutchison J., Dusheiko G. et al. Telaprevir for previously untreated chronic hepatitis C virus infection // N. Engl. J. Med. 2011. Vol. 364. P. 2405–2416.
9. Poordad F., McCone J., Bacon B. et al. Boceprevir for untreated chronic HCV genotype 1 infection // N. Engl. J. Med. 2011. Vol. 364. № 13. P. 1195–1206.
10. Hézode C., Fontaine H., Dorival C. et al. Triple therapy in treatment-experienced patients with HCV-cirrhosis in a multicentre cohort of the French Early Access Programme (ANRS CO20-CUPIC) – NCT01514890 // J. Hepatol. 2013. Vol. 59. № 3. P. 434–441.
11. Gomez E.V., Rodriguez Y.S., Bertot L.C. et al. The natural history of compensated HCV-related cirrhosis: a prospective long-term study // J. Hepatol. 2013. Vol. 58. № 3. P. 434–444.
12. Qamar A.A., Grace N.D. Abnormal hematological indices in cirrhosis // Can. J. Gastroenterol. 2009. Vol. 23. № 6. P. 441–445.
13. Saxena V., Yee H.S., Catalli L. et al. Protease-Inhibitor (PI) Triple Therapy (TT) in Mildly Decompensated Cirrhotics: Predictors of Treatment Discontinuation, Worsening Decompensation and Sustained Virologic Response. AASLD. 2013. Abstr. 1969.
14. Carithers R.L. Jr., Emerson S.S. Therapy of hepatitis C: meta-analysis of interferon alfa-2b trials // Hepatology. 1997. Vol. 26. № 3. Suppl. 1. P. 83S–88S.
15. Zeuzem S., Feinman S.V., Rasenack J. et al. Peginterferon alfa-2a in patients with chronic hepatitis C // N. Engl. J. Med. 2000. Vol. 343. № 23. P. 1666–1672.
16. Poynard T., Marcellin P., Lee S.S. et al. Randomised trial of interferon alpha2b plus ribavirin for 48 weeks or for 24 weeks versus interferon alpha2b plus placebo for 48 weeks for treatment of chronic infection with hepatitis C virus. International Hepatitis Interventional Therapy Group (IHIT) // Lancet. 1998. Vol. 352. № 9138. P. 1426–1432.
17. McHutchison J.G., Gordon S.C., Schiff E.R. et al. Interferon alfa-2b alone or in combination with ribavirin as initial treatment for chronic hepatitis C. Hepatitis Interventional Therapy Group // N. Engl. J. Med. 1998. Vol. 339. № 21. P. 1485–1492.
18. Lindsay K.L., Trepo C., Heintges T. et al. A randomized, double-blind trial comparing pegylated interferon alfa-2b to interferon alfa-2b as initial treatment for chronic hepatitis C // Hepatology. 2001. Vol. 34. № 2. P. 395–403.
19. Fried M.W., Shiffman M.L., Reddy K.R. et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection // N. Engl. J. Med. 2002. Vol. 347. № 13. P. 975–982.
20. Manns M.P., McHutchison J.G., Gordon S.C. et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial // Lancet. 2001. Vol. 358. № 9286. P. 958–965.
21. Manns M.P., McHutchison J.G., Gordon S.C. et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial // Lancet. 2001. Vol. 358. № 9286. P. 958–965.
22. Poordad F., McCone J., Bacon B.R. et al. Boceprevir for untreated chronic HCV genotype 1 infection // N. Engl. J. Med. 2011. Vol. 364. № 13. P. 1195–1206.
23. Sulkowski M.S. et al. Final results of the IDEAL (Individualzed Dosing Efficacy versus Flat Dosing to Assess Optimal Pegylated Interferon Therapy) phase IIIb study // J. Hepatol. 2008. Vol. 48. Suppl. 2. Abstr. 991.
Новости на тему
09.09.2022 01:00:00
09.03.2021
02.06.2014
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.