количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Комплексное лечение пациенток с андрогензависимыми дерматопатиями
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №6
- Аннотация
- Статья
- Ссылки
Лечение пациенток с андрогензависимыми дерматопатиями остается актуальной проблемой.
Для повышения эффективности лечения необходимо комплексное воздействие на все звенья патогенеза гиперандрогении.
Включение препаратов с антиоксидантным действием позволяет повысить эффективность антиандрогенной терапии.
Лечение пациенток с андрогензависимыми дерматопатиями остается актуальной проблемой.
Для повышения эффективности лечения необходимо комплексное воздействие на все звенья патогенеза гиперандрогении.
Включение препаратов с антиоксидантным действием позволяет повысить эффективность антиандрогенной терапии.

Таблица. Параметры Fe2+-индуцированной хемилюминесценции липопротеинов сыворотки крови пациентов с андрогензависимыми дерматопатиями и здоровых лиц
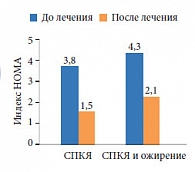
Рис. Динамика изменения индекса HOMA на фоне проводимой терапии у пациенток с СПКЯ с нормальной массой тела и сопутствующим ожирением
Проблемам терапии клинических проявлений гиперандрогении (ГА) в современной врачебной практике уделяется повышенное внимание по причине их широкого распространения. По данным литературы, в мире у 15–30% женщин имеются клинические признаки ГА, и в последние годы частота ГА возрастает [1]. Гиперандрогения может приводить не только к нарушению менструальной и генеративной функции, но и к развитию андрогензависимых дерматопатий (акне, себорея, гирсутизм и алопеция). Кожные проявления ГА являются постоянным стрессовым фактором в жизни пациентки, приводящим к психоэмоциональным реакциям, ограничениям во всех сферах жизнедеятельности, и, как следствие, существенно снижают качество жизни [2]. В этой связи представляется актуальным дальнейшее изучение данной проблемы и поиск более эффективной терапии дерматопатий.
К наиболее частым причинам ГА можно отнести синдром поликистозных яичников (СПКЯ), врожденную дисфункцию коры надпочечников, а именно его неклассическую форму (НК-ВДКН), и идиопатические формы дерматопатий, связанные с нарушением метаболизма андрогенов на уровне рецепторов [1]. Изучена роль инсулинорезистентности и, как следствие, гиперинсулинемии в усугублении симптомов дерматопатии, которая заключается в усилении зависимого от лютеинизирующего гормона (ЛГ) синтеза андрогенов и подавлении в печени синтеза глобулина, связывающего половые стероиды (секс-стероид-связывающий глобулин, СССГ) [3].
В схему стандартной терапии пациенток с андрогензависимыми дерматопатиями входят препараты, действие которых направлено на уменьшение продукции андрогенов, увеличение скорости метаболического клиренса тестостерона (комбинированные оральные контрацептивы (КОК)), блокаду андрогенных рецепторов (нестероидные антиандрогены), подавление активности или блокаду ферментов, вовлеченных в периферический метаболизм тестостерона в дигидротестостерон [4]. Несмотря на то что акне, алопеция и гирсутизм являются наиболее часто встречающимися дерматологическими симптомами гиперандрогении, их патогенез до конца не изучен и представляется многофакторным.
В последние годы ряд исследований был посвящен изучению роли окислительного стресса в патофизиологии андрогензависимых дерматопатий [5]. Выявлено снижение активности антиоксидантного фермента каталазы и повышения содержания малонового диальдегида в крови пациенток с акне и алопецией [6, 7]. Окислительный стресс характеризуется повышенной скоростью образования свободных кислородных радикалов и снижением активности антиоксидантной системы, что приводит к увеличению уровня токсичных радикальных соединений и возможной гибели клетки.
Роль окислительного стресса в патофизиологии дерматопатий не определена. Ряд авторов считают окислительный стресс проявлением воспалительной реакции, в результате которой происходит истощение эндогенной антиоксидантной защиты и снижение репаративных возможностей организма [8, 9]. Известно также, что для синдромов, сопровождающихся ГА, характерно относительное или абсолютное снижение уровня эстрадиола, что может снижать антиоксидантную способность организма, так как эстрогены обладают антиоксидантными свойствами [10–12].
В настоящее время в литературе отсутствуют данные о комплексном изучении гормонального и окислительного статуса у пациенток с андрогензависимыми дерматопатиями. Коррекция всех метаболических нарушений у данной группы пациенток может повысить эффективность комплексной терапии дерматопатий. Целью настоящей работы явилась оценка эффективности комплексной терапии пациенток с андрогензависимыми дерматопатиями с применением гепатопротектора с антиоксидантными свойствами адеметионина.
Материалы и методы
В исследование были включены 128 пациенток в возрасте от 16 до 32 лет (средний возраст составил 24 ± 1,4) с симптомами андрогензависимых дерматопатий (акне, гирсутизм и алопеция) в качестве основной жалобы. В контрольную группу были включены 30 практически здоровых женщин (средний возраст – 22 ± 1,1). Степень тяжести гирсутизма оценивалась по шкале Ферримана – Галвея (1961), акне – по классификации Американской академии дерматологии (2007), алопеции – по классификации Людвига (1977).
Всем пациенткам проводили общеклиническое обследование (сбор анамнеза, оценка антропометрических показателей), инструментальное (трансвагинальная эхография) и лабораторное исследование (определение в сыворотке крови гонадотропных гормонов, половых стероидов, СССГ, инсулина, глюкозы, с определением индекса инсулинорезистентности HOMA (Homeostasis Model Assessment of Insulin Resistance – математическая гомеостатическая модель для оценки резистентности к инсулину)), генетический анализ крови на выявление наиболее частых мутаций гена, кодирующего синтез фермента 21-гидроксилазы (CYP21), с целью определения источника ГА (овариальная и/или надпочечниковая), а также сопутствующих метаболических нарушений.
Критериями диагностики явились: СПКЯ – нарушение менструального цикла по типу олигоменореи с возраста менархе; возникновение дерматопатий с менархе; хроническая ановуляция, ультразвуковые признаки поликистозных яичников; гиперандрогения (повышенные концентрации тестостерона (Т) > 2,5 нмоль/л); НК-ВДКН – поздний возраст менархе (15,6 ± 1,3 года); нарушения овуляторного менструального цикла с длительностью 28–36 дней и начало клинических проявлений дерматопатий после влияния различных стрессорных факторов (ранние потери беременности, осложненные роды, повышенные физические и эмоциональные нагрузки); повышение уровня 17-гидроксипрогестерона (17-OHP) выше скрининговых значений (2 нг/мл или 7 нмоль/л) при двукратном измерении; выявление мутаций при генетическом анализе CYP21; идиопатических форм ГА – регулярный менструальный цикл; изолированное повышение концентрации дигидротестостерона (ДГТ) при нормальных концентрациях других фракций андрогенов; появление клинических симптомов дерматопатий после выраженных психических и физических стрессов, наличие наследственной отягощенности. Выбор критериев диагностики основан и согласуется с данными многочисленных исследований отечественных и зарубежных авторов [10, 13, 14].
У пациенток с андрогензависимыми дерматопатиями до и после лечения и в группе контроля состояние окислительного статуса оценивали с помощью Fe2+-индуцированного окисления липопротеинов низкой и очень низкой плотности, выделенных из сыворотки крови пациенток, – хемилюминесцентный тест [15]. По хемилюминесцентной (ХЛ) кривой, регистрируемой на хемилюминометре LKB–1251 (Швеция), определяли уровень гидроперекисей липидов (h, мВ), резистентность липопротеинов к окислению (тау, с), суммарную окисляемость липопротеинов (H, мВ), а также скорость окисления (V, отн. ед.) (угол наклона кривой возгорания ХЛ). Исследование проводилось в лаборатории нейрохимии Научного центра неврологии РАМН. Преимуществами этого метода являются его специфичность по отношению к перекисному окислению липопротеинов (ПОЛ) (прямой метод), высокая чувствительность и информативность [16].
Статистическую обработку данных проводили с использованием программы Statistica 5.0, достоверность получаемых различий оценивали с помощью непараметрических критериев Вилкоксона и Манна – Уитни. Достоверными считали различия при p < 0,05. В качестве стандартной терапии пациенткам с дерматопатиями назначался низкодозированный комбинированный оральный контрацептив Джес, 1 таблетка которого содержит 3 мг дроспиренона и 20 мкг этинилэстрадиола. Пациентки получали по 1 таблетке в сутки в течение 6 месяцев. Упаковка препарата Джес содержит 24 гормональных таблетки и 4 таблетки плацебо, что обеспечивает 3 дополнительных дня антиандрогенного воздействия и снижает риск рецидива дерматопатий в безгормональный период.
Кроме того, пациентки получали нестероидный блокатор рецепторов андрогенов флутамид (в дозировке 250 мг/сут ежедневно) в течение 6 месяцев. Флутамид подавляет синтез андрогенов за счет снижения активности цитохрома P450c17, участвующего в продукции половых стероидов в надпочечниках и яичниках. Очень важно, что флутамид не оказывает отрицательного влияния на липидный спектр крови и может успешно применяться у пациенток с инсулинорезистентностью. Лечение проводили под контролем функции печени 1 раз в 3 месяца. Пациенткам с тяжелыми формами дерматопатий и НК-ВДКН назначали дополнительно дексаметазон 0,5 мг/сут. При выявлении у пациенток сопутствующей инсулинорезистентности был назначен инсулиновый сенситайзер метформин (группа бигуанидов) в дозировке 1500 мг/сут ежедневно. Препарат повышает чувствительность периферических тканей к инсулину, способствуя нормализации уровня инсулина в крови. Длительность лечения составила 6 месяцев.
В дополнение к терапии назначался гепатопротекторный препарат с антиоксидантным действием адеметионин в течение 1 месяца по 800 мг/сут. Для оценки эффективности антиоксидантной терапии пациентки с андрогензависимыми дерматопатиями были разделены на 2 группы: первая группа включала 68 пациенток, которые получали в комплексе с основной терапией антиоксидантную терапию; во вторую группу вошли 60 пациенток, не получавших антиоксидантную терапию (группа сравнения).
Результаты и их обсуждение
По результатам комплексного обследования СПКЯ был выявлен у 60 пациенток, НК-ВДКН – у 20 пациенток, идиопатическая форма дерматопатий – у 48 пациенток. Избыточная масса тела (индекс массы тела 29 ± 1,6 кг/м2) определена у 41,6% (n = 25) обследованных пациенток с СПКЯ, преимущественно с выраженными формами дерматопатий. У пациенток с СПКЯ после проведения антиандрогенной терапии анализ гормонального гомеостаза показал достоверное снижение уровня ЛГ, общего тестостерона, повышение уровня СССГ и, как следствие, снижение индекса свободных андрогенов. Однако степень регресса дерматологических проявлений не всегда коррелировала с динамикой снижения уровня андрогенов, что обусловлено особенностями их периферического метаболизма.
Кроме положительной динамики гормональных показателей, отмечено значительное уменьшение объема яичников в группе СПКЯ у пациенток с нормальной массой тела (с 20,6 ± 1,3 см³ до 12,1 ± 0,8 см³) и у пациенток с сопутствующим ожирением (с 23,6 ± 1,2 см³ до 13,3 ± 1,4 см³) и площади гиперэхогенной стромы. Анализ результатов исследования показал, что гиперинсулинемия и инсулинорезистентность наблюдались чаще у пациенток с СПКЯ с ожирением – у 93,3% – и только у 25% пациенток с СПКЯ и нормальной массой тела. В группе пациенток с идиопатической формой гиперандрогении и с НК-ВДКН инсулинорезистентности выявлено не было. Данный факт подтверждает то, что основной источник гиперандрогении при НК-ВДКН – надпочечники, а при идиопатических формах – нарушение периферического метаболизма андрогенов.
Как видно из рисунка, показатель индекса инсулинорезистентности HOMA достоверно снизился через 6 месяцев терапии метформином по сравнению с исходным как в подгруппе СПКЯ с нормальной массой тела (1,5 ± 0,45, p < 0,05), так и с ожирением (2,1 ± 0,8, p < 0,01). У пациенток с верифицированным диагнозом НК-ВДКН после проведенного лечения выявлено достоверное снижение уровня основных андрогенов (Т, 17-OHP, дегидроэпиандростерон-сульфат (ДГАЭ-С)). У пациенток с идиопатической формой ГА наблюдалось незначительное уменьшение уровня ДГТ после 6 месяцев лечения при достоверном уменьшении уровня общего тестостерона, что является следствием снижения стероидогенеза на фоне приема КОК (p < 0,05). Отсутствие достоверного снижения концентрации ДГТ объясняет первостепенную роль фермента 5-альфа-редуктазы в периферическом метаболизме и патофизиологии идиопатических форм ГА. Концентрации СССГ были достоверно выше после лечения, что обусловлено приемом КОК.
Оценка окислительного статуса пациенток до введения в терапию препарата с антиоксидантными свойствами выявила их определенные особенности (табл.). Как видно из представленных данных, у всех обследованных до лечения отмечалось повышение скорости окисления липопротеинов (V) (2,68 ± 0,7) относительно группы контроля (2,11 ± 0,43). Этот процесс сопровождался значительным снижением длительности латентного периода ХЛ у пациенток (46,2 ± 12,8 с). Полученные данные о снижении длительности латентного периода ХЛ указывают на истощение эндогенной антиоксидантной системы. Данные настоящего исследования согласуются с результатами исследований, проведенных S. Briganti и M. Picardo (2003), O. Arican и соавт. (2005) и N.S. Abdel Fattah и соавт. (2010), показавшими увеличение уровня малонового диальдегида и снижение уровня супероксиддисмутазы, что также говорит о снижении эндогенной антиоксидантной защиты у пациенток с акне и алопецией [6, 7, 17].
Уровень липидных гидроперекисей (h) 90,6 ± 14,2 мВ у пациенток был сопоставим с таковым у практически здоровых женщин – 81,2 ± 11,1 мВ (различия статистически не значимы). Не получено достоверных различий между сравниваемыми группами и по суммарной окисляемости липопротеинов (Н) (у пациенток значение H составляло 1053 ± 161 мВ, а у здоровых лиц – 977 ± 102 мВ), что свидетельствовало об умеренной выраженности процессов ПОЛ, по сравнению с органическими заболеваниями [18]. Таким образом, у пациенток с андрогензависимыми дерматопатиями отмечаются определенные нарушения окислительного статуса, выражающиеся в значимом снижении активности эндогенной антиоксидантной защиты и повышении скорости окисляемости липопротеинов. Полученные данные указывают на необходимость включения препаратов антиоксидантного действия в схемы основного лечения.
Установлено, что после проведенного лечения у пациенток с включением адеметионина отмечается снижение скорости окисления липопротеинов и уровня липидных гидроперекисей до уровня в контрольной группе. Этот процесс сопровождается увеличением длительности латентного периода ХЛ, что свидетельствует о повышении активности эндогенной антиоксидантной защиты. После проведенного курса основной антиандрогенной терапии в группе сравнения показатель активности эндогенной антиоксидантной защиты (тау) продолжал оставаться достоверно сниженным по сравнению с группой контроля и значимо не изменялся по сравнению с уровнем до основного лечения. Таким образом, базисная терапия не оказывает существенного влияния на активность процессов ПОЛ и уровень эндогенной антиоксидантной защиты у пациенток с андрогензависимыми дерматопатиями. Наоборот, выявлена тенденция к ухудшению параметров по основным показателям, то есть скорости окисления липопротеинов (V) и длительности латентного периода ХЛ (тау), что еще раз подчеркивает необходимость включения антиоксидантов в комплексную антиандрогенную терапию.
Эффективность лечения с редукцией симптомов дерматопатий через 6 месяцев была отмечена у 75% (n = 51) пациенток 1-й группы, а во 2-й группе – у 50% пациенток (n = 30), следовательно, комплексная терапия с включением антиоксиданта адеметионина позволила повысить эффективность лечения дерматопатий на 25%. Таким образом, проведенное исследование свидетельствует о высокой эффективности комплексной антиандрогенной терапии. 24-дневный гормональный режим КОК усиливает антигонадотропное действие оральных контрацептивов, в результате снижается продукция андрогенов в яичниках, повышается концентрация СССГ.
Включение флутамида как блокатора периферических рецепторов андрогенов способствует более быстрому и стойкому достижению эффекта. В исследованиях R. George и соавт. (2008), а также в исследованиях A. Pizzo и соавт. (2008) также отмечено положительное влияние флутамида на течение андрогензависимых дерматопатий [19, 20]. Нарушения окислительного статуса у пациенток с дерматопатиями выражаются в значимом снижении активности эндогенной антиоксидантной системы и повышении скорости окисляемости липопротеинов. Результаты настоящего исследования свидетельствуют о способности адеметионина снижать уровень липидных гидроперекисей до уровня в контрольной группе и повышать активность эндогенной антиоксидантной системы, то есть подтверждают антиоксидантное действие адеметионина. Таким образом, введение адеметионина в комплексное лечение пациенток способствует повышению эффективности лечения андрогензависимых дерматопатий.
1. Azziz R., Sanchez L.A., Knochenhauer E.S. et al. Androgen excess in women: experience with over 1000 consecutive patients // J. Clin. Endocrinol. Metab. 2004. Vol. 89. № 2. P. 453–462.
2. Монахов С.А. Дифференцированная терапия акне с учетом тяжести кожного процесса и спектра психоэмоциональных расстройств: Автореф. дисс. ... канд. мед. наук. М., 2005.
3. Манухина Е.И. Оптимизация терапии гирсутизма у пациенток с синдромом поликистозных яичников: Автореф. дисс. … канд. мед. наук. М., 2002.
4. Манухин И.Б., Тумилович Л.Г., Геворкян М.А. Гинекологическая эндокринология, клинические лекции. М.: Гэотар-Медиа, 2012. С. 213–224.
5. Abdel Fattah N.S., Shaheen M.A., Ebrahim A.A. et al. Tissue and blood superoxide dismutase activities and malondialdehyde levels in different clinical severities of acne vulgaris // Br. J. Dermatol. 2008. Vol. 159. № 5. P. 1086–1091.
6. Abdel Fattah N.S., Ebrahim A.A., El Okda E.S. Lipid peroxidation/antioxidant activity in patients with alopecia areata // J. Eur. Acad. Dermatol. Venereol. 2011. Vol. 25. № 4. P. 403–408.
7. Arican O., Kurutas E.B., Sasmaz S. Oxidative stress in patients with acne vulgaris // Mediators Inflamm. 2005. № 6. P. 380–384.
8. Полонская Н.А. Комплексное лечение угревой болезни среднетяжелого и тяжелого течения комбинированным химическим пилингом в сочетании с низкими дозами изотретиноина: Автореф. дисс. … канд. мед. наук. М., 2005.
9. Repaci A., Gambineri A., Pasquali R. The role of low-grade inflammation in the polycystic ovary syndrome // Mol. Cell. Endocrinol. 2011. Vol. 335. № 1. P. 30–41.
10. Azziz R., Carmina E., Dewailly D. et al. Positions statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society guideline // J. Clin. Endocrinol. Metab. 2006. Vol. 91. № 11. P. 4237–4245.
11. Homburg R. Diagnosis and management of polycystic ovary syndrome // Springer US. 2009. 238 p.
12. Polycystic ovary syndrome / Ed. by G. Kovacs, R. Norman. Cambridge, 2007. P. 42–48.
13. Чагай Н.Б., Фадеев В.В. Сложности дифференциальной диагностики и терапии неклассической формы врожденной дисфункции коры надпочечников у пациенток репродуктивного возраста // Проблемы репродукции. 2009. № 3. С. 93–98.
14. Pall M., Azziz R., Beires J. et al. The phenotype of hirsute women: a comparison of polycystic ovary syndrome and 21-hydroxylase-deficient nonclassic adrenal hyperplasia // Fertil. Steril. 2010. Vol. 94. № 2. P. 684–689.
15. Федорова Т.Н. Окислительный стресс и защита головного мозга от ишемического повреждения: Автореф. дисс. … докт. мед. наук. М., 2003.
16. Владимиров Ю.А., Арчаков А.М. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972.
17. Briganti S., Picardo M. Antioxidant activity, lipid peroxidation and skin diseases. What's new // J. Eur. Acad. Dermatol. Venereol. 2003. Vol. 17. № 6. P. 663–669.
18. Багыева Г.Х. Клинико-генетический и биохимический анализ болезни Паркинсона: механизмы предрасположенности, экспериментальные модели, подходы к терапии: Автореф. дисс. … канд. мед. наук. М., 2009. С. 24.
19. George R., Clarke S., Thiboutot D. Hormonal therapy for acne // Semin. Cutan. Med. Surg. 2008. Vol. 27. № 3. P. 188–196.
20. Pizzo A., Borrielli I., Mastroeni M.T. et al. Low-dose flutamide in the treatment of hyperandrogenism in adolescents // Minerva Pediatr. 2008. Vol. 60. № 6. P. 1357–1366.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Лечение пациенток с андрогензависимыми дерматопатиями остается актуальной проблемой.
Для повышения эффективности лечения необходимо комплексное воздействие на все звенья патогенеза гиперандрогении.
Включение препаратов с антиоксидантным действием позволяет повысить эффективность антиандрогенной терапии.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
