Рациональная этиопатогенетическая интерферонотерапия у детей с инфекцией COVID-19
- Аннотация
- Статья
- Ссылки
- English








Введение
Эпидемиологическая ситуация в мире, вызванная новым штаммом коронавируса SARS-CoV-2, остается напряженной. 11 марта 2020 г. Всемирная организация здравоохранения объявила о начале пандемии COVID-19 [1]. Впервые данное заболевание было выявлено в декабре 2019 г. в г. Ухань (Китайская Народная Республика) как некий на тот момент неизвестный тип пневмонии [2].
Согласно данным J.F. Ludvigsson (2020), в возрастной структуре диагностированных случаев COVID-19 доля детей составляет 1–5% [3]. Китайские ученые проанализировали 44 672 случая COVID-19, подтвержденного лабораторными исследованиями, и установили, что в общей структуре инфицированных лиц доля детей в возрасте до десяти лет достигает 0,9%, в возрастной группе 10–14 лет, включая подростков, этот показатель не превышает 1,2%. Авторы отмечают, что с увеличением общего количества лабораторно обследованных лиц доля пациентов с легкими или бессимптомными формами заболевания возрастает [4].
J.F. Chan и соавт. (2020) подтвердили тот факт, что в условиях высокой распространенности коронавирусной инфекции дети болеют намного реже, а саму инфекцию переносят значительно легче, чем взрослые [5].
Американские ученые установили, что риск смерти при тяжелой форме COVID-19 в детской популяции ниже, чем во взрослой [6].
В процессе биологической эволюции в организме человека сформировлся великолепный механизм противостояния вирусным атакам, который реализован в системе цитокиновых белков – интерферонов (ИФН). В ответ на внедрение чужеродной генетической вирусной информации все ядерные клетки продуцируют интерфероны 1-го типа (ИФН-альфа, ИФН-бета), которые обеспечивают экспрессию ИФН-стимулированных генов. ИФН стимулирует антигенпрезентирующие функции макрофагов, увеличивает синтез цитокинов, усиливает активность натуральных киллеров (NK-клеток) и дендритных клеток. Согласно результатам исследований, повышение продукции ИФН 1-го типа, в частности ИФН-альфа, наблюдается через 30–40 минут после внедрения вируса в клетку [7–9]. Однако в норме, вне вирусной агрессии, «депо» ИФН в организме отсутствует, концентрация ИФН в плазме низка [10, 11]. В соответствии с последними научными данными, в процессе вирусного филогенеза новый коронавирус научился использовать многочисленные механизмы подавления интерфероногенеза и уклонения от иммунного ответа. В частности, Y. Konno и соавт. (2020) показали, что белок, экспрессируемый с гена ORF3b нового коронавируса SARS-CoV-2, значительно подавляет синтез ИФН 1-го типа у пациентов с COVID-19. Кроме того, аналогичными свойствами обладают неструктурные белки ORF6, 8, 9b и 9с [12].
В работе исследователей из Орхусского университета (Дания), изучавших индукцию экспрессии ИФН в легочной ткани при заражении SARS-CoV-2, показано, что альвеолярные макрофаги легочной ткани не продуцируют ИФН в ответ на внедрение вируса SARS-CoV-2, хотя известно, что данные макрофаги активно синтезируют ИФН при других легочных вирусных инфекциях [13].
Вместе с тем чувствительность вируса SARS-CoV-2 к ИФН высока, о чем свидетельствует множество научных публикаций.
А. Vanderheiden и соавт. (2020) проверили чувствительность SARS-CoV-2 к ИФН: они обрабатывали культуры pHAE интерферонами 1-го или 3-го типа за 24 часа до заражения. При этом количество вирусной РНК снижалось в три раза по сравнению с зараженными культурами, не обработанными ИФН, а репликация вируса уменьшалась на 90% [14].
Согласно данным K.G. Lokugamage и соавт. (2020), новый коронавирус гораздо более чувствителен к предварительному воздействию экзогенного ИФН. SARS-CoV-2 в аспекте ИФН 1-го типа индуцирует фосфорилирование STAT1 и повышенных белков ISG. Количество вируса в инфицированных, но обработанных ИФН клетках в 1000–10 000 раз ниже, чем в таких же инфицированных клетках, но предварительно не обработанных ИФН [11].
Американские исследователи также отметили повышенную чувствительность нового коронавируса SARS-CoV-2 к ИФН 1-го типа по сравнению с предыдущим штаммом коронавируса SARS-CoV, вызывающего атипичную пневмонию [11]. В исследовании R. Channappanavar и соавт. введение ИФН 1-го типа в виде ИФН-альфа-2b в течение одного дня после инфицирования коронавирусом MERS-CoV (до пика титров вируса) защищало мышей от летальной инфекции, несмотря на снижение экспрессии стимулированного ИФН гена (ISG) и гена воспалительного цитокина [15].
Таким образом, вирус SARS-CoV-2 поражает не только эпителиальные клетки, но и компоненты иммунной системы. Депо эндогенного ИФН в виде постоянно присутствующей оптимальной концентрации в плазме крови в свободный от вирусной агрессии период отсутствует. Факты, основанные на результатах проведенных в разное время научных исследований, такие как наличие «раннего» ИФН у новорожденных, обладающего слабой противовирусной активностью, и снижение синтеза эндогенного ИФН у детей младших возрастных групп, позволили нам выдвинуть рабочую гипотезу о целесообразности применения экзогенного ИФН у детей в качестве средства первичной иммунопрофилактики и лечения COVID-19.
Цель исследования – сравнить терапевтическую эффективность схемы применения препарата рекомбинантного интерферона альфа-2b с антиоксидантами под коммерческим наименованием ВИФЕРОН® в лекарственной форме ректальных суппозиториев в составе комплексной терапии у детей в возрасте от года до 17 лет и эффективность стандартной схемы терапии легкой формы коронавирусной инфекции COVID-19, а также оценить безопасность и переносимость схемы применения препарата ВИФЕРОН®, суппозитории ректальные, в составе комплексной терапии у детей в возрасте от года до 17 лет и стандартной схемы терапии легкой формы коронавирусной инфекции COVID-19.
Материал и методы
В сравнительном контролируемом научном исследовании изучали эффективность и безопасность препарата ВИФЕРОН®, суппозитории ректальные (ИФН-альфа-2b с антиоксидантами – токоферола ацетатом и аскорбиновой кислотой), в дозах 150 000 и 500 000 МЕ в комплексной терапии коронавирусной инфекции COVID-19 у детей.
Работа проводилась на базе ГБОУ «Самарская областная детская инфекционная больница» (лицензия на осуществление медицинской деятельности РН6301000885) под руководством заведующей кафедрой детских инфекций ФГБОУ ВО «Самарский государственный медицинский университет» Минздрава России, д.м.н., профессора Е.С. Гасилиной.
Препарат ВИФЕРОН®, суппозитории ректальные (ИФН-альфа-2b), 150 000, 500 000, 1 000 000, 3 000 000 МЕ зарегистрирован на территории Российской Федерации в качестве лекарственного средства с 1996 г. (регистрационное удостоверение № P N000017/01, выдано 6 октября 2010 г.).
Препарат ВИФЕРОН®, суппозитории ректальные (ИФН-альфа-2b), 150 000, 500 000, 1 000 000, 3 000 000 МЕ разрешен для медицинского применения у детей, в том числе новорожденных и недоношенных, и взрослых, включая беременных.
В соответствии с утвержденной инструкцией, основными показаниями к применению являются:
- в комплексной терапии различных инфекционно-воспалительных заболеваний у детей, в том числе новорожденных и недоношенных: острые респираторные вирусные инфекции, включая грипп, в том числе осложненные бактериальной инфекцией, пневмония (бактериальная, вирусная, хламидийная), менингит (бактериальный, вирусный), сепсис, внутриутробная инфекция (хламидиоз, герпес, цитомегаловирусная инфекция, энтеровирусная инфекция, кандидоз, в том числе висцеральный, микоплазмоз);
- комплексной терапии хронических вирусных гепатитов B, С, D у детей и взрослых, в том числе в сочетании с применением плазмафереза и гемосорбции, при хронических вирусных гепатитах выраженной активности, в том числе осложненных циррозом печени;
- комплексной терапии у взрослых, в том числе беременных, с урогенитальной инфекцией (хламидиоз, цитомегаловирусная инфекция, уреаплазмоз, трихомониаз, гарднереллез, папилломавирусная инфекция, бактериальный вагиноз, рецидивирующий влагалищный кандидоз, микоплазмоз), первичная или рецидивирующая герпетическая инфекция кожи и слизистых оболочек, локализованная форма, легкое и среднетяжелое течение, в том числе урогенитальная форма;
- комплексной терапии острых респираторных вирусных инфекций, включая грипп, в том числе осложненных бактериальной инфекцией у взрослых.
Противопоказания: повышенная чувствительность к любому из компонентов препарата. Препарат разрешен к применению с 14-й недели беременности, не имеет ограничений к применению в период лактации.
Препарат обладает иммуномодулирующими (усиление фагоцитарной активности макрофагов, увеличение специфической цитотоксичности лимфоцитов к клеткам-мишеням), противовирусными, антипролиферативными свойствами.
В исследовании препарат назначали в в форме суппозиториев для ректального применения в дозе 150 000, 500 000 МЕ в зависимости от возраста двукратно с интервалом 12 часов десятидневным курсом с первого дня госпитализации.
Диагноз подтвержден методом полимеразной цепной реакции. Пациенты были разделены на две группы. Первую составили 35 детей, получавших стандартную терапию (СТ) в сочетании с препаратом ВИФЕРОН®, вторую – 35 детей, получавших лечение по стандартной методике.
Эффективность лечения оценивали по методологии, принятой в клинической эпидемиологии. Основа оценки – клинические исходы заболевания. В качестве критериев для определения клинического исхода использовались данные анамнеза и объективного обследования, лабораторных и инструментальных исследований.
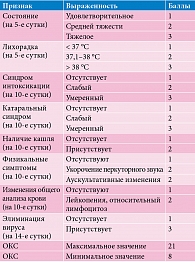
Выраженность клинических проявлений оценивали методом балльной оценки, разработанной В.А. Ревякиной (2003): 1 балл – симптомы отсутствуют; 2 балла – симптомы определяются, но причиняют минимальное беспокойство и легко переносятся; 3 балла – симптомы четко определяются, причиняют беспокойство, но в целом переносятся пациентом; 4 балла – симптомы ярко выражены, снижают активность или нарушают сон. Вычислялись суммарные показатели балльных критериев. Сумму баллов представляли в виде общего клинического счета (ОКС).
Спектр оцениваемых клинических исходов определяли на основании данных литературы о клинической картине заболевания. В настоящее время COVID-19 рассматривается как острая респираторная вирусная инфекция с преимущественным поражением нижних дыхательных путей. Заболевание может протекать в виде легкой острой респираторной вирусной инфекции или иметь тяжелое течение с развитием пневмонии. Инкубационный период инфекции колеблется от двух до 14 дней, хотя чаще составляет 3–7 дней. В начале заболевания у инфицированных детей в основном присутствуют лихорадка (87,9%) (в большинстве случаев умеренная), синдром интоксикации (38,1%), кашель (67,7%), заложенность носа, насморк (4,8%), диарея, головная боль. Одышка, цианоз и другие симптомы могут возникать по мере прогрессирования заболевания (обычно через неделю), часто сопровождаются системным токсикозом, недомоганием или беспокойством, плохим аппетитом и снижением активности. Наличие одышки и влажные хрипы при аускультации обычно указывают на пневмонию. Критерии быстрого дыхания: ≥ 60 раз/мин у детей младше двух месяцев; ≥ 50 раз/мин у детей 2–12 месяцев; ≥ 40 раз/мин у детей 1–5 лет; ≥ 30 раз/мин у детей старше пяти лет. При тяжелых формах дыхательная недостаточность достигает максимальной выраженности к 6–8-му дню болезни.
Мы оценивали эффективность терапии препаратом ВИФЕРОН® до начала исследования и на десятый день после начала лечения.
Первичные критерии клинической эффективности оценивались по следующим признакам:
- значительное улучшение: полное исчезновение признаков заболевания (снижение ОКС не менее чем на 60%);
- улучшение: частичное исчезновение признаков заболевания (снижение ОКС не менее чем на 40%).
Вторичные критерии клинической эффективности оценивались по количеству больных (%), у которых на десятый день болезни сохранялись следующие исходы: нарушенное состояние, лихорадка, синдром интоксикации, катаральный синдром, кашель, признаки дыхательной недостаточности, физикальные симптомы, изменения в общем анализе крови, рентгенологические признаки, элиминация вируса. Балльная оценка клинических проявлений СOVID-19 легкой формы у детей представлена в табл. 1.
Ключевые показатели вмешательства:
- частота исходов в группе лечения (ЧИЛ): рассчитывали как A/(А + В), где A – количество пациентов с наличием изучаемого исхода, В – количество пациентов с отсутствием изучаемого исхода;
- частота исходов в группе сравнения (ЧИК): рассчитывали как C/(С + D), где C – количество пациентов с наличием изучаемого исхода, D – количество пациентов с отсутствием изучаемого исхода;
- относительный риск, отношение рисков (ОР) – соотношение частоты изучаемых исходов среди больных, подвергавшихся воздействию лекарственного препарата: ЧИЛ/ЧИК. Позволяет определять силу связи между воздействием лекарственного средства и изучаемым исходом;
- повышение относительной пользы (ПОП): ПОП ≥ 1,0 – высокая вероятность исхода в результате лечения. ПОП < 1,0 – вероятность исхода снижается;
- число больных, которых необходимо лечить (ЧБНЛ) определенным препаратом, чтобы получить изучаемый исход у одного больного. Рассчитывали как 1/ЧИЛ - ЧИК;
- доверительный интервал (ДИ) отражает ошибку выборки. 95% ДИ показывает, что существует 95%-ная вероятность того, что при повторном эксперименте получится первоначальная величина;
- отношение шансов (ОШ) показывает, во сколько раз вероятность изучаемого исхода в основной группе выше (или ниже), чем в группе сравнения. Рассчитывали как (А/В)/(С/D). ОШ < 1 соответствует низкой вероятности, ОШ > 1 – высокой вероятности. ОШ = 1 означает такой же, как и в группе сравнения, результат.
Математическую обработку полученных данных проводили с помощью современного пакета статистического анализа SPSS Statistica 21,0. Для оформления результатов исследований применялись пакеты системы Microsoft Office и CorelDraw-10.
Схема статистического исследования включала проверку соответствия данных нормальному распределению, дескриптивную статистику с использованием непараметрических критериев для определения значимости различий (критерий χ2), анализ таблиц сопряженности, системный многофакторный анализ с определением интегральных показателей.
С помощью системного многофакторного анализа количественных характеристик, прошедших статистическую обработку и сгруппированных в логические системы, получили математические модели процесса.
В ходе системного многофакторного анализа многомерные количественные характеристики переводились в относительно сопоставимые путем вычисления относительной разности Xi каждого из параметров (средних арифметических значений), группировок и параметров, принятых за норму Хо. Вычислялись коэффициент влияния (Pi) каждого из полученных параметров во всех группировках и σ – среднеквадратичные отклонения Xi. На основании результатов были построены графики зависимости взвешенных средних от временного процесса, стадий или других заданных факторов, что представляло собой интегральную зависимость от времени или математическую модель изучаемого процесса, отражающую их характер, направленность и динамику.
Результаты
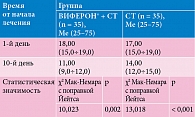
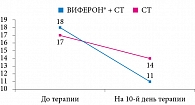
Анализ первичных критериев клинической эффективности по динамике ОКС. Динамика ОКС внутри групп (зависимые показатели ОКС до и после лечения) показала статистически значимые различия по критерию χ2 Мак-Немара с поправкой Йейтса (10,023 и 13,018 соответственно при р < 0,05). То есть выявлено значимое снижение ОКС в обеих группах наблюдения (табл. 2, рис. 1).
Показано отсутствие достоверных различий между группами в начале лечения (р > 0,05). На десятый день лечения в обеих группах отмечалось снижение ОКС, более выраженное в первой группе (стандартная терапия в сочетании с препаратом ВИФЕРОН®): 11,00 против 13,00 во второй группе (только стандартная терапия) (разность статистически достоверна, р < 0,05). Снижение ОКС у детей, применявших ВИФЕРОН®, составило 38,2%, что соответствовало результату «улучшение». В группе сравнения ОКС снизился на 22,4%.
Таким образом, показана целесообразность применения препарата ВИФЕРОН® при легкой форме СOVID-19 у детей. На фоне лечения у большинства детей первой группы наблюдалось улучшение, в то время как во второй группе снижение ОКС было меньше.
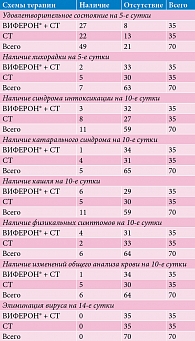
Анализ вторичных критериев клинической эффективности по клиническим исходам. Приводим сводную таблицу сопряженности по изучаемым клиническим исходам и расчет ключевых показателей оценки сравнительной эффективности вмешательства в группах пациентов при легкой форме СOVID-19 (табл. 3).
Анализ исхода «удовлетворительное состояние на пятые сутки». Удовлетворительное состояние на пятые сутки (табл. 4) при использовании препарата ВИФЕРОН® было достигнуто у 27 детей, на фоне СТ – у 22 пациентов (χ2 = 4,02; р = 0,045, разность статистически достоверна).
Зафиксирована высокая вероятность достижения данного клинического исхода в первой группе по сравнению со второй группой, поскольку показатель ОШ превысил 1,0 (ОШ 1,96 ± 0,32 при ДИ 1,06–3,65). То есть шансы достигнуть удовлетворительного состояния к пятому дню болезни у детей, получавших ВИФЕРОН®, в два раза выше. Доверительный интервал не содержит 1,0, то есть выявленная связь между фактором (применение исследуемого препарата) и изучаемым исходом статистически значима при p < 0,05. Сила связи между вмешательством и исходом оценивается как средняя, о чем свидетельствуют значения показателя ОР (ОР 1,22 ± 0,09 при ДИ 1,02–1,47) и коэффициента Пирсона (C' = 0,214). На основании этого можно предположить, что именно ВИФЕРОН® повлиял на улучшение состояния детей.
Итак, по исходу «удовлетворительное состояние на пятые сутки» применение препарата ВИФЕРОН® позволило улучшить результаты лечения.
Анализ исхода «наличие лихорадки на пятые сутки». У большинства детей в обеих группах лихорадочный синдром купировался к пятому дню госпитализации. На пятые сутки лихорадочный синдром сохранялся у двух детей первой группы и пяти детей второй группы (табл. 5). В данном случае не выявлено достоверных различий между группами (χ2 = 2,72; р = 0,10, разность статистически недостоверна).
Значение показателя ОШ (ОШ 0,39 ± 0,51 при ДИ 0,14–1,07) показывает, что вероятность сохранения лихорадки на пятые сутки заболевания в 2,5 раза выше во второй группе. Однако ДИ содержит 1,0, что свидетельствует об отсутствии статистической значимости связи между фактором и изучаемым исходом при p > 0,05. Отметим, что данный исход не связан с воздействием препарата ВИФЕРОН®, поскольку силу связи в данном случае можно оценить как слабую (ОР 0,43 ± 0,47 при ДИ 0,17–1,07; коэффициент Пирсона – 0,187).
Как видим, в отношении исхода «наличие лихорадки на пятые сутки» эффективность обеих схем одинакова.
Анализ исхода «наличие синдрома интоксикации на десятые сутки». Синдром интоксикации на десятые сутки наблюдался у трех детей первой группы и восьми детей второй группы (табл. 6). Интоксикационный синдром носил умеренный характер, проявлялся общей слабостью, снижением аппетита. Разность по данному синдрому была статистически достоверной (χ2 = 6,28; р = 0,013), то есть число пациентов с сохранением интоксикации к десятому дню на фоне применения препарата ВИФЕРОН® было достоверно ниже.
Показатель ОШ значительно ниже единицы при использовании препарата ВИФЕРОН® (ОШ 0,33 ± 0,42 при ДИ 0,15–0,76). Это позволяет предположить, что ВИФЕРОН® эффективнее стандартного лечения. Полученные данные свидетельствуют о более низкой вероятности неблагоприятного исхода в первой группе (вероятность в три раза ниже). Доверительный интервал не включает 1,0, что подтверждает статистическую значимость наблюдаемой зависимости при р < 0,05.
Показатель ОР в группах ВИФЕРОН® + СТ и СТ значимо ниже единицы (ОР 0,39 ± 0,37 при ДИ 0,13–0,72 и 0,42 при ДИ 0,21–0,92 соответственно), что говорит о низкой вероятности развития неблагоприятного исхода на фоне применения препарата ИФН альфа-2b с антиоксидантами. Причем степень связи между вмешательством и исходом оценивается как средняя (C' = 0,265).
Таким образом, выявлено преимущественное положительное влияние схемы лечения с применением препарата ВИФЕРОН® на синдром интоксикации.
Анализ исхода «наличие катарального синдрома на десятые сутки». Неблагоприятный исход (сохранение катаральных явлений свыше десяти суток) наблюдался только у одного ребенка первой группы и пяти детей второй группы (χ2 = 3,84; р = 0,05, разность статистически достоверна) (табл. 7).
Значение ОШ 0,25 при ДИ 0,07–0,93 свидетельствует о снижении в четыре раза вероятности длительного катарального синдрома при использовании препарата ВИФЕРОН®. ДИ не включает 1,0, что указывает на достоверную прямую связь между фактором и изучаемым исходом при р < 0,05. ОР составил 0,27 ± 0,63 (ДИ 0,08–0,95), что ниже 1,0 и свидетельствует о низкой вероятности затяжного катарального синдрома при использовании препарата ВИФЕРОН®. Степень связи вмешательства с исходом средней силы (коэффициент Пирсона – 0,22).
Итак, абсолютные значения исхода «наличие катарального синдрома на десятые сутки» показывают преимущество схемы с применением препарата ВИФЕРОН® (число неблагоприятных исходов – 3,0% при лечении препаратом ВИФЕРОН®, 11,0% – при стандартной терапии). Различия в показателях статистически достоверны, что позволяет сделать вывод о более высокой эффективности схемы с применением препарата ВИФЕРОН®.
Анализ исхода «наличие кашля на десятые сутки». При анализе этого синдрома по абсолютным значениям преимущества той или иной схемы не выявлено. Кашель сохранялся у шести детей первой группы и пяти детей второй группы соответственно. Разность статистически недостоверна (χ2 = 0,15; р = 0,70) (табл. 8).
ОШ 1,24 ± 0,39 при ДИ 0,58–2,65 и ОР 1,21 ± 0,33 при ДИ 0,63–2,33 показывают, что вероятность сохранения кашля в основной группе выше, чем в группе сравнения. Иными словами, имеется прямая связь с вероятностью наступления исхода.
Отсутствие связи исхода с вмешательством означает, что продолжительность кашля не зависит от схемы лечения.
Анализ исхода «наличие физикальных симптомов на десятые сутки». Физикальные симптомы сохранялись к десятому дню лечения у четырех детей, применявших ВИФЕРОН®, и двух пациентов, получавших СТ, – 11,0 и 6,0% соответственно. Преимущества той или иной схемы не выявлено, поскольку разность между показателями недостоверна (χ2 = 1,03; р = 0,31) (табл. 9).
ЧБНЛ составило 20,0, то есть только у каждого двадцатого больного по сравнению с группой со стандартным лечением будут наблюдаться физикальные симптомы, что говорит о равном влиянии схем терапии на данный исход.
ОР 1,83 ± 0,49 при ДИ 0,71–4,77 свидетельствует о повышении риска сохранения физикальных симптомов в первой группе. ДИ включает 1,0, поэтому можно сделать вывод об отсутствии статистической значимости влияния фактора на частоту исхода независимо от величины показателя ОР (p > 0,05).
Отсутствие связи между лечением препаратом ВИФЕРОН® и рассматриваемым исходом подтверждается значением коэффициента Пирсона (C' = 0,09; связь несущественная). Иными словами, наличие физикальных симптомов на десятый день лечения не зависит от схемы терапии.
Анализ исхода «наличие изменений общего анализа крови на десятые сутки». Изменения общего анализа крови сохранялись к десятому дню лечения у одного (3,0%) ребенка первой группы и пяти (14,0%) детей второй группы. Разность между показателями статистически достоверна (χ2 = 6,43; р = 0,01) (табл. 10).
ОШ 0,19 ± 0,65 при ДИ 0,05–0,68 позволяет предположить, что вероятность сохранения изменений со стороны общего анализа крови при лечении препаратом ВИФЕРОН® в пять раз ниже, чем в группе сравнения. То есть фактор применения препарата ВИФЕРОН® имеет обратную связь с вероятностью наступления исхода. Значения ДИ не содержат 1,0, поэтому можно сделать вывод о статистической значимости выявленной связи между фактором и исходом при p < 0,05.
ОР 0,21 ± 0,62 при ДИ 0,06–0,72 демонстрирует снижение вероятности исхода при воздействии препарата ВИФЕРОН® (обратная связь). ДИ не включает 1,0, поэтому можно сделать заключение о статистической значимости выявленной связи между применением препарата ВИФЕРОН® и исходом «наличие изменений общего анализа крови на десятые сутки» с вероятностью ошибки p < 0,05. Вывод подтверждается значением коэффициента Пирсона (C' = 0,27; связь средней силы).
Таким образом, применение препарата ВИФЕРОН® в схеме лечения детей с легкой формой СOVID-19 с высокой вероятностью (более чем в пять раз) способствовало нормализации общего анализа крови к десятому дню терапии.
Анализ исхода «элиминация вируса на 14-е сутки». Анализ данного исхода невозможен, поскольку в 100% случаев вирус элиминирован на 14-е сутки болезни. Данный исход не зависел от схемы терапии.
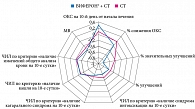
Результаты системного многофакторного анализа. Результаты системного многофакторного анализа показали меньшее отклонение в группе ВИФЕРОН® + СТ: значение взвешенного среднего (МВ) -0,31 (табл. 11, рис. 2). Худший результат лечения зафиксирован в группе СТ (МВ -0,39).
При оценке эффективности применения препарата ВИФЕРОН® у детей с легкой формой СOVID-19 наиболее информативными оказались ЧИЛ по критериям «наличие синдрома интоксикации» и «наличие катарального синдрома» на десятые сутки, которые имели высокие коэффициенты влияния. Данные выводы подтверждает n-мерная модель эффективности схем лечения детей с легкой формой СOVID-19 (рис. 2).
Системный многофакторный анализ показал целесообразность применения препарата ВИФЕРОН® при легкой форме СOVID-19. Отклонение от нормы интегрального показателя исхода в группе детей, получавших симптоматическую терапию, значимо выше, чем в первой группе: МВ 1,39 против +0,31.
В процессе лечения детей с легкой формой СOVID-19 препаратом ВИФЕРОН® нежелательных явлений не зафиксировано.
Обсуждение
В настоящее время применение препаратов интерферона в клинической практике признано мировым научным сообществом. Зарубежные и отечественные данные указывают на эффективность интерфероновых лекарственных средств при лечении различных острых респираторных вирусных инфекций, включая новую коронавирусную инфекцию COVID-19.
Результаты данного исследования подтвердили целесообразность применения препарата ВИФЕРОН® при легкой форме СOVID-19 у детей.
В результате анализа динамики ОКС (первичный критерий эффективности) выявлено улучшение у большинства детей первой группы. Во второй группе снижение ОКС было меньше. Системный многофакторный анализ продемонстрировал, что отклонение от нормы интегрального показателя исхода значимо выше в группе детей, которые находились на симптоматической терапии, – МВ 1,39. В группе препарата ВИФЕРОН® этот показатель составил +0,31.
Анализ вторичных критериев эффективности подтвердил значимую эффективность препарата ВИФЕРОН® в отношении общего состояния детей, синдрома интоксикации, катаральных явлений, нормализации показателей общего анализа.
Ye.S. Gasilina, PhD, Prof.
Samara State Medical University
Treatment of children with COVID-19 is an urgent medical task. The use of interferon drugs as a reliable means of preventing and treating COVID-19 infection in children's patients today does not raise questions among clinicians in many countries: these drugs have proven to be reliable medicines in the fight against COVID-19. Children's age has a number of features: insufficient synthesis of interferon in younger age groups, the presence of ‘early’ interferon in newborns, which does not have pronounced antiviral properties, special drug dosages of drugs. In addition, the identified molecular and biological mechanisms of the SARS-CoV-2 virus to inhibit the synthesis of interferon in human cells, contribute to the search for adequate and rational ways to prevent and treat COVID-19. The use of exogenous interferon drugs for the prevention and treatment of new coronavirus infection among children is etiologically and pathogenetically justified. In the work was to study the therapeutic effectiveness of the regimen of recombinant interferon-a2b with antioxidants, under the trade name VIFERON®, in dosage form-rectal suppositories, as part of complex therapy in children aged 1 to 17 years, compared with the standard treatment regimen for mild coronavirus infection COVID-19. In addition, the safety and tolerability of the VIFERON® regimen was evaluated rectal suppositories, as part of complex therapy in children aged 1 to 15 years, compared with the standard scheme of therapy of mild COVID-19 coronavirus infection. The high efficiency and safety of the use of the recombinant interferon-a2b drug with the antioxidants VIFERON® in a wide pediatric practice has been proven.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.