количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Альфа-липоевая кислота (Эспа-Липон) – доказательства эффективности лечения диабетической нейропатии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №2 (22)
- Аннотация
- Статья
- Ссылки
- English
Представлен обзор недавних работ по изучению механизма действия и эффективности альфа-липоевой (тиоктовой) кислоты у больных сахарным диабетом с поражением нервной системы. Показано, что патогенетическая терапия диабетических осложнений при помощи антиоксидантов (например, препарат тиоктовой кислоты Эспа-Липон) способствует снижению показателей окислительного стресса, уменьшению клинических симптомов диабетической нейропатии, улучшению гликемического профиля.
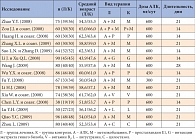
Таблица. Характеристика 15 протоколов исследований АЛК при ДН, включенных в метаанализ European Journal of Endocrinology, 2012
Диабетическая нейропатия (ДН) – комплекс клинических и субклинических синдромов, каждый из которых характеризуется диффузным или очаговым поражением периферических и/или автономных нервных волокон в результате сахарного диабета (СД). Выделяют различные формы ДН: периферическую (сенсорную, моторную) и автономную (вегетативную).
ДН является распространенным осложнением СД 1 и 2 типов. Частота нейропатии у больных СД колеблется, по данным разных исследователей, от 5 до 90% в зависимости от возраста, длительности заболевания, тяжести СД и методов диагностики. Так, при использовании для диагностики периферической сенсомоторной ДН электромиографии частота выявления ДН возрастает и достигает 70–90% [1]. По данным работы Диамобиля (передвижного диабетологического центра) в районах Новосибирской области в 2012 г., при обследовании 874 больных СД 2 типа частота ДН составила 50,8% (ДН выявлена у 444 человек). Диагностику ДН осуществляли путем определения вибрационной, болевой, температурной и тактильной чувствительности стандартными методами, выраженность проявлений полинейропатии оценивали с помощью шкалы неврологических расстройств NDS (Neuropathy Disability Score). При впервые выявленном СД 2 типа ДН диагностирована у 15,3%, при длительности диабета 1–5 лет – у 34,2% больных, при «стаже» СД 5–10 лет – у 55,4%, а при длительности СД более 10 лет частота ДН достигала 76,9%. Степень выраженности проявлений ДН по шкале NDS увеличивалась от 1 балла при впервые выявленном СД 2 типа до 2 баллов при длительности СД от 5 до 10 лет и составила 10 баллов при длительности болезни более 10 лет. Ранним признаком ДН в обследованной группе больных СД 2 типа были нарушения вибрационной чувствительности.
Причинами развития ДН служат как декомпенсация углеводного обмена, так и длительность заболевания, пожилой возраст, комы в анамнезе, ожирение, артериальная гипертония, гиперхолестеринемия, протеинурия [1, 2]. К прогрессированию поражения нервной системы при СД могут приводить хроническая почечная недостаточность и уремия, а также другие сопутствующие заболевания (гепатит, гипотиреоз, анемия, опухоли, дефицит витаминов группы B, заболевания соединительной ткани и некоторые наследственные болезни), а также интоксикации (алкоголизм).
Среди этиологических факторов ДН главное значение имеет хроническая гипергликемия. Ведущая роль гипергликемии подтверждается тем, что частота нейропатии у больных СД 1 и 2 типа практически одинакова. Хотя патогенез этих форм диабета различен, их общей чертой является гипергликемия и сниженный эффект инсулина. Длительная компенсация СД улучшает течение ДН и способствует резкому уменьшению частоты этого осложнения. Об этом убедительно свидетельствуют результаты проспективного многоцентрового исследования DССТ (The Diabetes Control and Complications Trial – Исследование по контролю сахарного диабета и его осложнений), в котором у пациентов с длительной компенсацией СД 1 типа удалось достичь значительного снижения частоты ДН (на 70%) по сравнению с больными, имеющими декомпенсированный СД.
В патогенезе ДН принимают участие хроническая ишемизация нервного волокна вследствие микроангиопатии, окислительный стресс, дефицит миоинозитола, нарушение образования фактора роста нервов, активация полиолового пути утилизации глюкозы с образованием сорбитола – высокотоксичного спирта, повреждающего нервные волокна, хроническое воспаление и генетические факторы [1, 2, 3].
Важная роль в патогенезе ДН принадлежит активации окислительных процессов с участием активированных кислородных метаболитов (АКМ) – окислительному стрессу. АКМ являются важными регуляторами клеточных процессов и ключевым элементом изменения программ дифференцировки, пролиферации и апоптоза клеток. Генерацию АКМ при СД связывают с гипергликемией, которая вызывает аутоокисление глюкозы, неферментативное гликирование белков и образование конечных продуктов повышенного гликирования (AGE’s – advanced glycation end products), усиление NADPH-оксидазной активности, интенсификацию сорбитолового пути, недостаточность ряда антиоксидантных ферментов [4]. Дисбаланс между прооксидантами и антиокислителями, вызывающий избыток свободных радикалов и накопление АКМ, приводит к поражению мембран и клеточных структур, что является основной причиной эндотелиальной дисфункции, окислительной модификации липопротеидов, внутрисосудистого тромбообразования, развития воспаления [3, 4, 5]. Повышенная генерация АКМ оказывает на нейроны и шванновские клетки прямой повреждающий эффект, а также может нарушать кровоток и вызывать эндоневральную гипоксию.
В последние годы интенсивно изучается использование антиоксидантов в эксперименте и у больных СД, что позволило получить сведения о механизме их действия и эффективности.
Большинство клинических работ в данной области посвящено применению альфа-липоевой (тиоктовой) кислоты (АЛК), которая является природным эффективным антиоксидантом и ко-антиоксидантом. АЛК – это универсальный «чистильщик» свободных радикалов, который работает как на мембране, так и в клеточной цитоплазме. При участии АЛК происходят регенерация и восстановление других антиоксидантов в организме через воздействие на тканевой глутатион и убихинон. Уникальность химической структуры АЛК позволяет ей стимулировать регенерацию клеточных структур самостоятельно, без участия других соединений.
АЛК также может выступать в качестве кофермента мультиферментных комплексов окислительного декарбоксилирования пировиноградной и альфа-кетокислот (альфа-кетоглутарата и разветвленных альфа-кетокислот). АЛК активирует пируватдегидрогеназу и подавляет пируваткарбоксилазу [4]. АЛК играет важную роль в процессе образования энергии (аденозинтрифосфата, АТФ), уменьшая, таким образом, дефицит энергии в тканях. Показана способность АЛК стимулировать синтез циклического аденозинмонофосфата (цАМФ) посредством активации рецепторов, связанных с G-белком и аденилатциклазой [6].
АЛК способна предотвращать образование конечных продуктов гликирования, тем самым снижая образование АКМ и уменьшая тяжесть окислительного стресса [4]. Нейропротективный эффект АЛК обусловлен не только ее антиоксидантными свойствами, но и способностью повышать уровень миоинозитола и креатинфосфата в нервах [3].
Уменьшение симптомов ДН при лечении препаратами АЛК может быть обусловлено улучшением эндоневрального кровотока на фоне лечения. Известно, что в развитии дисфункции эндотелия при СД важную роль играет активация ядерного транскрипционного фактора каппа-B (NF-κB) и других факторов транскрипции, чувствительных к окислительному стрессу. В эндотелиальных клетках NF-κB контролирует экспрессию ряда цитокинов, факторов роста, эндотелина-1. Показано, что в условиях окислительного стресса АЛК блокирует в клетках эндотелия активацию и поступление в ядро NF-κB и экспрессию генов, находящихся под его контролем. Даже трехдневное введение 600 мг АЛК перорально может приводить к снижению повышенного уровня NF-κB в моноцитах крови у больных СД [4].
В настоящее время доказаны противовоспалительные эффекты АЛК. Так, АЛК подавляет активность и цитотоксичность NK-клеток; лечение АЛК снижает уровень интерлейкинов 6 и 17 (ИЛ-6, ИЛ-17), пролиферацию Т-клеток (на 90%). В исследовании S. Salinthone и соавт. (2010) были представлены новые доказательства, поддерживающие гипотезу о том, что противовоспалительные свойства АЛК реализуются через каскад цАМФ/протеинкиназа А. Так, содержание цАМФ повышалось на 43% в течение 4 часов после инфузии АЛК, что сопровождалось снижением уровня провоспалительных цитокинов, а введение пептидного ингибитора протеинкиназы А блокировало подавляющее действие АЛК на ИЛ-1 и гамма-интерферон. Авторы считают, что действие АЛК реализуется посредством протеинкиназы А [6].
Необычным свойством АЛК оказалась способность улучшать утилизацию глюкозы тканями. Данный эффект связан с фосфорилированием тирозиновых остатков инсулиновых рецепторов, активацией транспортеров глюкозы GLUT-1 и GLUT-4 и рядом других эффектов в инсулинзависимых тканях. В плацебоконтролируемом исследовании S. Jacob и соавт. (1999) показали, что улучшение чувствительности к инсулину у больных СД 2 типа наблюдается через 4 недели перорального приема АЛК (600 мг) 1, 2 или 3 раза в день [3]. H. Ansar и соавт. (2011) показали значительное снижение тощаковой и постпрандиальной гликемии, улучшение показателей инсулинорезистентности в группе больных СД 2 типа, получавших АЛК в течение 2 месяцев в дозе 300 мг в сутки [7].
Улучшение гликемического профиля и снижение показателей окислительного стресса были отмечены в рандомизированном двойном слепом плацебоконтролируемом исследовании у больных СД 2 типа при лечении различными дозами АЛК (300, 600, 900 и 1200 мг/сут). Через 6 месяцев в группе лечения отмечалась тенденция к снижению уровня гликемии и HbA1c, степень снижения зависела от дозы АЛК. Экскреция с мочой PGF2α-IsoP (простагландин F2-альфа-изопростан) была ниже в группе лечения, чем плацебо. Авторы делают вывод о том, что применение АЛК ассоциируется с улучшением показателей гликемии и меньшей выраженностью окислительного стресса [8].
Терапевтическая эффективность АЛК в лечении ДН доказана в исследованиях ALADIN (Alpha-Lipoic Acid in Diabetic Neuropathy – Альфа-липоевая кислота при диабетической нейропатии) и DECAN (Deutsche Kardiale Autonome Neuropathie – Германское исследование кардиальной автономной нейропатии). Исследование ALADIN показало, что внутривенное введение больным СД 2 типа АЛК (600 и 1200 мг в течение 3 недель) уменьшает клинические симптомы ДН: боль, жжение, онемение, парестезии [9]. В исследовании DECAN доказана способность АЛК (800 мг/сут перорально в течение 4 месяцев) уменьшать проявления кардиальной автономной ДН, в частности, увеличивать вариабельность сердечного ритма [10].
Позже опубликованы результаты других клинических испытаний и постмаркетинговых исследований, подтвердивших эффективность АЛК. Важные данные получены в ходе исследования ALADIN-II. В рамках данного проекта было показано, что длительная пероральная терапия АЛК (600 или 1200 мг в течение 2 лет) позволяет не только контролировать симптомы периферической ДН, но и улучшать электрофизиологические показатели функции нервов [11]. В исследовании отмечен высокий профиль безопасности АЛК: частота побочных эффектов у принимавших препарат и в группе плацебо была одинаковой. Очевидным недостатком ALADIN-II стал высокий процент выбывания больных и выбраковки данных (в окончательный анализ включено лишь 65 из 299 пациентов).
Представляют интерес результаты исследования ALADIN-III. Эффективность препарата была исследована у 509 больных СД 2 типа с периферической ДН. После курса внутривенных инъекций (600 мг/сут в течение 3 недель) лечение было продолжено до 6 месяцев – прием АЛК перорально 1800 мг/сут, что способствовало закреплению достигнутого положительного эффекта и дальнейшему улучшению неврологических показателей [11].
По данным исследования ORРIL (ORal PILot Study), пероральный прием высоких доз АЛК (1800 мг/сут в течение 3 недель) эффективно контролирует симптомы периферической ДН и без предшествующего внутривенного введения препарата.
Для оценки влияния длительной, в течение 4 лет, пероральной терапии АЛК на прогрессирование ДН проведено многоцентровое двойное слепое плацебоконтролируемое исследование NATHAN I (Neurological Assessment of THioctic Acid in diabetic Neuropathy – Неврологическая оценка эффекта тиоктовой кислоты при диабетической нейропатии). В исследование включались больные СД 1 и 2 типа с ДН. В динамике (первичный исход) оценивали изменение сочетанного показателя, включающего динамику по шкале NIS (Neuropathy Impairment Score) – LL (Lower Limbs – нижние конечности), а также 7 дополнительных тестов нервной проводимости, предложенных P.J. Dyck и соавт. в 1997 г. Вторичные конечные точки включали оценки по шкалам NIS, NIS-LL, NSC (Neuropathy Symptom and Change), TSS (Total Symptom Score), оценку температурной чувствительности и электрофизиологические показатели. Исходы оценивали через 2 и через 4 года терапии. Первичный исход по показателю «NIS-LL + 7 электрофизиологических тестов» снизился на 0,45 в группе лечения и повысился на 0,34 в группе плацебо, однако эти различия не достигли уровня статистической значимости. Достоверные различия между группами отмечались через 4 года по показателю NIS и NSC: в группе лечения отмечено улучшение, в группе плацебо – ухудшение. В группе АЛК также значительно уменьшилась мышечная слабость (р = 0,045). Отмечено увеличение процента больных, ответивших улучшением на лечение в группе активной терапии по сравнению с плацебо. Электрофизиологические показатели, автономные тесты через 4 года не продемонстировали статистически достоверной разницы между группами. Проведенное исследование показало, что длительное лечение АЛК улучшает течение ДН, особенно состояние мелких волокон нервов и мышечную функцию. Отсутствие улучшения по первичной композитной точке связано в первую очередь с отсутствием значительного ухудшения в группе плацебо, что было опосредовано снижением уровня HbA1c [12].
Метаанализ клинических исследований ALADIN, SYDNEY (Symptomatic Diabetic NEuropathY trial – Исследование симптомной диабетической нейропатии), ORPIL, SYDNEY2 и ALADIN III (2011) выявил улучшение неврологической симптоматики при внутривенном введении АЛК по сравнению с плацебо. Значительное улучшение отмечено при сочетании парентеральной (600 мг в день 3 недели) и пероральной терапии (600 мг 1–3 раза в день в течение 6 месяцев). Дозы 600 мг и 1200 мг в день показали одинаковую эффективность, однако доза 1200 мг ассоциировалась с большей частотой побочных эффектов. Во всех исследованиях продемонстрировано достоверное уменьшение симптомов ДН, однако электрофизиологические показатели (особенно нервное проведение) менялись незначительно. Отчасти это может быть объяснено тем, что АЛК в большей степени улучшает состояние мелких нервных волокон, которое трудно оценить электрофизиологическими методами. Можно также предположить, что улучшение и сохранение нервного проведения станет очевидным через несколько лет после лечения (как в исследовании ALADIN II). Отмечено, что в исследовании NATHAN I было показано некоторое прогрессирование ДН в группе плацебо и улучшение ее течения в группе длительного лечения АЛК [13].
Интересно, что у больных с ДН после внутривенного введения АЛК в дозе 600 мг в течение 3 недель улучшение неврологических показателей сохраняется длительно, до 2 месяцев [14].
В опубликованном в European Journal of Endocrinology обзоре (2012) представлен метаанализ клинических исследований по оценке влияния АЛК на течение периферической ДН [15]. При этом в анализ включались исследования, в рамках которых проводили оценку эффективности по изменению клинических симптомов, сухожильных рефлексов и скорости проведения возбуждения по нерву. Поиск осуществлялся в базах данных Medline с 1966 до 2011 г., Embase с 1980 до 2011 г., Cochrane central register контролируемых исследований и Chinese Biological Medicine с 1978 до 2011 г. без языковых ограничений. В анализ были включены только рандомизированные контролируемые исследования, нерандомизированные исследования и клинические наблюдения исключались. Оценивались группы лечения, в которых АЛК назначалась по 300–600 мг в день в/в, группы контроля получали схожую терапию, исключая АЛК. Параметры оценки включали динамику (улучшение) симптомов, сухожильных рефлексов и скорости проведения возбуждения по нерву. Из анализа исключались исследования, использовавшие для оценки эффективности тесты TSS или NIS, и исследования, в которых эффективность оценивалась после в/в введения АЛК с последующим длительным пероральным ее приемом. Таким образом, в окончательный анализ вошли 15 протоколов исследований, включивших 1118 пациентов с ДН, средний возраст больных составил от 43,9 до 66,0 лет (таблица) [15]. Длительность лечения АЛК составляла от 14 до 28 дней. В девяти исследованиях оценивалась клиническая эффективность лечения (улучшение симптомов и сухожильных рефлексов): в группе больных, получавших АЛК, отмечено достоверное улучшение (р < 0,00001, отношение рисков 4,03, 95% ДИ 2,73; 5,94). В десяти исследованиях оценивалась скорость проведения по чувствительным и двигательным волокнам n. medianus. Преимущество АЛК доказано во всех случаях (отличия статистически достоверны, р < 0,00001). В восьми протоколах исследовалась скорость проведения возбуждения по моторным волокнам n. peroneus, в шести – по чувствительным. Преимущество АЛК также имело статистическую значимость (р < 0,00001). При этом в проведенных исследованиях не было сообщений о серьезных нежелательных явлениях. Таким образом, проведенный метаанализ показал, что назначение АЛК в/в на период 2–4 недели приводит к значительному (достоверному) повышению скорости проведения возбуждения по чувствительным и двигательным нервным волокнам у больных с периферической ДН. Лечение АЛК не связано с риском серьезных нежелательных побочных явлений [15].
Недавно были представлены результаты исследования, показывающие высокую эффективность применения АЛК в сочетании с другим антиоксидантом супероксиддисмутазой у 50 больных СД 2 типа, имеющих моторную и сенсорную формы ДН. После 4 месяцев лечения значительно улучшились показатели чувствительности и электронейромиографические параметры [16].
В настоящее время показана эффективность АЛК в лечении ДН не только у взрослых больных с СД, но и у детей и подростков [17]. Так, назначение АЛК в дозе 1800 мг в сутки перорально уже через 3 недели вызывало значительное улучшение чувствительности (по шкалам TSS, NDS) и положительно влияло на элекронейромиографические показатели, а поддерживающая терапия в дозе 600 мг в течение 2 месяцев приводила к стабилизации ДН. Авторы делают вывод, что АЛК может назначаться подросткам с СД 1 типа для лечения ДН.
В последние годы намечены подходы к профилактике и лечению других осложнений СД с помощью АЛК. Описано улучшение течения микроангиопатий при применении АЛК. Защитный эффект этого антиоксиданта при диабетической нефропатии связан со способностью препарата улучшать функцию вольтажзависимых анионных каналов мембраны митохондрий в почках [18]. У 32 больных с СД 2 типа с диабетической ретинопатией выявлена достоверная эффективность длительного применения АЛК (2 года) в дозе 600 мг в сутки для лечения ретинопатии (по картине глазного дна) [19]. В исследовании B.B. Heinisch и соавт. (2010) лечение АЛК в дозе 600 мг внутривенно в течение 3 недель улучшало эндотелийзависимую вазодилатацию при СД 2 типа [20]. Препарат не влиял на динамику макулярного отека. Так, при оценке эффективности применения АЛК в лечении макулярного отека у больных СД 2 типа (600 мг в сутки в течение 6 месяцев, группа на лечении – 235 больных, плацебо – 232 больных) не было получено достоверного терапевтического эффекта от АЛК [21].
Препараты АЛК различаются по дозировке, количеству активного вещества в таблетированной или инфузионной форме. В медицинской практике используется ряд инфузионных препаратов АЛК, которые представлены тремя солями: этилендиаминовой (Эспа-Липон, «Берлитион»), трометамоловой (Тиоктацид), меглюминовой (Тиогамма). Эспа-Липон компании “Esparma” выпускается в виде концентрата для приготовления раствора для инфузий (300 или 600 мг) и таблеток (600 мг). Препарат широко известен врачам, опыт его применения в России – более 15 лет. В небольших [22] и крупных клинических исследованиях [23] Эспа-Липон показал свою клиническую эффективность. В 1995 г. компания-производитель препарата (“Esparma Pharmazeutische Fabrik GmbH”) провела клиническое исследование ESPALIPON II [23], в котором приняли участие 3509 больных с ДН, получавших Эспа-Липон в дозе 600 мг/сут. Исследование было направлено на оценку эффективности и переносимости пациентами различных форм выпуска лекарственного препарата: Эспа-Липон раствор для инфузий, а также таблетки в оболочке для приема внутрь. В 83% случаев лечащие врачи и в 80% – пациенты оценили эффективность препарата как «очень хорошую» и «хорошую». В ходе лечения наблюдалось улучшение клинической симптоматики ДН: парестезий, болей, нарушений моторики и трофики. Помимо этого у больных отмечалось улучшение обмена веществ и снижение АД. В 95% случаев лечащие врачи и в 95% – больные оценили переносимость препарата как «хорошую» или «очень хорошую». В качестве побочных эффектов имели место слабая тошнота, головные боли, головокружение, диспепсия, а также чувство жжения и зуд/боль после быстрого в/в введения препарата. Наблюдаемые побочные эффекты препарата Эспа-Липон были указаны ранее в документации к препарату.
Таким образом, накопленные к настоящему времени данные позволяют рассматривать антиоксидант Эспа-Липон (АЛК) как весьма перспективный препарат, способный оказывать протективное действие на механизмы развития нейропатии и других осложнений диабета. Нерешенными остаются вопросы об адекватных дозах АЛК и длительности применения, критериях эффективности, а также о том, при каком уровне гликемии можно достигать максимального эффекта от применения препарата.
Основным методом профилактики ДН при СД является поддержание стабильной нормогликемии, которая препятствует активации процессов окислительного стресса. Достижение стабильной компенсации заболевания и использование патогенетических средств (Эспа-Липон) с доказанным терапевтическим эффектом являются важными и необходимыми способами коррекции окислительного стресса у больных СД и с поражением нервной системы.
1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Лечение сахарного диабета и его осложнений. Руководство для врачей. М.: Медицина, 2005. 512 с.
2. Бондарь И.А., Демин А.А., Королева Е.А. Диабетическая автономная нейропатия. Новосибирск: Издательство НГТУ, 2006. 164 с.
3. Меньщикова Е.Г., Зенков Н.К., Ланкин В.З. и др. Окислительный стресс. Патологические состояния и заболевания. Новосибирск: АРТА, 2008. 284 с.
4. Меньщикова Е.Б., Ланкин В.З., Зенков Н.К. и др. Окислительный стресс. Прооксиданты и антиоксиданты. М.: Фирма «Слово», 2006. 553 с.
5. Mollo R., Zaccardi F., Scalone G. et al. Effect of α-lipoic acid on platelet reactivity in type 1 diabetic patients // Diabetes Care. 2012. Vol. 35. № 2. P. 196–197.
6. Salinthone S., Yadav V., Schillace R.V. et al. Lipoic acid attenuates inflammation via cAMP and protein kinase A signaling // PLoS One. 2010. Vol. 5. № 9. P. e13058.
7. Ansar H., Mazloom Z., Kazemi F., Hejazi N. Effect of alpha-lipoic acid on blood glucose, insulin resistance and glutathione peroxidase of type 2 diabetic patients // Saudi. Med. J. 2011. Vol. 32. № 6. P. 584–588.
8. Porasuphatana S., Suddee S., Nartnampong A. et al. Glycemic and oxidative status of patients with type 2 diabetes mellitus following oral administration of alpha-lipoic acid: a randomized double-blinded placebo-controlled study // Asia Pac. J. Clin. Nutr. 2012. Vol. 21. № 1. P. 12–21.
9. Ziegler D., Hanefeld M., Ruhnau K.J. et al. Treatment of symptomatic diabetic peripheral neuropathy with the anti-oxidant alpha-lipoic acid. A 3-week multicentre randomized controlled trial (ALADIN Study) // Diabetologia. 1995. Vol. 38. № 12. P. 1425–1433.
10. Ziegler D., Gries F.A. Alpha-lipoic acid in the treatment of diabetic peripheral and cardiac autonomic neuropathy // Diabetes. 1997. Vol. 46. Suppl. 2. P. S62–S66.
11. Ziegler D., Hanefeld M., Ruhnau K.J. et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a 7-month multicenter randomized controlled trial (ALADIN III Study). ALADIN III Study Group. Alpha-Lipoic Acid in Diabetic Neuropathy // Diabetes Care. 1999. Vol. 22. № 8. P. 1296–1301.
12. Ziegler D., Low P.A., Litchy W.J. et al. Efficacy and safety of antioxidant treatment with α-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial // Diabetes Care. 2011. Vol. 34. № 9. P. 2054–2060.
13. McIlduff C.E., Rutkove S.B. Critical appraisal of the use of alpha lipoic acid (thioctic acid) in the treatment of symptomatic diabetic polyneuropathy // Ther. Clin. Risk. Manag. 2011. Vol. 7. P. 377–385.
14. Ametov A.S., Novosadova M.V., Barinov A.N. et al. Long-term effect of 3-week intravenous alpha-lipoic acid administration in symptomatic diabetic polyneutropathy with clinical manifestations // Ter. Arkh. 2010. Vol. 82. № 12. P. 61–64.
15. Han T., Bai J., Liu W., Hu Y. A systematic review and meta-analysis of α-lipoic acid in the treatment of diabetic peripheral neuropathy // Eur. J. Endocrinol. 2012. Vol. 167. № 4. P. 465–471.
16. Bertolotto F., Massone A. Combination of alpha lipoic acid and superoxide dismutase leads to physiological and symptomatic improvements in diabetic neuropathy // Drugs R. D. 2012. Vol. 12. № 1. P. 29–34.
17. Светлова Г.Н., Кураева Т.Л., Ходжамирян Н.Л., Петеркова В.А. Результаты применения Тиоктацида БВ в лечении диабетической периферической сенсомоторной нейропатии у детей и подростков с сахарным диабетом 1 типа // Сахарный диабет. 2007. № 1. С. 36–41.
18. Wang L., Wu C.G., Fang C.Q. et al. The protective effect of α-Lipoic acid on mitochondria in the kidney of diabetic rats // Int. J. Clin. Exp. Med. 2013. Vol. 6. № 2. P. 90–97.
19. Трахенберг Ю.А., Миленькая Т.М., Аметов А.С., Демидова Т.Ю. Изучение эффективности альфа-липоевой кислоты у пациентов с сахарным диабетом 2 типа и непролиферативной диабетической ретинопатией // Сахарный диабет. 2006. № 3. С. 39–41.
20. Heinisch B.B., Francesconi M., Mittermayer F. et al. Alpha-lipoic acid improves vascular endothelial function in patients with type 2 diabetes: a placebo-controlled randomized trial // Eur. J. Clin. Invest. 2010. Vol. 40. № 2. P. 148–154.
21. Haritoglou C., Gerss J., Hammes H.P. et al. Alpha-lipoic acid for the prevention of diabetic macular edema // Ophthalmologica. 2011. Vol. 226. № 3. P. 127–137.
22. Недосугова Л.В. Альфа-липоевая кислота (Эспа-липон) в комплексном лечении диабетической нейропатии // Международный эндокринологический журнал. 2007. Т. 8. № 2. С. 49–51.
23. Клиническое исследование Espalipon II. Дозировка 600 мг (№ исследования 616-14-94-002 02.05.1995).
Alpha-lipoic acid (Espa-Lipon): evidence-based efficacy of treatment of diabetic neuropathy
I.A. Bondar, Ye.A. Korolyova
State Budgetary Educational Institution for Higher Professional Education ‘Novosibirsk State Medical University’, Novosibirsk
Contact person: Irina Arkadyevna Bondar, bondaria@oblmed.nsk.ru
The authors review recent studies on the mechanisms of action of alpha-lipoic (thioctic) acid and its efficacy in diabetic neuropathy. In patients with complications of diabetes mellitus, pathogenetic treatment with antioxidants (e.g. thioctic acid preparation Espa-Lipon) reduces oxidative stress, improves diabetic neuropathy symptoms and glycemic profile.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.