Автономная нейропатия: как распознать
- Аннотация
- Статья
- Ссылки
- English
Благодаря научному прогрессу удалось хорошо изучить и классифицировать автономные нейропатии. Однако патогенез некоторых из них до сих пор остается неизвестным, что ограничивает подбор патогенетической терапии.
В статье рассматриваются примеры острых и хронических автономных нейропатий: их клинические проявления, подходы к диагностике и ведению. Отдельное внимание уделяется состояниям, лечение которых доступно в России: синдрому Гийена – Барре, сахарному диабету, транстиретиновому семейному амилоидозу.
Сахарный диабет занимает ведущие позиции в структуре причин развития хронических автономных нейропатий. Распространенность автономных нарушений зависит от типа сахарного диабета и составляет 54% для 1 типа и 73% для 2 типа. Самый неблагоприятный прогноз характерен для кардиальной диабетической автономной нейропатии, смертность при которой в пяти- – десятилетней перспективе составляет 27–56%.
Патогенетическая терапия диабетической автономной нейропатии не разработана. Единственной группой препаратов с доказанной эффективностью являются антиоксиданты на основе тиоктовой или альфа-липоевой кислоты. Альфа-липоевая кислота при диабетической нейропатии, нефропатии, кардиомиопатии и эректильной дисфункции показывает положительные результаты, особенно в отношении уменьшения нейропатической боли. Многие авторы подчеркивают важность мультидисциплинарного подхода в ведении пациентов с автономными нейропатиями и раннего начала реабилитации.
Благодаря научному прогрессу удалось хорошо изучить и классифицировать автономные нейропатии. Однако патогенез некоторых из них до сих пор остается неизвестным, что ограничивает подбор патогенетической терапии.
В статье рассматриваются примеры острых и хронических автономных нейропатий: их клинические проявления, подходы к диагностике и ведению. Отдельное внимание уделяется состояниям, лечение которых доступно в России: синдрому Гийена – Барре, сахарному диабету, транстиретиновому семейному амилоидозу.
Сахарный диабет занимает ведущие позиции в структуре причин развития хронических автономных нейропатий. Распространенность автономных нарушений зависит от типа сахарного диабета и составляет 54% для 1 типа и 73% для 2 типа. Самый неблагоприятный прогноз характерен для кардиальной диабетической автономной нейропатии, смертность при которой в пяти- – десятилетней перспективе составляет 27–56%.
Патогенетическая терапия диабетической автономной нейропатии не разработана. Единственной группой препаратов с доказанной эффективностью являются антиоксиданты на основе тиоктовой или альфа-липоевой кислоты. Альфа-липоевая кислота при диабетической нейропатии, нефропатии, кардиомиопатии и эректильной дисфункции показывает положительные результаты, особенно в отношении уменьшения нейропатической боли. Многие авторы подчеркивают важность мультидисциплинарного подхода в ведении пациентов с автономными нейропатиями и раннего начала реабилитации.


Введение
Автономная (вегетативная) нервная система обеспечивает регуляцию жизненно важных функций и поддержание гомеостаза. Заболевания с вовлечением автономной нервной системы могут поражать как центральный, так и периферический ее отделы. Их проявления разнообразны и представлены сердечно-сосудистыми, желудочно-кишечными, мочеполовыми, терморегуляторными, судомоторными, пупилломоторными расстройствами [1].
Автономные, или вегетативные, нарушения в той или иной степени сопровождают большинство генерализованных, симметричных нейропатий за счет повреждения немиелинизированных или слабо миелинизированных нервных волокон [1], однако собственно автономными нейропатиями (АН) считаются состояния с изолированным или преимущественным поражением автономной нервной системы. Примером таких АН могут быть синдром Гийена – Барре (СГБ), диабетическая, амилоидная или токсическая нейропатии.
На сегодняшний день АН достаточно хорошо изучены, что позволило классифицировать их по различным характеристикам, например, по течению – острые/подострые (табл. 1), хронические (табл. 2), по этиологии – наследственные, приобретенные, по распространенности – фокальные или генерализованные, преимущественно симпатические или парасимпатические [2, 3].
Целью данной статьи стало описание некоторых острых и хронических АН, что позволит быстрее проводить дифференциальную диагностику и своевременно подбирать соответствующую терапию курабельных состояний.
Синдром Гийена – Барре
Синдром Гийена – Барре – острая воспалительная, чаще демиелинизирующая, полирадикулонейропатия. СГБ является самой распространенной причиной острых периферических тетрапарезов и параличей. Данный синдром имеет монофазное течение с развитием клинической картины в течение четырех недель. Наряду с генерализованной слабостью, снижением или выпадением сухожильных рефлексов выявляются сенсорные и вегетативные нарушения. Морфологически СГБ характеризуется клеточной инфильтрацией, деструкцией миелина и иногда аксональной дегенерацией. В трети случаев заболевание требует проведения всего комплекса мероприятий интенсивной терапии, включая искусственную вентиляцию легких [4]. В двух третях случаев СГБ ассоциирован с вегетативными нарушениями, которые преимущественно вовлекают сердечно-сосудистую систему и желудочно-кишечный тракт. Согласно данным клиники Мэйо, наиболее тяжелое течение СГБ и более высокая смертность зарегистрированы у пациентов с вегетативными расстройствами [5]. Смертность в этой популяции составляет 7%, что диктует необходимость ранней диагностики, мониторинга и своевременной терапии сердечной и дыхательной недостаточности [6].
При СГБ в структуру сердечно-сосудистых нарушений входят колебания артериального давления, стойкая артериальная гипертензия, ортостатическая гипотензия, синусовая брадикардия, синусовая тахикардия, транзиторная кардиомиопатия.
Вклад АН в клиническую картину желудочно-кишечных расстройств оценить сложно в связи с тем, что они также могут возникнуть на фоне длительной иммобилизации, механической вентиляции, лекарственной терапии. Наиболее опасным осложнением является непроходимость кишечника. Описаны также случаи диареи, констипации, недержания [4].
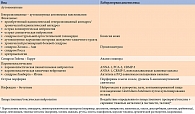
Особое внимание стоит уделить острой пандизавтономии. Эта форма СГБ проявляется выраженной ортостатической гипотензией, атонией мочевого пузыря, гастропатиями [2]. Полный спектр ее клинических проявлений представлен в табл. 3 [7]. Характерными особенностями патологии являются отсутствие изменений по данным электронейромиографии (ЭНМГ), а также медленное и неполное восстановление [7].
СГБ – это клинический диагноз. К обязательным его критериям относятся прогрессирующая мышечная слабость в конечностях, арефлексия или гипорефлексия в первые дни заболевания. Диагностика СГБ также включает исследование ликвора и проведение ЭНМГ [8].
При всех формах СГБ показано патогенетическое и симптоматическое лечение. Патогенетическая терапия заключается в проведении высокообъемного программного плазмафереза и/или высокодозном внутривенном введении препаратов иммуноглобулина класса G. Оба варианта патогенетической терапии имеют равнозначную эффективность (I (A)). Симптоматическая и сопутствующая терапии предполагают коррекцию осложнений, а также раннюю реабилитацию.
Диабетическая автономная нейропатия
Сахарный диабет (СД) – ведущая причина соматической и автономной нейропатии в развитых странах [3]. Распространенность автономных нарушений зависит от типа диабета, составляя 54% при СД 1 типа и 73% при СД 2 типа. Факторами риска их развития также являются длительность основного заболевания, возраст пациента, контроль гликемии, наличие метаболического синдрома, особенно при СД 2 типа [9]. Самым тяжелым осложнением СД с неблагоприятным прогнозом признана кардиальная АН. Частота ее встречаемости варьируется от 1 до 90% при СД 1 типа и от 20 до 73% при СД 2 типа [10]. Смертность при кардиальной АН в пяти- – десятилетней перспективе достигает 27–56%. Пациенты с кардиальной АН относятся к группе повышенного риска внезапной сердечной смерти [11]. У лиц с СД была продемонстрирована значимая корреляция между сердечно-сосудистой АН (ортостатическая гипотензия, непереносимость физических нагрузок, тахикардия покоя, безболевая ишемия миокарда) и смертностью [2]. Согласно данным национального регистра инфаркта миокарда, 32% больных диабетом, перенесших инфаркт, никогда не испытывали загрудинной боли [12].
Одним из проявлений диабетической АН также являются аритмии. В экспериментах на животных моделях показано, что симпатическая активность может дестабилизировать сердечный ритм, а повышение активности блуждающего нерва – оказывать защитное воздействие при развитии потенциально фатальной желудочковой аритмии [13].
Наиболее частым и ранним симптомом АН при СД считается эректильная дисфункция у мужчин. К другим урогенитальным проявлениям относят атонию мочевого пузыря, которая может осложняться задержкой мочи и восходящей инфекцией мочевых путей [14].
Гастроинтестинальные расстройства при диабетической АН нередки и разнообразны, так как в патологический процесс вовлекается весь желудочно-кишечный тракт. Поражение блуждающего нерва приводит к дисфагии, гастропарезу, диарее и запорам, замедлению опорожнения желчного пузыря. Гастропарез описан в отдельных клинических случаях и проявляется тошнотой, чувством переполнения желудка после приема пищи, в тяжелых случаях – повторяющейся рвотой, снижением веса [15].
Пупилломоторные расстройства при СД представлены нарушением адаптации к темноте, гиппусом, дисфункцией дилататора и сфинктера зрачка [16].
Диабетическая АН также приводит к денервации потовых желез, характеризуясь нарушением потоотделения, трофическими расстройствами со стороны кожи и потерей волос. Иногда пациенты жалуются на гипергидроз головы и туловища, что может быть компенсаторной реакцией на снижение потоотделения в нижних конечностях [13].
Диагностика диабетической нейропатии обычно не составляет труда и основывается на сборе жалоб, анамнеза и данных осмотра. Нейрофизиологическое обследование включает стандартный набор: ЭНМГ, кардиовагальное и судомоторное тестирование. При необходимости спектр диагностических процедур может быть расширен.
Мультидисциплинарный подход при диабетической нейропатии так же актуален, как и при любых состояниях, сопровождающихся АН. Патогенетическая терапия диабетической нейропатии с высоким уровнем доказательности эффективности до настоящего времени не разработана. Основная тактика направлена на профилактику осложнений, достижение и поддержание индивидуальных целевых показателей углеводного и липидного обменов и артериального давления (менее 140 мм рт. ст. для систолического и 85 мм рт. ст. для диастолического артериального давления), а также соблюдение гигиены стоп [7].
В качестве сопутствующей терапии диабетической нейропатии большой интерес представляют препараты метаболического действия с направленной антиоксидантной активностью на основе альфа-липоевой кислоты (АЛК), или тиоктовой кислоты.
В 1999 г. Диабетическим обществом врачей Германии АЛК была признана единственным средством с доказанной эффективностью для лечения диабетической нейропатии [15]. АЛК может восстанавливать другие антиоксиданты, такие как витамины Е и С, коэнзим Q10 и глутатион, то есть действует как универсальный антиоксидант [17]. Антиоксиданты играют важную роль в лечении больных диабетом из-за вызываемых гипергликемией стимуляции полиолового пути и образования конечных продуктов гликирования и активных форм кислорода [18].
В клинических испытаниях АЛК при диабетической нейропатии, нефропатии, кардиомиопатии и эректильной дисфункции получены положительные результаты, особенно в отношении уменьшения нейропатической боли [19]. В рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании продемонстрирована эффективность перорального приема АЛК в дозе 600 мг/сут при легкой и умеренной дистальной диабетической сенсомоторной полинейропатии [20].
В другом рандомизированном открытом исследовании активность АЛК изучалась в два последовательных этапа. Все участники получали АЛК перорально в дозе 600 мг/сут в течение четырех недель, при этом они не должны были принимать какие-либо лекарственные средства, облегчающие нейропатическую боль. У пациентов с СД 2 типа и симптоматической полинейропатией АЛК улучшала нейропатические симптомы, одновременно снижая частоту использования препаратов для неотложной помощи [21].
Было также показано, что АЛК протективно воздействовала на почечную ткань [22], способствовала снижению асимметричного диметиларгинина при нефропатии, улучшению осцилляторного потенциала и контрастной чувствительности при ретинопатии.
При диабетической кардиомиопатии АЛК обеспечивала протективный эффект за счет ингибирования активации нуклеарного фактора kB, снижения уровней fas-лиганда и матриксной металлопротеиназы 2 [23, 24].
Транстиретиновая семейная амилоидная нейропатия
Транстиретиновая семейная амилоидная нейропатия (ТТР-САП) – редкое прогрессирующее аутосомно-доминантное заболевание, характеризующееся отложением мутантного амилоидного белка транстиретина в органах и тканях. Амилоидные фибриллы кумулируются в сердце, периферических нервах, почках, глазных яблоках, в стенках мелких и средних артерий, артериол головного мозга [25, 26]. Описано более 150 мутаций в гене ТТР, однако самой распространенной считается мутация Val30Met.
Согласно данным регистра THAOS, Val30Met ассоциируется с более ранним началом вегетативных нарушений, их большей частотой и тяжестью [27]. Вегетативная дисфункция проявляется очень рано, вовлекая желудочно-кишечный тракт, мочеполовую и сердечно-сосудистую системы. Симптомы могут быть настолько выражены, что существенно снижают качество жизни и социальную активность. В отсутствие своевременного лечения длительная рвота, неконтролируемая диарея, выраженная ортостатическая гипотензия, кахексия на фоне мальабсорбции приводят к летальному исходу [28].
Вариабельная пенетрантность и генетическая гетерогенность обусловливают разнообразие клинических проявлений, разный возраст дебюта и тяжесть симптоматики, наличие спорадических форм, что значительно усложняет диагностический поиск, особенно на ранних стадиях.
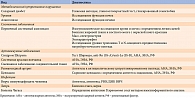
Для подозрения на ТТР-САП помимо периферической аксональной полинейропатии необходимо наличие «красных флагов», таких как карпальный туннельный синдром, поражение сердца (аритмии, блокады, рестриктивная кардиомиопатия), ортостатическая гипотензия, эректильная дисфункция, нарушение мочеиспускания, почечная недостаточность, непреднамеренное снижение массы тела, уменьшение аппетита, диарея и констипация, тошнота и рвота, катаракта, глаукома, синдром сухого глаза (рисунок) [29, 30].
Инструментальные и лабораторные методы диагностики ТТР-САП включают секвенирование ДНК, биопсию, например, кожи, нерва, сердца, слюнных желез, слизистой оболочки прямой кишки, ЭНМГ, исследование кардиовагального тонуса и судомоторной функции, сцинтиграфию сердца, электрокардиографию, эхокардиографию, исследование функции почек.
Как и при лечении всех АН, при ТТР-САП должен быть реализован мультидисциплинарный подход, когда команда профильных специалистов наблюдает за течением заболевания, корректирует дефицит и проводит профилактику присоединения инфекции, кахексии, сердечной недостаточности [29].
Для коррекции симптомов могут применяться не только препараты, но и оперативное вмешательство, например, трабекулопластика при неконтролируемой глаукоме или витрэктомия при деструкции стекловидного тела.
На сегодняшний день разработана патогенетическая терапия ТТР-САП. В России из лекарственных препаратов зарегистрирован тафамидис – стабилизатор молекулы белка транстиретина. В международном многоцентровом двойном слепом рандомизированном плацебо-контролируемом исследовании препарат обеспечивал поддержание должного уровня нутритивного статуса и качества жизни пациентов, а также замедлял прогрессирование полинейропатии [31]. Кроме того, у 90% пациентов была отмечена стабилизация мутантного белка. К патогенетической терапии ТТР-САП можно отнести и трансплантацию печени, которая существенно замедляет прогрессирование амилоидоза, а 20-летняя выживаемость больных после операции составляет 55,3% [32].
Токсические автономные нейропатии
Нейропатия может быть вызвана природными токсинами (яд медузы, сигуатоксины), промышленными ядами (органические растворители, мышьяк, ртуть, таллий и другие тяжелые металлы, акриламид, крысиный яд) и лекарственными препаратами (винкристин, доксорубицин) [3].
Известно, что применение винкристина ассоциировано с нейропатией блуждающего нерва, проявляющейся выраженными гастроинтестинальными симптомами, ортостатической гипотензией и дисфункцией мочевого пузыря. Группой российских ученых проведено исследование, показавшее, что в структуре автономных нарушений у пациенток с раком молочной железы на фоне химиотерапии преобладали кардиальные расстройства (аритмии, нарушение сердечной проводимости, снижение сократительной способности миокарда левого желудочка). Важным аспектом данного исследования стало формирование правильного реабилитационного диагноза и поиск оптимальной комплексной реабилитационной программы для женщин с раком молочной железы [33, 34].
Общий подход к диагностике автономных нейропатий
Системный подход при сборе анамнеза и осмотре – самый важный аспект диагностического поиска АН. При подозрении на вегетативную дисфункцию необходимо исключить вторичные причины (анемию, почечную недостаточность, феохромоцитому, заболевания щитовидной железы, сердца, прием медикаментов, алкоголизм), а также заболевания центральной нервной системы (альфа-синуклеинопатии, энцефалиты, травмы головного и спинного мозга, рассеянный склероз).
Выбор методов инструментальной и лабораторной диагностики должен соответствовать клинической картине. Некоторые исследования являются оператор-зависимыми (судомоторный аксон-рефлекс, биопсия, ЭНМГ), поэтому их лучше выполнять в экспертных центрах. Если на данном этапе уверенности в диагнозе нет, можно опираться на классификацию АН по характеру течения. При остро развившейся сенсомоторной дистальной полинейропатии необходимо исключить синдром Гийена – Барре. При ксерофтальмии стоит заподозрить болезнь Шегрена, выполнив исследование на наличие антител к цитоплазматическим антигенам – anti-Ro и anti-La, а также при необходимости биопсию слюнной железы губы. При хроническом течении АН в первую очередь следует определить уровень глюкозы в крови натощак и провести глюкозотолерантный тест. При подозрении на амилоидоз – электрофорез белков с иммунофиксацией, а также поиск депозитов амилоида при помощи сцинтиграфии сердца или биопсии пораженных тканей. Если имеет место семейный анамнез, то проводится генетическое консультирование и тестирование [2].
Заключение
Автономные нейропатии представляют собой сложную диагностическую задачу для клинициста, так как сопровождаются различными системными проявлениями, иногда без характерных для конкретного заболевания особенностей. Основным диагностическим инструментом является тщательный опрос и осмотр пациента. Дополнительные подтверждающие данные могут быть получены благодаря лабораторным анализам, электрофизиологическим и визуализационным исследованиям.
Нередко АН носят жизнеугрожающий характер. Своевременная и быстрая диагностика и, как следствие, своевременная патогенетическая и симптоматическая терапия могут обеспечить пациентам благоприятный прогноз на выздоровление.
При проведении лечебных мероприятий необходимо помнить о ранней психологической и физической реабилитации пациентов.
Применение АЛК при диабетической нейропатии, в том числе автономной нейропатии, является эффективным патогенетическим средством коррекции и профилактики угрожающих жизни состояний.
N.A. Suponeva, Corresponding member of the RASci., MD, PhD, Prof., N.V. Belova, PhD, D.A. Grishina, PhD, I.E. Luneva, D.G. Yusupova, PhD
Research Center of Neurology
Contact person: Natalia V. Belova, belovanv22@yandex.ru
Autonomic neuropathies are a heterogeneous group of diseases affecting isolated or predominantly autonomic nerve fibers. Clinical manifestations can be various, and depend on the prevalence and severity of the pathological process. Autonomic neuropathies significantly reduce the quality of life and social activity, and in some cases can cause death. Particularly dangerous are generalized forms damaging cardiovascular and gastrointestinal systems.
Due to scientific progress, autonomic neuropathies are well studied and classified, but the pathogenesis of some of them remains unknown, which limits the selection of pathogenetic therapy.
This article discusses examples of acute and chronic autonomic neuropathies: their clinical manifestations, approaches to diagnosis and management. Special attention is paid to conditions for which treatment is available in Russia: Guillain – Barre syndrome, diabetes mellitus, transthyretin familial amyloidosis.
Diabetes mellitus plays the first violin in the structure of the causes of chronic autonomic neuropathies. The prevalence of autonomic disorders in diabetes mellitus depends on the type of diabetes, being 54% for the first type and 73% for the second. A cardiac form of diabetic autonomic neuropathy has the most unfavorable prognosis, the mortality rate in which is 27–56% in a 5–10-year perspective.
Pathogenetic therapy for diabetic autonomic neuropathy has not been developed. The only group of drugs with proven effectiveness are antioxidants based on thioctic or alpha-lipoic acid. Alpha-lipoic acid in diabetic neuropathy, nephropathy, cardiomyopathy and erectile dysfunction shows positive results, especially in the reduction of neuropathic pain. Many authors emphasize the importance of a multidisciplinary approach in the management of patients with autonomic neuropathies and early initiation of rehabilitation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.