Анализ «затраты – полезность» режимов антибактериальной терапии острого неосложненного пиелонефрита
- Аннотация
- Статья
- Ссылки
- English
Цель. Провести анализ «затраты – полезность» различных вариантов эмпирической антибактериальной терапии неосложненного пиелонефрита при оказании стационарной медицинской помощи.
Материал и методы. При расчетах учтены данные литературы об эффективности, безопасности, полезности (сохраненных днях жизни с поправкой на качество (Quality-Adjusted Life Days – QALDs)) стартового режима антибактериальной терапии неосложненных пиелонефритов цефалоспоринами третьего поколения, фторхинолонами, аминогликозидами и карбапенемами в условиях оказания стационарной специализированной медицинской помощи. Построена модель «дерева решений». Составлен перечень прямых и непрямых затрат, на основании которого рассчитана стоимость одного случая терапии острого неосложненного пиелонефрита для каждой стратегии антибактериальной терапии. Проведен анализ «затраты – полезность».
Результаты. Анализ «затраты – полезность» продемонстрировал, что в лечении острого неосложненного пиелонефрита стратегия лечения гентамицином оказалась доминирующей по сравнению со стратегией лечения ципрофлоксацином, так как при меньших затратах обладала большей полезностью, и по сравнению со стратегией цефтриаксона, так как при равной полезности была менее затратной. Сравнение стратегии применения гентамицина и стратегии использования эртапенема показало, что дополнительная полезность в 0,001 QALDs потребует дополнительно 16 894 680 руб., что выше порога готовности платить в РФ.
Выводы. Стратегия лечения острого пиелонефрита аминогликозидами, в том числе в регионах с уровнем резистентности основных возбудителей более 10%, является не только эффективной и безопасной, но и экономически целесообразной.
Цель. Провести анализ «затраты – полезность» различных вариантов эмпирической антибактериальной терапии неосложненного пиелонефрита при оказании стационарной медицинской помощи.
Материал и методы. При расчетах учтены данные литературы об эффективности, безопасности, полезности (сохраненных днях жизни с поправкой на качество (Quality-Adjusted Life Days – QALDs)) стартового режима антибактериальной терапии неосложненных пиелонефритов цефалоспоринами третьего поколения, фторхинолонами, аминогликозидами и карбапенемами в условиях оказания стационарной специализированной медицинской помощи. Построена модель «дерева решений». Составлен перечень прямых и непрямых затрат, на основании которого рассчитана стоимость одного случая терапии острого неосложненного пиелонефрита для каждой стратегии антибактериальной терапии. Проведен анализ «затраты – полезность».
Результаты. Анализ «затраты – полезность» продемонстрировал, что в лечении острого неосложненного пиелонефрита стратегия лечения гентамицином оказалась доминирующей по сравнению со стратегией лечения ципрофлоксацином, так как при меньших затратах обладала большей полезностью, и по сравнению со стратегией цефтриаксона, так как при равной полезности была менее затратной. Сравнение стратегии применения гентамицина и стратегии использования эртапенема показало, что дополнительная полезность в 0,001 QALDs потребует дополнительно 16 894 680 руб., что выше порога готовности платить в РФ.
Выводы. Стратегия лечения острого пиелонефрита аминогликозидами, в том числе в регионах с уровнем резистентности основных возбудителей более 10%, является не только эффективной и безопасной, но и экономически целесообразной.
![Таблица 2. Значения QALDs для различных состояний [25–28]](/upload/resize_cache/iblock/ca5/195_350_1/Gomon5.jpg)







Введение
Острый неосложненный пиелонефрит – одна из часто встречающихся в клинической практике патологий. Так, в Российской Федерации ежегодно острый пиелонефрит переносят 0,9–1,3 млн человек [1]. Российское общество урологов рекомендует применение фторхинолонов в качестве стартового режима терапии острого пиелонефрита в регионах с уровнем резистентности внегоспитальных уропатогенов к фторхинолонам менее 10% [2]. Согласно данным многоцентровых микробиологических исследований UTIAP-I и UTIAP-II (2004), в Санкт-Петербурге уровень резистентности Escherichia coli к фторхинолонам составляет 13% [3]. Несмотря на это, фторхинолоны остаются одними из наиболее часто используемых антимикробных средств в эмпирической терапии уроинфекций [4]. Сведения о фактическом уровне резистентности в Санкт-Петербурге отсутствуют. Тем не менее существует возможность математического моделирования, которое позволяет прогнозировать актуальный уровень резистентности исходя из текущего потребления антимикробных препаратов [5]. Уровень антибиотикорезистентности – не единственный фактор, определяющий выбор эмпирического режима терапии: также крайне важны экономическая целесообразность и безопасность назначаемых антимикробных препаратов [2]. В рамках настоящего исследования проведен анализ «затраты – полезность» различных режимов антибактериальной терапии неосложненных острых пиелонефритов с учетом прогнозируемой динамики резистентности Escherichia coli как основного возбудителя уроинфекций. Выбраны стратегии, рекомендуемые Российским обществом урологов в качестве альтернативы цефалоспоринам и фторхинолонам при уровне резистентности Escherichia coli более 10%: аминогликозиды, а также карбапенем без антисинегнойной активности (эртапенем).
Цель
Провести анализ «затраты – полезность» различных режимов эмпирической антибактериальной терапии неосложненного пиелонефрита при оказании стационарной медицинской помощи.
Методы
Анализ «затраты – полезность» – частный случай анализа «затраты –эффективность», в котором мерой эффективности являются единицы полезности. Коэффициент, отражающий результаты анализа, представляет собой отношение затрат на лечение к эффективности, выраженной в единицах полезности, – сохраненные годы жизни с поправкой на качество (Quality-Adjusted Life Years – QALYs) и сохраненные дни жизни с поправкой на качество (Quality-Adjusted Life Days – QALDs). Чем меньше соотношение, тем выше экономическая целесообразность стратегии.
Коэффициент «затраты – полезность» (Cost-Utility Ratio – CUR) рассчитывается по формуле: CUR = З/Ut, где З – затраты, Ut – полезность [6]. При этом доминантной является стратегия, которая при наименьших затратах будет иметь наивысшую полезность. Индифферентными считаются стратегии с равным коэффициентом полезности затрат. В ситуации, когда при больших затратах имеется и большая полезность, проводят расчет инкрементального показателя (Incremental Cost-Utility Ratio – ICUR) [6]: ICUR = (З первого метода – З второго метода) / (Ut первого метода – Ut второго метода), где З – затраты, Ut – полезность.
Сведения о значениях QALYs/QALDs при различных состояниях взяты из литературных источников. Было принято, что 1 QALYs соответствует 365 QALDs. Расчет полезности осуществляли умножением длительности состояния на значения показателя полезности. Для нежелательных явлений также учитывали вероятность развития события.
Характеристика затрат и показателей эффективности
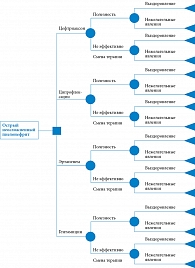
Структура «дерева решений». Клинико-экономическая оценка антибактериальной терапии при неосложненных острых пиелонефритах у госпитализированных пациентов проводилась с помощью модели «дерева решений» (рис. 1) [7]. Модель «дерева решений» основана на сведениях о применении антимикробных препаратов в реальной клинической практике при лечении внегоспитальных неосложненных острых пиелонефритов, полученных в рамках кросс-секционного исследования «Повышение эффективности расходования средств обязательного медицинского страхования в медицинских организациях Санкт-Петербурга» [4]. Кроме того, использовались данные по эффективности и безопасности различных режимов эмпирической антибактериальной терапии у пациентов с внегоспитальными неосложненными острыми пиелонефритами из других источников. В качестве исходов при построении модели анализа решений выбраны выздоровление и нежелательные явления.
Полезность лечения. Критерием полезности был выбран показатель сохраненных дней жизни с поправкой на качество (QALDs).
Безопасность лечения. Отсутствие нежелательных явлений, требующих отмены антибактериальной терапии, и/или серьезных нежелательных явлений на фоне проводимой терапии и в течение последующего 30-дневного периода наблюдения. Под серьезными нежелательными явлениями понимали реакции, влекущие за собой смерть, угрожающие жизни состояния, состояния, требующие экстренной госпитализации или увеличения сроков текущей госпитализации, развитие генетических нарушений, дефектов развития, злокачественных и доброкачественных образований, снижение жизненной активности на срок три месяца и более, инвалидизацию [8].
Определение случая острого неосложненного пиелонефрита
Пиелонефрит – неспецифический инфекционно-воспалительный процесс, характеризующийся одновременным или последовательным поражением чашечно-лоханочной системы и паренхимы почек (преимущественно интерстициальной ткани).
Неосложненный пиелонефрит – пиелонефрит, развивающийся в интактной почке (без аномалий развития и видимых нарушений уродинамики верхних мочевых путей) [2].
Динамика бактериальной резистентности: структура статистической модели
За основу модели брали регрессионную модель, разработанную ранее для моделирования резистентности [5]. Данный подход удобен при анализе нестационарных временных рядов с учетом влияния независимых факторов, в данном случае – фактора потребления. Обобщенный вид модели с учетом некоторых изменений:
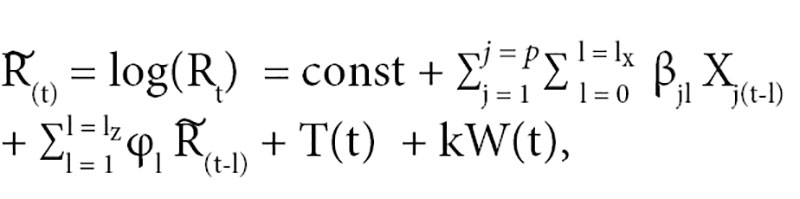
В результате был стратифицирован риск развития антибактериальной резистентности при существующей стратегии потребления антимикробных препаратов. Потребление измеряли в установленных суточных дозах (Defined Daily Dose), деленных на количество койко-дней в периоде. При этом койко-дни учитывали общие, а не только койко-дни пациентов, проходящих терапию конкретным антимикробным препаратом. Подобный показатель варьировался от 0 до 1, что примерно соотносится с количеством пациентов, получающих лечение конкретным антимикробным препаратом.
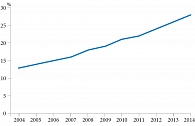
С учетом полученных данных проведено моделирование, при котором на вход подавали данные о существующей структуре потребления антимикробных препаратов (установленные суточные дозы, разделенные на количество койко-дней) и оценивали значения полученной резистентности. При построении модели использовали единственные доступные сведения о бактериальной резистентности Escherichia coli при уроинфекциях в РФ, согласно которым в 2004 г. доля БЛРС-продуцирующих штаммов Escherichia coli в Санкт-Петербурге составляет 13% [3]. Математическое моделирование позволило рассчитать резистентность Escherichia coli в динамике, которая составила 15% за десять лет (2004–2014 гг.) (рис. 2) [5, 6]. Полученные результаты (см. рис. 2, табл. 1) косвенно подтверждаются результатами эпидемиологического исследования ДАРМИС (2010–2011 гг.), которое показало, что средний показатель резистентности Escherichia coli к ципрофлоксацину в РФ составил 23% [9].
Стоимость лечения
Был составлен перечень прямых затрат:
- стоимость различных схем антибактериальной терапии с учетом длительности пребывания пациентов в стационаре;
- стоимость терапии в случае развития нежелательных явлений с учетом частоты встречаемости;
- стоимость тарифа обязательного медицинского страхования (ОМС) «острый пиелонефрит».
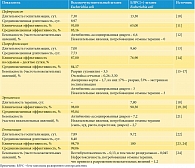
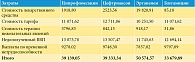
К непрямым затратам относили выплаты по временной утрате трудоспособности, недополученный внутренний валовый продукт (ВВП) вследствие развития временной нетрудоспособности. Данные для построения математической модели представлены в табл. 1–8 [10–30].
Согласно п. 1 ч. 1 ст. 7 Федерального закона от 29.12.2006 № 255-ФЗ (ред. от 03.12.2011) «Об обязательном социальном страховании на случай временной нетрудоспособности и в связи с материнством», пособие по временной нетрудоспособности при утрате трудоспособности вследствие заболевания или травмы застрахованному лицу, имеющему страховой стаж восемь и более лет, выплачивают в размере 100% среднего заработка [31]. При учете восьмилетнего страхового стажа и возраста пациентов было сделано допущение о том, что выплаты по временной нетрудоспособности составят 100% среднего заработка. Согласно Федеральному закону от 29.12.2006 № 255-ФЗ, первые три дня периода временной нетрудоспособности оплачиваются работодателем, остальные дни – Фондом социального страхования. Таким образом, при расчете затрат Фонда социального страхования на выплату пособий по временной нетрудоспособности исходили из длительности периода временной нетрудоспособности с учетом, что первые три дня выплаты осуществляются за счет работодателя [32].
При оценке недополученного ВВП отталкивались от того, что в течение периода временной нетрудоспособности все пациенты (28–70 лет) не вносят вклад в ВВП страны. Подушевой ВВП за 2015 г. – 1505,85 руб./день [32].
Анализ
Основной сценарий. Стоимость болезни оценена для каждой стратегии лечения пациента целевой группы. Если менее дорогостоящая стратегия оказывалась более эффективной, она считалась доминирующей. Если более дорогостоящая стратегия была более эффективной, то выполнялся инкрементальный анализ.
Анализ чувствительности. Вероятностный анализ чувствительности проводили, чтобы проверить устойчивость полученных результатов основного сценария к изменениям в таких ключевых параметрах, как эффективность антимикробных препаратов и затраты. При выполнении данного анализа изменяли параметры по одному от 75 до 125% их ценностей и от полученного результата вычисляли рентабельность [7].
Генератор случайных чисел использовали для получения значений параметров из каждого распределения. Эти значения пропускали через модель и таким образом получали оценки затрат и эффективности для каждой стратегии лечения, которые применяли для вычисления коэффициентов эффективности затрат.
Результаты
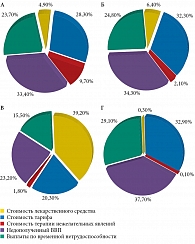
Были рассчитаны суммарные затраты при применении сравниваемых стратегий антибактериальной терапии острого пиелонефрита (для всех стратегий горизонт моделирования составил год) (табл. 9). При горизонте моделирования в один год затраты на один случай острого неосложненного внегоспитального пиелонефрита были максимальными при применении эртапенема (50 574,57 руб.). Стратегии лечения ципрофлоксацином и цефтриаксоном были приблизительно равными по затратам (39 139,05 и 39 333,34 руб. соответственно). Наименьшие затраты (33 679,89 руб.) отмечали на фоне терапии гентамицином. Как видно из данных, представленных на рис. 3, разница в затратах обусловлена стоимостью антимикробных препаратов: наименьшие затраты были при применении гентамицина (0,3%), наибольшие – при использовании эртапенема – 39,2%. При этом разница в затратах на антимикробные препараты не компенсировалась уменьшением непрямых затрат. Наибольшие затраты на купирование нежелательных явлений отмечали на фоне терапии ципрофлоксацином (до 9,7%), наименьшие – на фоне терапии гентамицином (0,1%). Минимальная стоимость тарифа была на фоне терапии эртапенемом (20,3%), наибольшая – на фоне терапии цефтриаксоном (32,3%), что связано с длительностью госпитализации.
Анализ «затраты – полезность»
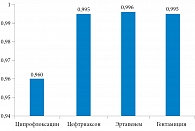
С учетом расчетных коэффициентов, длительности госпитализации, а также частоты развития нежелательных явлений был рассчитан показатель QALDs. Горизонт моделирования составил год (рис. 4). Наибольшие показатели полезности наблюдались на фоне терапии эртапенемом за счет наименьших сроков госпитализации и отсутствия серьезных нежелательных явлений, требующих пролонгации госпитализации и/или приводящих к инвалидизации. Наихудшие результаты получены для ципрофлоксацина, что обусловлено серьезными нежелательными явлениями: аневризмой аорты, в том числе фатальной, а также требующей экстренной госпитализации и протезирования аорты, отслойкой сетчатки, включая случаи резидуального снижения зрения, несмотря на проводимые оперативные вмешательства.
В связи с тем что стратегия с эртапенемом была полезнее, но затратнее, был проведен расчет ICUR (табл. 10). Анализ «затраты – полезность» продемонстрировал, что при терапии острого неосложненного пиелонефрита стратегия применения гентамицина доминировала над стратегией применения ципрофлоксацина, так как при меньших затратах обладала большей полезностью, а также доминировала над стратегией применения цефтриаксона, так как при равной полезности была менее затратна. Сравнение стратегии применения гентамицина и стратегии применения эртапенема показало, что дополнительная полезность в 0,001 QALDs потребует дополнительно 16 894 680 руб., что выше порога готовности платить в РФ [33].
Анализ чувствительности
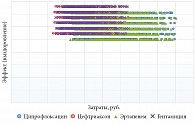
Вероятностный анализ чувствительности выполняли путем многократного одновременного изменения таких показателей, как эффективность и стоимость антимикробных препаратов, отклоняя параметры от исходного результата на ±5% и ±25% их значения соответственно (рис. 5). При одновременном многократном изменении указанных параметров и рассмотрении показателя «частота выздоровления на один случай острого неосложненного пиелонефрита» стратегия проведения антибактериальной терапии гентамицином при большей эффективности оставалась наименее затратной и поэтому доминантной. Результаты анализа чувствительности подтверждают выводы, полученные в основном сценарии.
Обсуждение
Целью настоящего исследования было проведение анализа «затраты – полезность» существующих стратегий антибактериальной терапии неосложненных острых пиелонефритов. Ввиду отсутствия отечественных данных относительно динамики резистентности Escherichia coli как основного возбудителя острых пиелонефритов в расчет приняты данные математического моделирования [5]. В качестве критерия полезности использовали QALDs, а критерия безопасности – риски развития нежелательных реакций. Учитывали как прямые, так и непрямые затраты.
Анализ «затраты – полезность» показал, что стратегия лечения острого неосложненного пиелонефрита гентамицином оказалась доминантной по сравнению со стратегиями применения цефтриаксона и ципрофлоксацина. Что касается терапии эртапенемом, при больших затратах эта стратегия обладала и большей полезностью: ICUR составил 16 894 680 руб., что выше порога готовности платить в РФ [33].
При острых заболеваниях анализ «затраты – полезность» проводится значительно реже, чем при хронических социально значимых (например, сахарном диабете или онкологических заболеваниях). Несмотря на относительно короткую длительность острого эпизода, оценка качества жизни остается крайне важной задачей. При высокой распространенности заболевания даже небольшие различия в общих затратах или QALDs на пролеченного пациента значимо влияют на бюджет системы здравоохранения. Так, учитывая, что в РФ ежегодно острый пиелонефрит переносят порядка 1 млн человек, выбор в качестве альтернативы ципрофлоксацину гентамицина 240 мг один раз в сутки позволит сохранить до 35 000 QALDs и порядка 5,5 млрд руб. в год, что обусловлено в том числе худшим профилем безопасности фторхинолонов. Крупные когортные исследования показали повышенные риски коллаген-ассоциированных нежелательных побочных реакций на фоне приема фторхинолонов, в частности отслойки сетчатки, разрывов сухожилий, а также аневризм аорты, в том числе фатальных [15–17].
Согласно российским и международным рекомендациям, аминогликозиды рассматриваются как потенциальная альтернатива и эмпирической, и целенаправленной терапии, поскольку уровень резистентности к аминогликозидам остается низким среди БЛРС-продуцирующих Escherichia coli [2]. В то же время выбор этой группы антимикробных препаратов ограничивается представлениями лечащих врачей о высоких рисках нефро- и ототоксичности. В исследовании D.P. Nicolau и соавт. 2184 пациента получали гентамицин в режиме 240 мг/сут внутривенно. При этом нефротоксичность развилась в 1,2% случаев и разрешилась самостоятельно после отмены антимикробных препаратов, а ототоксичность развилась в 0,13% случаев [23]. В то же время в исследованиях S.H. Park и соавт., S.H. Wie и соавт. показана высокая клиническая эффективность аминогликозидов в терапии острого пиелонефрита как в случаях БЛРС-продуцирующих штаммов Escherichia coli, так и случаях высокочувствительных штаммов [19, 22]. Высокая клиническая эффективность обусловлена в том числе уникальными фармакокинетическими характеристиками аминогликозидов: высокой концентрацией в моче, зависимым от концентрации бактерицидным эффектом, что предоставляет преимущество при лечении острого пиелонефрита [22]. Таким образом, аминогликозиды – эффективная и экономически целесообразная альтернатива карбапенемам при нетяжелых острых неосложненных пиелонефритах, вызванных БЛРС-продуцирующими штаммами Escherichia coli. Требуются дополнительные усилия по поиску стратегии введения этой группы препаратов, чтобы минимизировать потенциальные риски токсичности.
Выводы
Стоимость одного случая терапии острого неосложненного пиелонефрита гентамицином была наименьшей в сравнении с альтернативными стратегиями (33 679,89 руб.). Анализ «затраты – полезность» показал, что стратегия терапии гентамицином являлась доминантной по сравнению со стратегиями применения цефтриаксона и ципрофлоксацина, так как при меньших затратах обладала большей полезностью. Инкрементальный анализ продемонстрировал, что дополнительные затраты, связанные с приростом полезности в 0,001 QALDs на фоне терапии эртапенемом, составят 16 894 680 руб., что выше порога готовности платить в РФ.
Рекомендации
Для более точного расчета клинико-экономической эффективности применения антимикробных препаратов необходим мониторинг динамики уровня резистентности на территории РФ, а также совершенствование системы фармаконадзора.
Ограничения исследования
В модель не включались пациенты, у которых течение пиелонефрита осложнилось развитием сепсиса.
В расчет не принимались проводимые оперативные вмешательства в случаях неэффективности консервативной терапии из-за отсутствия доступных статистических данных о частоте и виде оперативных вмешательств. Ввиду благоприятного прогноза заболевания при построении модели летальность была принята равной нулю.
Круг клинических исследований, в которых оценивалась эффективность режимов эмпирической антибактериальной терапии, ограничивался тем, что во многих работах в качестве критерия эффективности использовалась суррогатная конечная точка – микробиологическая излеченность, которая определялась как эрадикация возбудителя или снижение его титра менее 103 КОЕ/мл.
При расчете непрямых затрат не учитывался недополученный ВВП вследствие смерти пациентов от разрыва аневризмы, так как в исследовании, данные которого приняты в расчет, использовалась база данных пациентов старше 65 лет, то есть лиц нетрудоспособного возраста [15].
Yu.M. Gomon, A.S. Kolbin, Yu.Ye. Balykina, M.A. Arepyeva, S.V. Sidorenko, V.V. Strizheletsky, I.G. Ivanov
Academician I.P. Pavlov First St. Petersburg State Medical University
St. George the Great Martyr Hospital, Saint Petersburg
Saint Petersburg State University, Saint Petersburg
Pediatric Research and Clinical Center for Infectious Diseases under the Federal Medical Biological Agency, Saint Petersburg
North-Western State Medical University named after I.I. Mechnikov, Saint Petersburg
Contact person: Yuliya Mikhaylovna Gomon, gomonmd@yandex.ru
Relevancy. The Russian society of urologists recommends the use of fluoroquinolones as a starting mode of therapy for acute pyelonephritis in regions with the level of resistance of extrahospital uropathogens to fluoroquinolones less than 10%. Despite the resistance level in St. Petersburg in 2004 of 13%, fluoroquinolones remain first-line drugs in the treatment of patients with acute pyelonephritis at the hospitals.
Purpose. Cost-benefit analysis of different variants of empirical antibacterial therapy for uncomplicated pyelonephritis in hospital care.
Materials and methods. The calculations take into account the literature data on the effectiveness, safety, utility (Quality-Adjusted Life Days – QALDs) of the starting regime of antibacterial therapy of uncomplicated pyelonephritis with cephalosporins of the 3rd generation, fluoroquinolones, aminoglycosides and carbapenems in terms of hospital specialized medical care. The model of ‘decision tree’ is constructed. A list of direct and non-direct costs was compiled, on the basis of which the cost of 1 case of acute uncomplicated pyelonephritis therapy for each strategy of antibacterial therapy was calculated. The cost-utility analysis was performed.
Results and discussion. Cost-utility analysis demonstrated that the strategy of therapy of acute uncomplicated pyelonephritis gentamicin was dominated by the strategy of therapy with ciprofloxacin, as with less had a greater usefulness; dominated strategy сeftriaxone, as equal usefulness was less expensive. As for the comparison of the strategy of therapy with acute pyelonephritis gentamicin therapy ertapenem, the cost analysis showed that the additional utility of 0.001 QALDs will require an additional 16 894 680 rubles, which is higher than the threshold of willingness to pay in Russia.
Conclusions. The strategy of therapy of acute pyelonephritis with aminoglycosides including in regions with the level of resistance of the main pathogens more than 10% is not only effective and safe, but also economically feasible.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.