Базальноклеточный рак на фоне синдрома Горлина – Гольца: клинические особенности и возможности терапии
- Аннотация
- Статья
- Ссылки
- English


Введение
Синдром Горлина – Гольца (синдром Горлина, синдром базальноклеточного невуса, синдром невоидной базальноклеточной карциномы, синдром множественных базальноклеточных опухолей, пятый факоматоз) – редкий врожденный или развившийся de novo (около 30%) синдром с аутосомно-доминантным наследованием и высокой пенетрантностью (около 97%). Вероятность наследования составляет 50%.
Первые упоминания о синдроме относятся к 1894 г. (Jarisch W., White J.C.), основные клинические проявления были описаны и систематизированы в 1960 г. американскими врачами R.J. Gorlin (дерматолог) и R.W. Goltz (стоматолог) по результатам наблюдения за группой пациентов [1].
Синдром базальноклеточного невуса обусловлен инактивирующей гетерозиготной герминальной мутацией преимущественно в гене PTCH1 (9q-хромосомы, до 70%) и значительно реже в гене PTCH2 (1p-хромосомы, частота неизвестна) или SUFU (10q-хромосомы, до 4%) [2, 3]. Однако у каждого четвертого пациента при генетическом исследовании не удается выявить вышеупомянутые варианты мутаций [4], что может быть обусловлено постзиготическим мозаицизмом (при развитии синдрома de novo), несовершенством использованных молекулярно-генетических методов исследования или иными генами, вовлеченными в патологический процесс.
Ген PTCH1 кодирует трансмембранный гликопротеин PTCH1, опухолевый супрессор сигнального пути Hedgehog, который играет ключевую роль в регуляции эмбрионального развития, а также пролиферации и дифференцировке клеток [5].
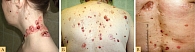
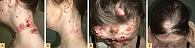
Данный синдром характеризуется нарушением эмбриогенеза в виде скелетных, офтальмологических, неврологических и других аномалий развития, а также предрасположенностью к развитию первично-множественного базальноклеточного рака кожи (БКРК) и медуллобластомы. БКРК может развиваться с двухлетнего возраста, но в среднем проявляется к 20 годам [6]. Риск развития БКРК в течение жизни достигает 90%, при этом количество опухолевых образований может варьировать от нескольких единиц до нескольких тысяч. Опухолевые очаги чаще возникают на открытых участках кожи (голова, шея, верхняя часть туловища и верхние конечности), однако также могут появиться на коже, не подверженной инсоляции [7] (рис. 1).
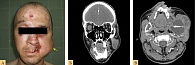
Инактивация одной копии гена PTCH1 вследствие герминальной мутации обусловливает дизэмбриогенез и характерный для данного синдрома фенотип, в то время как инактивация второй копии гена вследствие внешнего воздействия (ультрафиолет, ионизирующая радиация, химические канцерогены и др.) приводит к полному прекращению функционирования опухолевого супрессора и активации канцерогенеза. Поэтому пациентам с синдромом Горлина – Гольца необходима максимальная защита от солнечного воздействия (использование солнцезащитных средств с высоким SPF 50+, закрытой одежды и головных уборов), а также противопоказано проведение лучевой терапии и ряда методов лучевой диагностики (выполнять лучевую диагностику в тех случаях, когда она повлияет на выбор тактики лечения), которые сами по себе могут провоцировать появление новых опухолей кожи [8–10] (рис. 2, А).
Клинически и гистологически БКРК на фоне генетического заболевания не отличается от спорадических форм БКРК, однако имеет тенденцию к более агрессивному течению.
Распространенность синдрома Горлина – Гольца варьирует от 1 на 31 000 до 1 на 256 000 человек, с частотой 1 на 18 976 новорожденных [11, 12], который выявляется примерно в 1% случаев БКРК. При нетипичном клиническом течении опухоли кожи, наличии стигм дизэмбриогенеза, а также необычном внешнем виде пациента нельзя исключить наследственный генодерматоз, что крайне важно для выбора правильной тактики лечения БКРК.
Риск развития медуллобластомы достигает 1,2–2,4% при гетерозиготной мутации в гене PTCH1 и повышается в 20 раз при варианте синдрома, обусловленном гетерозиготной мутацией в гене SUFU [13, 14].
Клинические особенности синдрома Горлина – Гольца
Клинические диагностические критерии для синдрома Горлина – Гольца были впервые предложены D.G. Evans и соавт. в 1993 г. и впоследствии неоднократно дополнялись и обновлялись (V.E. Kimonis и соавт., 1997; A.F. Bree и соавт., 2011) [15–17]. Всего описано более 100 клинических признаков, разделенных по значимости на большие и малые диагностические критерии, наличие которых позволяет установить диагноз клинически.
К большим диагностическим критериям относятся:
- раннее развитие БКРК (в возрасте до 20 лет) или множественный БКРК (рис. 1, рис. 2, А);
- одонтогенные кисты (в возрасте до 20 лет) (рис. 2);
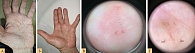
- пальмарные/плантарные вдавления (≥ 2) – бессимптомные, непальпируемые углубления от 1 до 3 мм на коже ладоней и/или подошв, обусловленные частичным или полным отсутствием рогового слоя (рис. 3);
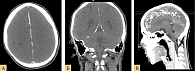
- интракраниальная эктопическая кальцификация – ламеллярная кальцификация серпа мозга, намета мозжечка (рис. 4);
- медуллобластома (десмопластический вариант) в возрасте до трех лет;
- синдром Горлина – Гольца у близкого родственника.
Среди малых клинических критериев:
- реберные аномалии: расщепление или слияние ребер (рис. 5);
- макроцефалия;
- выступающие лобные бугры (рис. 6, Г), расширенная переносица, прогнатизм;
- расщелина губы/неба;
- лимфомезентериальные кисты, единичные или множественные (чаще всего бессимптомные, могут кальцифицироваться);
- глазные аномалии (косоглазие, гипертелоризм, врожденная катаракта, глаукома, колобома) и др.;
- пороки развития костной системы (клиновидная деформация позвонков, кифосколиоз, spina bifida, укорочение четвертой пястной кости, постаксиальная полидактилия, синдактилия, деформация Шпренгеля, воронкообразная или клиновидная деформация грудной клетки и др.);
- патология развития турецкого седла;
- фиброма яичника/сердца и др.
В соответствии с современными представлениями (консенсус экспертов) и клиническими рекомендациями, синдром Горлина – Гольца может быть установлен на основании [9, 17]:
- наличия одного большого клинического критерия и генетического подтверждения;
- наличия двух больших клинических критериев;
- наличия одного большого и двух малых клинических критериев.
Таким образом, синдром Горлина – Гольца может быть диагностирован и без генетического подтверждения. Тем не менее генетическое исследование может быть рекомендовано в следующих случаях:
- подтверждение диагноза у пациентов с недостаточным количеством клинических диагностических критериев;
- прогностическое исследование у пациентов из группы риска, у которых имеется близкий родственник с синдромом Горлина – Гольца;
- пренатальное тестирование при наличии известной семейной мутации.
При установлении синдрома Горлина – Гольца в связи с высоким риском развития злокачественного новообразования рекомендовано следующее.
- По поводу риска развития БКРК. Ежегодный осмотр кожи всей поверхности тела, включая кожные покровы, защищенные от солнца, до появления первого очага БКРК, далее осмотры каждые 3–6 месяцев в зависимости от количества и частоты появления новых очагов БКРК [9].
- По поводу риска развития медуллобластомы. Детям с мутацией в гене PTCH1 – выполнение магнитно-резонансной томографии (МРТ) головного мозга при наличии неврологических симптомов. Детям с синдромом Горлина – Гольца без генетического подтверждения или с мутацией в гене SUFU – МРТ головного мозга каждые четыре месяца до трех лет и далее два раза в год до пяти лет (медуллобластома чаще проявляется в возрасте до трех лет) [9].
- Дифференциальный диагноз следует проводить прежде всего с синдромом Базекса, множественной папулезной трихоэпителиомой и синдромом Мьюира – Торре.
Возможности терапии БКРК на фоне синдрома Горлина – Гольца
Лечение БКРК следует проводить в соответствии с международными/национальными клиническими рекомендациями [9]. В настоящее время научно обоснованного подхода к лечению множественного БКРК у пациентов с синдромом Горлина – Гольца не существует, поэтому варианты терапии БКРК на фоне наследственного заболевания такие же, как и при спорадическом БКРК, за исключением лучевой терапии, которая в данном случае противопоказана [8–10] (см. рис. 2, A).
Методы локального воздействия
Хирургическое иссечение является золотым стандартом и основным методом лечения при немногочисленных очагах БКРК. При локально-агрессивных опухолях
и/или опухолях, расположенных в зонах высокого риска (центральные отделы лица, веки, брови, периорбитальные области, нос, губы, подбородок, нижняя челюсть, околоушная и заушная области, складки кожи лица, висок, ушная раковина, а также гениталии, ладони и стопы), хирургия по методу Моса предпочтительнее обычного хирургического иссечения [10].
У пациентов с многочисленными опухолями небольших размеров, узловыми или поверхностно-распространяющимися формами БКРК могут также применяться другие методы локального воздействия, включая кюретаж с электрокоагуляцией, лазерную/криодеструкцию, фотодинамическую терапию (ФДТ), применение крема имихимод, а также их комбинирование, поскольку множественные хирургические вмешательства сами по себе могут являться источником болевых ощущений, дискомфорта, а также обусловливать неудовлетворительные функциональные и эстетические результаты лечения.
Методы локального воздействия обеспечивают удовлетворительный локальный контроль отдельных опухолевых очагов [8, 10].
Системная терапия
При неэффективности или невозможности применения локальных методов лечения по поводу первично-множественного и/или местно-распространенного БКРК может быть назначена таргетная терапия висмодегибом, ингибирующим патологически активный сигнальный путь Hedgehog в опухоли. Таргетная терапия демонстрирует высокую эффективность (рис. 6, 7), частота объективных ответов достигает 80% [18], однако контроль болезни сохраняется в процессе терапии и некоторое время после ее окончания, что требует непрерывного и длительного применения препарата. После прекращения таргетной терапии рост опухолей возобновляется даже при морфологически подтвержденном полном ответе [19] (рис. 6, Г).
Прерывистое применение висмодегиба
В настоящее время режимы прерывистого применения висмодегиба не одобрены, однако в ходе рандомизированного клинического исследовании MIKIE были апробированы два прерывистых режима применения висмодегиба с оценкой их эффективности и безопасности. Пациенты с множественным БКРК (не менее шести очагов) распределялись в две группы терапии висмодегибом: в группе А – 116 пациентов (44 пациента с синдромом Горлина – Гольца) получали терапию висмодегибом в течение 12 недель, далее 8 недель плацебо, далее 12 недель терапии; в группе B – 113 пациентов (41 пациент с синдромом Горлина – Гольца) получали терапию висмодегибом в течение 24 недель, далее 8 недель плацебо, 8 недель терапии висмодегибом (в таком режиме до 73 недель). По данным исследования, среднее количество очагов БКРК на 73-й неделе в группе лечения A уменьшилось на 62,7% (95% доверительный интервал (ДИ) 53,0–72,3) и в группе лечения B – на 54,0% (95% ДИ 43,6–64,4). Частота нежелательных явлений 3–4-й степени тяжести в обеих группах была сопоставима. Таким образом, оба прерывистых режима применения висмодегиба продемонстрировали хорошую активность при длительном применении у пациентов с множественным БКРК [20].
Описание собственных клинических данных
Синдром Горлина – Гольца – это редкий синдром, тем не менее в период с 2012 по 2023 г. в отделении онкодерматологии (ранее – отделение биотерапии опухолей) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России наблюдались и/или получали терапию десять пациентов с первично-множественным и/или местно-распространенным БКРК на фоне синдрома Горлина – Гольца, который был установлен на основании современных диагностических критериев (табл. 1; рис. 1–7).
Характеристика пациентов
Большинство пациентов были женщины (мужчин – трое, женщин – семь). Средний возраст на момент обращения в НМИЦ – 44 года (диапазон от 28 до 66 лет).
У всех десяти пациентов отмечалось первично-множественное опухолевое поражение кожи лица и туловища, у пяти пациентов также отмечалось поражение кожи шеи и волосистой части головы, у двух пациентов – конечностей, у одного пациента – промежности. У четырех пациентов заболевание приобрело местно-распространенный характер. Количество гистологически подтвержденных очагов БКРК варьировало от 15 до > 100 на одного пациента. Средний возраст на момент появления первых очагов БКРК составил 22 года (диапазон от 5 до 35 лет).
Учитывая наследственный характер синдрома и длительный анамнез появления очагов БКРК в течение жизни, большинство пациентов проходили многолетнее комплексное лечение (табл. 2) в разных учреждениях и в итоге обратились в НМИЦ им. Н.Н. Блохина для консультации и/или терапии.
В данной статье проанализированы методы лечения БКРК у пациентов с синдромом Горлина – Гольца в контексте современных рекомендаций.
Терапия БКРК, проводимая пациентам (n = 10)
Хирургическое лечение. Девяти пациентам из десяти проводилось хирургическое лечение в количестве от одного до 35 хирургических вмешательств с удовлетворительным контролем проявлений заболевания, повторные хирургические иссечения проводились по поводу новых опухолевых очагов.
Другие методы локального воздействия. Двум пациентам из десяти проводились ФДТ, и/или криодеструкция, и/или лазерная деструкция опухолей с удовлетворительным контролем опухолевых очагов и косметическим результатом.
Трем пациентам из десяти проводилась близкофокусная или дистанционная лучевая терапия, которая пациентам с синдромом Горлина – Гольца противопоказана и способствует образованию новых очагов БКРК (см. рис. 2, А – новый очаг БКРК на коже лобной области после лучевой терапии).
Лекарственная терапия. Семи пациентам из десяти проводилась системная лекарственная терапия:
четыре пациента из семи получали терапию ретиноидами/интерфероном/диклофенаком или химиотерапию, которые продемонстрировали наименьшую эффективность в виде краткосрочной стабилизации опухолевых очагов;
пяти пациентам из семи проводилась таргетная терапия висмодегибом, который обеспечил длительный контроль заболевания у четырех из пяти пациентов с достижением двух полных ответов (один клинический – после четырех месяцев терапии и один морфологически подтвержденный – после 11,5 месяца терапии) и два глубоких частичных ответа на лечение, которые, однако, сохранялись только при продолжении таргетной терапии (рис. 6, 7). Продолженный рост опухолей и/или рецидив развивался в ближайшие недели после временного прекращения таргетной терапии (рис. 6, Г).
Среди них:
- двое пациентов вынуждены продолжать терапию висмодегибом более пяти и восьми лет (с перерывами терапии при перебоях в лекарственном обеспечении, вследствие изоляции во время пандемии COVID-19 или по иным причинам);
- один пациент получал висмодегиб в течение трех месяцев с выраженным частичным ответом (–60%), далее перерыв три месяца вследствие развития алопеции 1-й степени с последующим возобновлением терапии в течение трех месяцев и приостановкой терапии из-за проблем с обеспечением препаратом;
- один пациент получает терапию висмодегибом более 14 месяцев с перерывами в связи с развитием полного клинического ответа и возобновлением терапии после развития рецидива заболевания;
- один пациент получал висмодегиб около одного-двух месяцев с неизвестным эффектом и летальным исходом по неизвестной причине.
Переносимость терапии висмодегибом в целом удовлетворительная, среди нежелательных явлений были отмечены: мышечные спазмы 1–3-й степени у трех из четырех пациентов, дисгевзия 1-й степени у двух из четырех пациентов, алопеция 1–2-й степени у трех из четырех пациентов, лихорадка 1-й степени у одного из четырех пациентов, нерегулярные менструации 1-й степени у одного из четырех пациентов, папилломатоз кожи туловища 1-й степени у одного из четырех пациентов, снижение веса 1-й степени у одного из четырех пациентов.
Одному пациенту из десяти проводилась локальная терапия курадермом с краткосрочным контролем заболевания.
Одному пациенту из десяти не проводилось никаких видов лечения, поскольку синдром был выявлен случайно (пациент обратился в НМИЦ онкологии им. Н.Н. Блохина с подозрением на злокачественное новообразование нижней челюсти, по данным биопсии злокачественный характер образования был исключен, диагностирована одонтогенная киста).
Обсуждение
Главный принцип управления рисками развития БКРК на фоне синдрома Горлина – Гольца заключается в пожизненной максимальной защите от ультрафиолетового воздействия, недопустимости проведения лучевой терапии и ограничении в использовании методов лучевой диагностики (например, выполнение МРТ и ультразвукового исследования вместо компьютерной томографии).
Динамическое наблюдение с регулярным осмотром всех кожных покровов позволяет своевременно и последовательно выявлять очаги БКРК для проведения радикального хирургического вмешательства, а также хирургии по Мосу для очагов в зонах высокого риска.
При множественном опухолевом поражении возможно применение дополнительных методов локального контроля, включая кюретаж с электрокоагуляцией, лазерную/криодеструкцию, ФДТ, применение крема имихимод, а также их комбинирование.
Системная таргетная терапия демонстрирует исключительную непосредственную эффективность при БКРК на фоне синдрома Горлина – Гольца, однако не обладает курабельным потенциалом. Таким образом, назначение таргетной терапии может быть рассмотрено при первично-множественном и/или местно-распространенном БКРК, который не поддается методам локального контроля.
В связи с необходимостью проведения длительной таргетной терапии и исходя из результатов клинического исследования MIKIE, у пациентов с БКРК может быть рассмотрена возможность проведения прерывистой терапии висмодегибом (официально не одобрена ни в одной из стран).
Пациенты с синдромом Горлина – Гольца, которые обращались в НМИЦ онкологии, в основном не были информированы о необходимости защиты от солнечного излучения. Каждому третьему пациенту ранее проводилась лучевая терапия и/или многократные лучевые методы диагностики, которые могли оказать негативное влияние на клиническое течение опухолевых поражений кожи.
Половина пациентов не проходили специального наблюдения по поводу опухолевого поражения кожи и на момент обращения уже имели десятки очагов БКРК разной степени распространенности.
Практически всем пациентам проводилось хирургическое лечение с удовлетворительным контролем заболевания. Только двум пациентам проводились дополнительные методы локального контроля с удовлетворительным эффектом. Половина пациентов получали таргетную терапию висмодегибом, выраженный эффект отмечен у четырех из пяти пациентов. В силу технических причин пациенты получали таргетную терапию в прерывистом режиме.
Заключение
Проявления дизэмбриогенеза или необычный внешний вид пациента на фоне злокачественных новообразований кожи могут быть проявлением наследственного генодерматоза. Синдром Горлина – Гольца может контролироваться при регулярном наблюдении, адекватном лечении и информировании пациента о рисках и мерах профилактики. Своевременное выявление и лечение опухолевых проявлений наследственного генодерматоза при участии мультидисциплинарной команды, а также генетическое консультирование могут предотвратить осложеннное течение заболевания и улучшить качество жизни пациентов.
N.N. Petenko, PhD, K.V. Orlova, PhD, V.V. Nazarova, PhD, Iu.A. Filippova, O.N. Cherepanova, PhD, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
RUDN University
Contact person: Natalia N. Petenko, n.petenko@gmail.com
Gorlin-Goltz syndrome is a rare hereditary disorder characterised by multiple congenital abnormalities and cancer predisposition – basal cell cancer (BCC) and medulloblastoma. BCC develops in most patients throughout their life.
The number of BCCs varies from a few to several thousand. In this paper we describe the diagnostic features for Gorlin-Goltz syndrome and treatment options for BCC associated with this hereditary disease. We analysed our clinical experience and presented data on patients with multiple BCC related to Gorlin-Goltz syndrome who were referred to N.N. Blokhin National Medical Research Center of Oncology from 2012 to 2023 (n = 10).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.