Современные возможности лекарственной терапии БКР
- Аннотация
- Статья
- Ссылки
- English

Введение
Базально-клеточный рак кожи (БКРК) – самая распространенная злокачественная опухоль, на долю которой приходится до 80% всех злокачественных образований кожи. Заболеваемость БКРК в мире продолжает расти (на 2% в год) и составляет несколько миллионов случаев в год. При этом реальные показатели заболеваемости систематически недооцениваются, поскольку во многих странах они не регистрируются из-за отсутствия канцер-регистров. Стандартные методы локального лечебного воздействия высокоэффективны, однако в 2% случаев отмечается агрессивное течение БКРК с местно-распространенным процессом. Иногда (в литературе описано несколько сотен случаев) имеет место регионарное и/или отдаленное метастазирование, когда локальное лечение неэффективно или невозможно [1, 2]. Согласно клиническим рекомендациям NCCN (National Comprehensive Cancer Network – Национальная онкологическая сеть США), главной целью лечебного вмешательства является не только излечение от первичного БКРК, но и максимальное сохранение функции при минимальном косметическом дефекте [3].
Патогенез
БКРК развивается из стволовых клеток воронки фолликула или межфолликулярного эпидермиса [4] и в большинстве случаев (до 90%) обусловлен патологической активацией клеточного сигнального пути Hedgehog (Hh) вследствие мутаций. Сигнальный путь Hh активируется при соединении лиганда Sonic hedgehog со своим рецептором Patched (Ptch) на поверхности клетки. В результате высвобождается внутриклеточный протеин Smoothened (Smo), который перемещается на поверхность клетки и активирует семейство протеинов SuFu и GLI, индуцирующих транскрипцию и трансляцию генов-мишеней Hh, принимающих участие в росте и делении клеток [5]. Чаще возникает мутация Ptch (11,5–66,7%), реже Smo (9,5–25,8%), Sufu (4,8%) [6]. Этот сигнальный путь играет фундаментальную роль в эмбриональном развитии, формировании органов и тканей, поэтому у детей и взрослых он неактивен.
Реактивация сигнального пути Hh обусловлена развитием ряда опухолей, в частности медуллобластомы, рабдомиосаркомы, злокачественных опухолей желудочно-кишечного тракта, рака легкого, рака молочной и предстательной железы, БКРК [5].
Первые свидетельства о том, что сигнальный путь Hh может быть чувствителен к ингибированию, были получены при наблюдении за овцами, у которых вследствие употребления в пищу тератогенного растения (чемерицы калифорнийской) рождалось одноглазое потомство [7]. Позднее из этого растения было выделено активное вещество, получившее название циклопамина. В исследованиях на животных было показано, что циклопамин ингибирует сигнальный путь Hh [8] и вызывает регрессию БКР у мышей [9]. В дальнейшем усовершенствованное производное циклопамина стало объектом клинических исследований.
Лекарственное лечение БКРК
Подобная терапия заключается в местном и системном лекарственном воздействии. Местное лекарственное лечение может быть применено при БКРК низкого риска. Главными преимуществами такого лечения являются хороший косметический эффект, сохранение окружающих тканей и возможность использования в домашних условиях.
5-фторурацил (5-ФУ), 5%-ная мазь/крем – противоопухолевый препарат из группы антиметаболитов, антагонистов пиримидинов. Может применяться при поверхностно-распространяющемся БКРК. Схема лечения: местно, два раза в день в течение 11 недель. Через три недели терапии отмечается до 90% полного лечебного патоморфоза. Однако систематических данных о частоте отдаленных рецидивов нет [10]. В России данная форма выпуска 5-ФУ не зарегистрирована.
Имиквимод, 5%-ный крем (ЛП-001612, 28.03.2012) – модификатор иммунного ответа, который стимулирует TLR-7 рецепторы на иммунных клетках, активируя неспецифический иммунный ответ и воспаление в зоне опухоли. Эффективен при поверхностно-распространяющемся БКРК небольших размеров вне зон высокого риска у иммунокомпетентных больных. Схема лечения: местно, пять дней в неделю до 6–12 недель. Частота рецидивов при пятилетнем наблюдении для первичного БКРК: при шестинедельной терапии – 22,1%, при 12-недельной – 19,1% [11]. В некоторых странах зарегистрированы и другие препараты для местного применения (ингенол мебулат, курадерм).
Системная лекарственная терапия может применяться при неоперабельном местно-распространенном (мрБКР) и/или метастатическом БКР (мБКР) либо в неоадъювантном режиме и заключается в ингибировании сигнального пути Hh.
Клинические исследования висмодегиба
Первой малой молекулой – ингибитором сигнального пути Hh стал GDC-0449 (висмодегиб), блокирующий Smo. Этот препарат уже в клинических исследованиях I фазы продемонстрировал высокую эффективность в лечении мрБКР и мБКР с частотой объективных ответов (ЧОО) 57,6% у 19 больных из 33 [12].
Эффективность ингибирования сигнального пути Hh в лечении мрБКР и мБКР была подтверждена в международном многоцентровом клиническом исследовании II фазы ERIVANCE. На основании результатов этого исследования висмодегиб в 2012 г. был одобрен FDA (Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США), а в 2013 г. – EMEA (European Medicines Agency – Европейское агентство лекарственных средств). В России висмодегиб был зарегистрирован 26.09.2013 (ЛП-002252).
В исследовании ERIVANCE участвовали 104 пациента с неоперабельным БКР, из них мрБКР имел место у 71 больного, мБКР – у 33 больных. Все пациенты получали терапию висмодегибом 150 мг внутрь ежедневно до прогрессирования заболевания. О неоперабельном БКР говорят в том случае, если имеется опухоль с двумя и более рецидивами или опухоль, при которой проведение операции и лучевой терапии приведет к выраженному дефекту и деформации вплоть до потери органа из-за глубокой инвазии, больших размеров и/или локализации, прежде всего в области глаз и ушей, а также волосистой части головы. Дизайн исследования не предусматривал наличие контрольной группы из-за отсутствия стандартного метода лечения такой категории пациентов. Основная цель исследования заключалась в оценке эффективности (ЧОО по критериям RECIST1.0), которая подтверждалась независимым комитетом. Кроме того, оценивалась активность сигнального пути Hh в архивных образцах опухоли путем определения уровня экспрессии GLI1 andPtch2. При этом опухолевый материал был доступен у 76% пациентов (таблица) [13].
При более длительном наблюдении медиана выживаемости без прогрессирования (ВБП) на фоне терапии висмодегибом составила 12,8 месяца. При этом медиана продолжительности ответа у больных мрБКР достигла 26,2 месяца, а при мБКР – 14,8 месяца [14].
Наиболее распространенными нежелательными явлениями (НЯ) были мышечные спазмы, алопеция, дисгевзия, снижение веса, утомляемость, тошнота, снижение аппетита, диарея. Большинство из них достигало 1–2-й степени. Серьезные НЯ отмечались у 26 (25%) пациентов. У 13 (12%) больных лечение было прекращено из-за токсичности. Несмотря на эффективность лечения, некоторые пациенты прекращали прием висмодегиба по собственному желанию вследствие длительных НЯ низкой степени, например дисгевзии (расстройство вкуса) или мышечных спазмов, что могло быть обусловлено влиянием на качество жизни [13].
В опухолевых образцах уровень экспрессии Ptch2 и GLI1 был достоверно выше, чем в нормальной коже [13].
В клиническом международном многоцентровом исследовании II фазы STEVIE, которое было приближено к реальным условиям, оценивали главным образом безопасность висмодегиба. Дополнительные цели заключались в оценке эффективности висмодегиба в лечении больных неоперабельным БКР (мрБКР (n = 1119) и мБКР (n = 96)). Кроме того, анализировали влияние препарата на качество жизни больных. Лечение висмодегибом проводили в стандартной дозе (150 мг внутрь ежедневно) до прогрессирования заболевания или неприемлемой токсичности.
Нежелательные явления включали мышечные спазмы (66,4%), алопецию (61,5%), дисгевзию (54,6%), снижение веса (40,6%) и аппетита (24,9%), астению (24,0%), тошноту (17,9%) и агевзию (17,5%). Серьезные НЯ наблюдались у 289 (23,8%) пациентов.
По данным первичного анализа, ЧОО (оценка исследователями согласно критериям RECIST 1.1) при мрБКР и мБКР составила 68,5 и 37% соответственно. Медиана продолжительности ответа достигла 23 месяцев. Медиана ВБП составила 23,3 месяца при мрБКР и 13,1 месяца при мБКР.
Исследование STEVIE – самое крупное в мире у этой редкой категории пациентов. Полученные результаты подтверждают профиль безопасности и высокую эффективность висмодегиба.
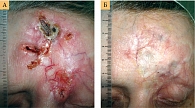
Висмодегиб также может быть использован в неоадъювантном режиме при БКР высокого риска в эстетически значимых зонах [15] и мрБКР с целью уменьшения объема хирургического вмешательства и травматизма (рисунок). При этом 12-недельная терапия операбельного БКР только в 42–50% случаев обеспечивает полный лечебный патоморфоз [16].
Клинические исследования сонидегиба
Сонидегиб – еще один препарат, ингибирующий Smo, который также продемонстрировал эффективность и безопасность в терапии мрБКР и мБКР. Сонидегиб был одобрен FDA и EMEA в 2015 г. на основании результатов рандомизированного клинического исследования II фазы BOLT. В исследовании участвовали 230 больных неоперабельным мрБКР и мБКР, которые получали терапию сонидегибом в двух дозовых режимах: 200 мг (n = 79) и 800 мг (n = 151) внутрь ежедневно до прогрессирования заболевания или неприемлемой токсичности. Эффективность оценивали с помощью ЧОО (независимая оценка исходя из модифицированных критериев RECIST (для мрБКР) и RECIST 1.1 (для мБКР)). Препарат в дозе 200 мг продемонстрировал эффективность в 58% случаев, в дозе 800 мг – в 45% случаев. Как оказалось, повышение дозы сонидегиба не увеличивает эффективность лечения. Именно поэтому 200 мг были выбраны в качестве эффективной дозы. Нежелательные явления на фоне терапии включали мышечные спазмы (54%), алопецию (53%), дисгевзию (46%), слабость (41%), тошноту (39%), боли в костях и мышцах (32%), диарею (32%), снижение веса (30%) и аппетита (23%). Самыми частыми НЯ 3–4-й степени были слабость (4%), мышечные спазмы (3%), уменьшение веса (3%), боли в костях и мышцах, головная боль, тошнота, диарея, рвота и снижение аппетита (по 1% для каждого НЯ) [17]. В России сонидегиб пока не зарегистрирован.
Перерывы в лечении ингибиторами Smo
Для препаратов этой группы характерны особенные НЯ, которые в большинстве случаев не превышают 1–2-й степени, но продолжаются весь период лечения и способны влиять на качество жизни больных. При этом специфических мер терапии НЯ не существует, а симптоматическая терапия малоэффективна. Единственный способ приостановить указанные НЯ – прервать лечение. Подобные перерывы существенно не влияют на эффективность противоопухолевой терапии. Так, данные эксплоративного анализа результатов исследования STEVIE показали, что у больных распространенным БКР без перерыва в лечении висмодегибом, с одним, двумя и тремя перерывами, обусловленными НЯ, ЧОО составила 61, 65, 95 и 85% соответственно. Медиана ВБП достигла 19,8 и 19,0 месяца у больных в отсутствие перерыва или с одним перерывом в лечении, а при трех-четырех перерывах медиана ВБП не была достигнута [18].
Заключение
Новые таргетные препараты, ингибирующие сигнальный путь Hh, который патологически активен в 90% случаев БКР, расширили возможности лечения распространенного БКР. Тем не менее неразрешенной остается проблема первичной и приобретенной резистентности к ингибиторам Smo.
Ожидается появление новых ингибиторов сигнального пути Hh, среди которых саридегиб, XL139, LEQ506 (второе поколение Smo-ингибиторов), PF-04449913 и др. Эти препараты находятся на разных стадиях исследования при различных злокачественных опухолях. Изучаются дополнительные сигнальные пути, которые в той или иной мере могут быть задействованы в патогенезе БКР (Notch, Wnt) [19, 20].
N.N. Petenko
N.N. Blokhin Russian Cancer Research Center
Contact person: Nataliya Nikolayevna Petenko, n.petenko@gmail.com
Drug therapy of skin basal cell carcinoma (BCC) includes a set of topical and systemic drugs. Systemic drug therapy is based on inhibition of pathlogically active Sonic hedgehog (Hh) signaling pathway by using modern targeted drugs, which are efficient in irresectable BCC (locally advanced and/or metastatic BCC). Moreover, use of such drugs may be possible in non-adjuvanted protocol in order to reduce volume of surgery and traumatism.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.