Эритропоэтины длительного действия в лечении нефрогенной анемии
- Аннотация
- Статья
- Ссылки
Анемия относится к модифицируемым факторам риска сердечно-сосудистых осложнений у больных хронической болезнью почек (ХБП). Коррекция анемии, особенно ранняя, еще на додиализном этапе, не только улучшает качество жизни больных, но и может замедлить прогрессирование ХБП и предупредить сердечно-сосудистые осложнения на этапе регулярного гемодиализа (ГД) [1–8]. В этой связи коррекция нефрогенной анемии остается важным и обязательным компонентом лечения больных ХБП.
Стандартная практика ведения анемии при ХБП претерпела значительные изменения после опубликования в 2007 г. пересмотренных рекомендаций рабочей группы National Kidney Foundation-Kidney Disease Outcomes Quality Initiative (NKF-KDOQI). Согласно новым данным, целевой уровень гемоглобина (Hb) почечных больных, получающих препараты, стимулирующие эритропоэз (erythropoiesis stimulating agents, ESAs), в целом должен составлять 11–12 г/дл (не более 13,0 г/дл), «поскольку возможности причинения вреда от высокого Нb превышают потенциальную пользу от улучшения качества жизни и снижения частоты трансфузий» [8–13]. Длительно существующий низкий уровень Hb (< 11 г/дл) до начала применения эпоэтина, а также продолжительный период достижения целевого уровня Hb 11–12 г/дл увеличивает риск госпитализаций и летального исхода [14–23]. Однако, по мнению большинства исследователей, значительную трудность представляет удержание пациентов в узком коридоре целевого Hb [15, 24–29]. Именно поэтому важной задачей терапии анемии у больных ХБП является уменьшение колебаний (вариабельности) фактического уровня гемоглобина от оптимального целевого диапазона уровня Hb в сторону как снижения, так и повышения.
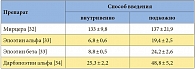
Одним из подходов к решению этой задачи может быть применение эпоэтинов длительного действия, в частности нового представителя эпоэтинов – активатора рецепторов эритропоэтина длительного действия (метоксиполиэтиленгликоль) – эпоэтина бета (препарат Мирцера). Препарат третьего поколения Мирцера отличается от стимулятора эритропоэтина короткого действия эпоэтина бета наличием более длинной полимерной цепочки в структуре своей молекулы [30]. По молекулярной массе Мирцера примерно в 2 раза превосходит стандартный эритропоэтин. Пониженное сродство к рецепторам эритропоэтина и более длительное взаимодействие с ними обеспечивают постоянную стимуляцию эритропоэза. Мирцера характеризуется самым длительным периодом полувыведения среди всех ESAs (табл.) [31–34], что позволяет увеличить интервал дозирования и приводит к плавному росту уровня Hb и его стабильному контролю на фоне поддерживающей терапии. Следует отметить, что внутривенные и подкожные введения препарата биоэквивалентны.
При терапевтических концентрациях стимуляторов эритропоэза короткого действия возможно насыщение рецепторов эритропоэтина; при этом не обязательно происходит активация дополнительных рецепторов. За счет короткого периода выведения несвязанные молекулы эпоэтина быстро удаляются из организма, не оказывая воздействия на рецепторы. Кроме того, внутриклеточный ответ на эритропоэтины продолжается в течение нескольких минут после освобождения лигандов из комплекса с рецепторами, поэтому для стимуляции эритропоэза стойкое связывание с рецепторами не требуется [35]. В то же время длительный период полувыведения и особенности взаимодействия с рецепторами препарата Мирцера обеспечивают более продолжительный эффект по сравнению с эпоэтинами короткого действия, определяя более высокую общую активность Мирцеры в лечении нефрогенной анемии.
Эффективность Мирцеры в лечении анемии у больных с ХБП изучалась в 4 исследованиях II фазы и 6 исследованиях III фазы. В целом в эти исследования, проводившиеся в 369 центрах Европы (в том числе в РФ), Америке, Азии, Африке, Австралии и Новой Зеландии, были включены 2700 пациентов, среди которых 1789 получали Мирцеру [36–47]. Полученные данные исследований II фазы позволили выбрать стартовые дозы для исследований III фазы и подтвердили возможность введения препарата с длительными интервалами. Результаты 6 открытых рандомизированных исследований III фазы показали безопасность и эффективность подкожного и внутривенного применения препарата Мирцера с кратностью введения до 1 раза в месяц как в фазу коррекции (ARCTOS, AMICUS) [34, 46], так и поддерживающей терапии анемии (MAXIMA, PROTOS, STRIATA, RUBRA).
С целью изучения эффективности препарата Мирцера в сравнении с другими стимуляторами эритропоэза в исследовании AMICUS пациенты контрольной группы получали эпоэтин альфа или эпоэтин бета, а в исследовании ARCTOS – дарбэпоэтин альфа. Эффективность препарата Мирцера (1 раз в 2 недели) при коррекции анемии у диализных больных и больных на додиализном этапе подтверждена высокой частотой ответа на лечение – 97,5% в исследовании ARCTOS и 93,3% в исследовании AMICUS. В течение первых 8 недель исследования ARCTOS доля пациентов, у которых отмечалось повышение уровня Hb более 13,0 г/дл, в группе дарбэпоэтина альфа была намного выше, чем в группе Мирцеры (соответственно 33,5% и 12,4%; p < 0,0001). Различия сохранялись на протяжении фазы подбора дозы и оценки ответа на лечение. В течение 28 недель доля пациентов, у которых отмечено повышение уровня Hb более 13,0 г/дл, составила 80,6% и 67,7% в группах соответственно (p < 0,0082) [30]. Следовательно, применение Мирцеры позволяло у большего числа больных поддерживать уровень Hb в узком целевом диапазоне 11–12 мг/дл.
В исследованиях MAXIMA, PROTOS, STRIATA, RUBRA подтверждено, что поддерживающая терапия препаратом Мирцера в течение года по эффективности не уступает применению других стимуляторов эритропоэза и позволяет удерживать уровень Hb в пределах целевых значений у больных с ХБП [30, 48].
При прямом переходе с эритропоэтинов короткого действия на лечение стимулятором эритропоэза длительного действия Мирцера удавалось сохранить стабильный уровень Hb, при этом число инъекций Мирцеры могло составлять 12 в год. При анализе подгрупп было установлено, что внутривенное или подкожное введение препарата Мирцера при введении один раз в месяц обеспечивает стабильный контроль Hb, который не зависит от возраста, пола, способа введения предшествующих стимуляторов эритропоэза и наличия сахарного диабета [18, 30, 37]. Способность препарата Мирцера восстанавливать и поддерживать стабильный уровень Hb у больных с различными стадиями ХБП в сочетании с уменьшением кратности введения препарата обеспечивает предсказуемый контроль его уровня и упрощает лечение анемии для врачей и пациента.
По безопасности препарат Мирцера сопоставим с другими стимуляторами эритропоэза. В клинических исследованиях частота и характер нежелательных явлений были сходными при применении Мирцеры и эпоэтина альфа, эпоэтина бета и дарбэпоэтина альфа [30]. Большинство нежелательных реакций при лечении Мирцерой по сравнению с эпоэтином бета были легкими или умеренными: артериальная гипертония (у 13% и 14% пациентов соответственно), диарея (у 11% и 11% пациентов), назофарингит (у 11% и 10%). Частота серьезных нежелательных явлений при лечении препаратом Мирцера была несколько ниже, чем в группе сравнения (соответственно 37% и 40%) [30]. В то же время на фоне лечения Мирцерой относительно чаще встречались пневмония (соответственно 2,4% и 3,1%) и инфаркт миокарда (1,7% и 1,9%).
В соответствии с рекомендациями по применению стимулятора эритропоэза длительного действия Мирцера, во время лечения следует постоянно мониторировать артериальное давление, добиваясь его контроля [34]. Пациентов целесообразно информировать о важности регулярного приема гипотензивных препаратов и соблюдения диеты. Если артериальное давление плохо контролируется с помощью медикаментозных и немедикаментозных методов, то следует снизить дозу препарата Мирцера или отменить его [49]. В клинических исследованиях препарата Мирцера примерно у 27% больных на додиализном этапе ХБП и 26% больных, получавших лечение диализом, потребовалось усилить гипотензивную терапию. У некоторых больных с ХБП при лечении препаратом Мирцера, как и другими стимуляторами эритропоэза, развивались гипертоническая энцефалопатия и/или судороги [30, 36, 37].
Безопасность препарата Мирцера в достаточной мере не оценена у больных с гемоглобинопатиями, кровотечениями, судорожным синдромом, числом тромбоцитов > 500 × 10⁹/л, активностью системного заболевания, опухолями, поэтому в таких случаях следует соблюдать осторожность при применении препарата [34].
По данным U. Sauressing и соавт., опубликованным в 2007 г. [50], стоимость лечения анемии препаратами короткого действия (инъекции 3 р/нед) в центре гемодиализа Германии составляла в среднем 17 000€/100 больных, в Великобритании – 18 379£/100 больных (без учета стоимости эпоэтинов). Было рассчитано, что в случае замены эпоэтинов короткого действия стимулятором эритропоэза длительного действия Мирцера (инъекции 1 р/мес) расходы на лечение анемии в центре гемодиализа Германии могли бы снизиться на 58%, а в Великобритании – на 35%.
Таким образом, Мирцера – это единственный препарат, который может вводиться один раз в месяц, обеспечивая стабильный и стойкий контроль уровня Hb независимо от предыдущего применения других стимуляторов эритропоэза. В фазу коррекции введение препарата Мирцера каждые две недели приводило к плавному и постоянному росту уровня Hb, целевые значения достигались у 97,5% пациентов. У больных, получавших стимуляторы эритропоэза короткого действия, установлена возможность прямого перехода на применение Мирцеры 1 раз в месяц. При этом стабильный контроль уровня Hb отмечался как при внутривенном, так и при подкожном введении препарата вне зависимости от возраста и пола больных и сопутствующих заболеваний. В клинических исследованиях переносимость препарата Мирцера пациентами с ХБП была хорошей, причем профиль безопасности был сопоставим с таковым эпоэтинов альфа, бета и дарбэпоэтина альфа. Возможность стабильного контроля уровня Hb при снижении числа инъекций дает преимущество препарату Мирцера перед другими препаратами, стимулирующими эритропоэз, в лечении анемии у пациентов. Кроме того, сокращение числа инъекций позволяет освободить время медперсонала, снизить риск инъекционных осложнений, повысить качество жизни больных и способствовать замедлению темпов прогрессирования ХБП. Применение препарата Мирцера в лечении анемии у больных различными стадиями ХБП с анемией дает возможность в конечном счете уменьшить затраты на лечение.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.