Функциональные нарушения желчевыводящих путей у детей с периодической болезнью
- Аннотация
- Статья
- Ссылки
- English


Периодическая болезнь (ПБ), или семейная средиземноморская лихорадка, которая в основном наблюдается у народов средиземноморского бассейна (армяне, евреи и арабы), до недавнего времени считалась редкой патологией. Последние годы наметилась тенденция к росту заболеваемости и расширению географии распространенности ПБ, вероятно за счет увеличения числа смешанных браков и миграции населения [1, 2].
Периодическая болезнь (синонимы: семейная средиземноморская лихорадка, армянская болезнь, пароксизмальный синдром Джейнуэя – Мозенталя, периодический перитонит, синдром Реймана, болезнь Сигала – Маму) – наследственное аутосомно-рецессивное заболевание, проявляющееся периодически рецидивирующим серозитом и часто развивающимся амилоидозом. Первое упоминание о ПБ относится к 1908 г. Тогда был описан случай повторяющихся приступов лихорадки, абдоминальных болей и лейкоцитоза у 16-летней еврейской девушки [1, 2]. Сегодня, исходя из базы данных орфанных болезней [3], в мире этим заболеванием страдают свыше 100 000 пациентов [1].
В начале 1990-х гг. M. Pras и E.N. Hevi обнаружили, что ген, ответственный за развитие ПБ, локализован на коротком плече 16-й хромосомы (ген MEFV). Ген состоит из десяти экзонов и кодирует белок пирин [4]. Пирин является регулятором ответа на воспаление на уровне организации цитоскелета лейкоцитов. Кроме того, у пациентов с ПБ снижается уровень экспрессии некоторых классов генов, вовлеченных в процессы регуляции транскрипции, апоптоза, воспаления и структурного развития мышечных клеток [4]. Ген MEFV экcпрессируется в основном в нейтрофилах, эозинофилах и моноцитах, дендритных клетках, синовиальных фибробластах, но не В-лимфоцитах [2, 5]. Ключевую роль в развитии приступов ПБ играет гиперпродукция интерлейкина (ИЛ) 1-бета. Во время приступов также увеличиваются сывороточные показатели ИЛ-6, фактора некроза опухоли (ФНО) альфа, растворимых рецепторов белков 55 и 75 ФНО, растворимого рецептора ИЛ-2. Более того, вне обострения у пациентов с ПБ повышаются сывороточные уровни ИФН-гамма, экспрессия мРНК ИЛ-1-бета, ИЛ-6 и ИЛ-8 в циркулирующих лейкоцитах, что может указывать на непрерывное субклиническое воспаление [1, 5].
Клинически ПБ проявляется возникающими через определенные интервалы (дни, недели, месяцы) стереотипными приступами лихорадки, которые существенно влияют на качество жизни пациентов. Лихорадке нередко сопутствуют болевые синдромы, связанные с неспецифическим воспалением в серозных и синовиальных покровах. Самый частый из них асептический перитонит [2]. Частота и длительность приступов различны. Может наблюдаться несколько приступов в неделю длительностью до 72 часов. Подобное течение болезни ухудшает качество жизни пациентов с ПБ, иногда приводит к неоправданным оперативным вмешательствам.
Материал и методы
Нами обследовано 66 пациентов в возрасте от четырех до 18 лет (40 (61%) мальчиков и 26 (39%) девочек) с абдоминальной формой периодической болезни. Средний возраст больных составил 10,2 ± 1,0 года, средний возраст манифестации болезни – 2,9 ± 0,6 года. 39 детей находились в приступном периоде болезни, 27 – вне приступа.
Анализ сочетания мутантных аллелей показал, что чаще встречались компаунд-гетерозиготы – 26 (39,3%) больных и гомозиготы – 23 (34,8%). Самой малочисленной была подгруппа с гетерозиготными мутациями гена MEFV – 17 (25,8%) детей. Распределение по полу среди пациентов с гомозиготными мутациями было приблизительно одинаковым: 56,5% – мальчики, 43,5% – девочки. В остальных подгруппах превалировали пациенты с ПБ мужского пола: компаунд-гетерозиготы – 65,4% мальчиков и 34,6% девочек, гетерозиготы – 70,5% мальчиков и 29,4% девочек.
Всем детям с ПБ было проведено комплексное обследование с целью оценки состояния желчевыводящих путей и выявления синдрома холестаза. Данное обследование включало:
- оценку жалоб;
- сбор анамнеза;
- физикальное обследование;
- клинический анализ крови;
- биохимический анализ крови для определения показателей общего билирубина, трансаминаз, щелочной фосфатазы;
- ультразвуковое исследование (УЗИ) желчного пузыря с желчегонным завтраком, в качестве которого использовался Хофитол в дозе 3 или 5 мл в зависимости от возраста больного.
28 больным с выявленными фиксированными деформациями желчного пузыря УЗИ с желчегонным завтраком не проводили. При оценке результатов сокращения желчного пузыря на фоне применения Хофитола в качестве желчегонного завтрака учитываются значения объемного расхода выделенной желчи и времени выделения желчи [6].
Математическая обработка результатов исследования проводилась с помощью пакета программ прикладной статистики Мicrosoft Excel 2010 «Пакет анализа», Statistica 6.1, Medcalc (9.1.0.1). Уровень статистической значимости при проверке нулевой гипотезы считали соответствующим p ≤ 0,05.
Результаты и обсуждение
Пациенты с ПБ как во время приступа, так и вне его предъявляют различные жалобы со стороны желудочно-кишечного тракта (ЖКТ) [2, 7]. Нами была проанализирована частота таких жалоб. Самыми частыми были рвота – 33,3% случаев, разжиженный стул – 24,2%. Редко отмечались метеоризм – 1,5% случаев, изжога и снижение аппетита – 3,0%. Тошнота зафиксирована в 16,7% случаев, отрыжка и запоры – в 6,1%. Кроме того, установлено, что 20% больных в анамнезе имели оперативные вмешательства на брюшной полости.
В исследовании были определены средние уровни общего билирубина, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и щелочной фосфатазы (ЩФ) в подгруппах детей с ПБ во время приступа и вне его (табл. 1). Средние уровни общего билирубина практически не отличались у детей с ПБ во время приступа и вне его. Средний уровень АЛТ был несколько выше в подгруппе больных вне приступа. У детей вне приступа также имели место статистически более высокие уровни АСТ и ЩФ.
Была проанализирована связь мутаций гена MEFV и уровней общего билирубина, АСТ, АЛТ и ЩФ (табл. 2). Как видим, средние показатели общего билирубина и ЩФ были практически одинаковыми в подгруппах детей с ПБ. Средние уровни АСТ и АЛТ оказались статистически выше в подгруппах гетерозигот и компаунд-гетерозигот.
При корреляционном анализе методом Спирмена выявлена прямая умеренная связь средних уровней АСТ с длительностью заболевания у всех детей с ПБ (r = 0,49; p < 0,001).
При УЗИ органов брюшной полости у 28 (42,4%) больных обнаружены фиксированные перегибы желчного пузыря. Их частота при гетерозиготных мутациях (62,5% случаев) статистически значимо превышала таковую при гомозиготных (41,7% случаев; р < 0,05) и компаунд-гетерозиготных мутациях (30,8% случаев; р < 0,05).
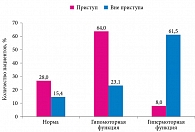
Из 38 детей, которым было проведено УЗИ желчного пузыря с желчегонным завтраком (Хофитол), 25 находились в периоде приступа ПБ, 13 больных – вне приступа. В качестве показателя, характеризующего функцию желчного пузыря, мы использовали минутный объем выделенной желчи. В зависимости от величины этого показателя были получены следующие данные (рисунок). Нормальная функция желчного пузыря (минутный объем выделенной желчи 0,13–0,24 мл/мин) зафиксирована у 28,0% детей с ПБ во время приступа и 15,4% больных вне приступа. Гипомоторная функция желчного пузыря определялась при минутном объеме выделенной желчи менее 0,13 мл/мин и статистически чаще встречалась у детей во время приступа ПБ (64,0%) по сравнению с детьми вне приступа (23,1%; р < 0,01). Гипермоторная функция желчного пузыря определялась при минутном объеме выделенной желчи более 0,24 мл/мин и статистически чаще регистрировалась у детей вне приступа ПБ (61,5% случаев), чем у детей во время приступа (8,0% случаев; р < 0,001).
При ПБ основным направлением терапии считается назначение колхицина. Между тем не менее важным критерием эффективности терапии ПБ у детей является купирование приступов боли в животе – ключевого признака абдоминального синдрома, нередко определяющего качество жизни пациентов [8, 9]. Для этих целей в гастроэнтерологической практике успешно используют селективные холинолитики. К препаратам данной группы относится гиосцина бутилбромид (Бускопан), характеризующийся высокой степенью аффинности, преимущественно к М3-рецепторам, локализованным в гладкомышечных клетках ЖКТ, желчного и мочевого пузыря. Препарат распределяется главным образом в мышечных клетках органов брюшной полости и малого таза, а также интрамуральных ганглиях органов брюшной полости [9].
Детям, у которых выявлены функциональные нарушения желчевыводящих путей по данным УЗИ с желчегонным завтраком, и больным с фиксированными перегибами мы проводили медикаментозную коррекцию селективным спазмолитическим препаратом Бускопан. Детям старше шести лет препарат назначали по одной таблетке три раза в сутки в течение двух недель. Всего терапию препаратом Бускопан получили 49 больных с ПБ: 28 детей – во время приступа ПБ, 21 – вне приступа. Эффективность терапии оценивали по уменьшению абдоминального болевого синдрома, болезненности в точке желчного пузыря, снижению уровней общего билирубина и ЩФ. Достоверное уменьшение болевого абдоминального синдрома отмечалось более чем в 50% случаев (p < 0,05). Уменьшение болезненности в точке желчного пузыря зафиксировано также более чем у половины больных с гипермоторными и гипомоторными дискинезиями желчного пузыря (p < 0,05). Уровни общего билирубина и ЩФ в крови достоверно снизились только у пациентов с ПБ во время приступа при гипомоторной дискинезии желчного пузыря (33,3% случаев; р < 0,05). Уровень общего билирубина достоверно уменьшился у детей вне приступа ПБ с гипермоторной дискинезией желчного пузыря – 62,5% случаев (р < 0,05). При фиксированных перегибах желчного пузыря достоверное снижение уровней общего билирубина отмечалось у больных во время и вне приступа – более 50% случаев (p < 0,05).
Заключение
Как показали результаты проведенного исследования, у детей с ПБ помимо абдоминального болевого синдрома нередко присутствуют жалобы со стороны ЖКТ (рвота, разжиженный стул), свидетельствующие о нарушении моторики. У больных, находящихся вне приступа ПБ, отмечается умеренное повышение активности АСТ и ЩФ. Длительность заболевания также коррелирует с повышением активности АСТ.
Из сказанного следует, что пациенты с ПБ, даже вне приступа, должны систематически наблюдаться у специалистов. Моторные нарушения желчевыводящих путей (гипомоторные в период приступа, сменяющиеся гипермоторными вне приступа) могут усиливать абдоминальный болевой синдром. Для успешного купирования абдоминального синдрома у детей старше шести лет в комплексе с базисной терапией колхицином может быть рекомендован препарат Бускопан в таблетированной форме.
S.B. Krutikhina, Ye.V. Borisova, A.V. Gorelov
I.M. Sechenov First Moscow State Medical University
Central Research Institute of Epidemiology of the Federal Service of Customers’ Rights Protection and Human Well-Being Surveillance (Rospotrebnadzor)
Contact person: Svetlana Borisovna Krutikhina, svetulkakru@gmail.com
Clinical, functional and laboratory examination of the biliary tract condition of 66 children with Familial Mediterranean fever (FMF) during the attack and out of it was made. The children were divided into subgroups depending on the stage of the disease (attack and outside attack). In addition, children were divided into subgroups depending on the combination of mutant alleles (homozygotes, compound heterozygotes and heterozygotes), without taking in account the period of the disease. Children outside the attack showed higher rates of aspartate aminotransferase (AST) and alkaline phosphatase. The connection of AST levels and duration of the disease was found. As well hypomotor disorders of the biliary tract during the attack and outside the attack – hypermotor were revealed. The algorithm of the biliary tract functional disorders therapy in children with FMF was offered.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.